
- •Лекции по курсу биохимия и молекулярная биология для студентов направления биология
- •Оглавление
- •Введение
- •Модуль 1. Статическая биохимия
- •Лекция 1
- •Строение, свойства, биологическая роль
- •Моно – и олигосахаридов
- •Классификация углеводов
- •Моносахариды
- •Стереоизомерия моносахаридов
- •Представители моносахаридов
- •Олигосахариды
- •Отдельные представители дисахаридов
- •Лекция 2 строение, свойства, биологическая роль
- •Отдельные представители полисахаридов
- •Лекция 3 строение, свойства, биологическая роль простых липидов
- •Классификация
- •Стероиды
- •Желчные кислоты
- •Лекция 4 строение, свойства, биологическая роль сложных липидов
- •Лекция 5 аминокислотный состав белков Белки и их функции
- •Функции белков
- •Элементарный состав белков
- •Методы выделения и очистки белков
- •Аминокислотный состав белков
- •Химические свойства аминокислот
- •Классификация аминокислот, заменимые и незаменимые аминокислоты
- •Лекция 6 уровни структурной организации белков Структурная организация белков
- •Первичная структура белка: методы исследования. Структурные особенности пептидной связи
- •Номенклатура пептидов и полипептидов. Природные пептиды: глутатион, карнозин, ансерин, грамицидин s, окситоцин, энкефалины
- •Отдельные представители пептидов
- •Вторичная структура белков: -спираль, ее основные характеристики, -структура, -изгиб. Роль водородных связей в формировании вторичной структуры. Сверхвторичные (надвторичные) структуры белка
- •Третичная структура белков. Типы нековалентных связей, стабилизирующих третичную структуру. Роль s-s-мостиков в формировании третичной структуры некоторых белков
- •Заимодействия между субъединицами, стабилизирующие четвертичную структуру. Функциональное значение четвертичной структуры белков
- •Лекция 7
- •Физико-химические свойства белков
- •Ионизация, гидратация, растворимость,
- •Осмотические и онкотические свойства, оптические свойства
- •Молекулярная масса и размеры белков. Методы определения молекулярной массы белков. Необходимость применения комплекса методов для точной оценки молекулярной массы белков
- •Денатурация белков
- •Лекция 8 классификация белков. Простые и сложные белки Принципы классификации белков
- •Фибриллярные белки
- •Глобулярные белки
- •Сложные белки
- •Липопротеины
- •Гликопротеины
- •Протеогликаны
- •Фосфопротеины
- •Металлопротеины
- •Нуклеопротеины
- •Хромопротеины
- •Гемоглобин
- •Миоглобин
- •Цитохромы электронтранспортной цепи
- •Хлорофиллы
- •Флавопротеины
- •Лекция 9 сложные белки Гликопротеины
- •Фосфопротеины
- •Липопротеины
- •Металлопротеины
- •Лекция 10 строение, свойства, биологическая роль нуклеотидов
- •Циклические нуклеотиды
- •Лекция 11 строение, свойства, биологическая роль нуклеиновых кислот
- •Рибосомальные рнк
- •Лекция 12 витамины – биологическая роль, классификация. Водорастворимые витамины
- •Витамин в1 (тиамин)
- •Витамин в2 (рибофлавин)
- •Витамин в3 (рр, никотиновая кислота, никотинамид)
- •Витамин в5 (пантотеновая кислота)
- •Витамин в6 (пиридоксин, пиридоксаль, пиридоксамин)
- •Витамин в9 (фолиевая кислота)
- •Витамин в12 (кобалами)
- •Витамин н (биотин)
- •Витамин с (аскорбиновая кислота)
- •Витамин р (рутин)
- •Лекция 13 жирорастворимые витамины Витамин а (ретинол)
- •Витамин d (кальциферол)
- •Витамин е (токоферол)
- •Витамин к (нафтохинон)
- •Лекция 14
- •Ферменты – строение: свойства, механизм действия
- •Понятие о ферментах.
- •Сущность явлений ферментативного катализа
- •Структурная организация ферментов
- •3. Роль металлов в регуляции aктивности ферментов
- •Изоферменты: биологическая роль
- •Механизм действия ферментов
- •Специфичность действия ферментов
- •Стационарная кинетика ферментативных реакций
- •Концентрация субстрата
- •Концентрация фермента
- •Температура
- •Уравнение Михаэлиса-Ментен
- •Единицы ферментов
- •Лекция 15
- •Ингибиторы ферментов
- •Регуляция каталитичекой активности ферментов
- •Изостерическая регуляция
- •Аллостерический контроль активности ферментов
- •Регуляция ферментов ковалентной модификацией
- •Регуляция ферментов ограниченным протеолизом (активация зимогенов)
- •Регуляция активности мультиэнзимных комплексов
- •Классификация и номенклатура ферментов
- •Характеристика отдельных классов ферментов
- •Ферменты в клинической диагностике. Энзимопатии
- •Модуль II. Динамическая биохимия
- •Катаболические, анаболические, амфиболические пути
- •Метаболизм углеводов
- •Расщепление углеводов в пищеварительном тракте
- •Переваривание углеводов в ротовой полости
- •Переваривание углеводов в кишечнике
- •Амилолитические ферменты: характеристика Панкреатическая -амилаза
- •Сахаразо-изомальтазный комплекс
- •Гликоамилазный комплекс
- •Трегалаза
- •Всасывание моносахаридов в тонком кишечнике и их дальнейший транспорт. Глюкозные транспортеры
- •Всасывание моносахаридов в кишечнике
- •Транспорт глюкозы из крови в клетки
- •Лекция 17
- •Анаэробный катаболизм углеводов
- •Анаэробное окисление глюкозы. Гликолиз. Внутриклеточная
- •Локализация процесса
- •Отдельные реакции гликолиза, их термодинамические характеристики. Образование 2,3-дифосфоглицерата в шунте Рапопорта-Люберинга
- •Расщепление гликогена (гликогенолиз). Строение, механизм действия и регуляция гликогенфосфорилазы
- •Спиртовое и молочнокислое брожение
- •Лекция 18
- •Аэробный катаболизм углеводов (часть 1)
- •Аэробный метаболизм пирувата. Митохондрии: структура
- •И энергетические функции
- •Окислительное декарбоксилирование пирувата. Строение
- •Цикл лимонной кислоты. Отдельные реакции цикла, их термодинамическая характеристики. Суммарное уравнение окисления ацетил-CоА в цикле Кребса
- •Лекция 19
- •Аэробный катаболизм углеводов (часть 2)
- •Регуляция цикла Кребса на уровне цитратсинтазы,
- •Изоцитратдегидрогеназы и -кетоглутаратдегидрогеназного комплекса
- •Амфиболическое значение цикла Кребса. Необходимость анаплеротических путей, пополняющих запас компонентов, участвующих в цикле
- •Зависимое от атp и биотина карбоксилирование пирувата: анаплеротический путь синтеза оксалоацетата
- •Пентозофосфатный путь (гексозомонофосфатный шунт)
- •Отдельные реакции пфп, их термодинамические характеристики.
- •Суммарное уравнение пентозофосфатного пути.
- •Регуляция пентозофосфатного пути на уровне
- •Глюкозо-6-фосфатдегидрогеназы
- •Участки перекреста пфп с гликолизом
- •Циклический характер пфп
- •Лекция 20 биосинтез углеводов
- •Глюконеогенез
- •В последующей реакции, катализируемой ферментом фосфоенолпируваткарбоксикиназой, из оксалоацетата образуется фосфоенолпируват. Реакция Mg2-зависимая и донором фосфата служит gtp.
- •Лекция 21 расщепление пищевых и тканевых липидов
- •Катаболизм липидов
- •Всасывание продуктов расщепления липидов
- •Транспорт липидов
- •Метаболизм глицерола
- •Лекция 22 катаболизм жирных кислот
- •Активация жирной кислоты
- •Транспорт ацил-СоА в митохондрии
- •Катаболизм ненасыщенных жирных кислот
- •Катаболизм жирных кислот с нечетным числом атомов углерода
- •Образование кетоновых тел (кетогенез)
- •Кетоновые тела как источники энергии
- •Глиоксилатный цикл
- •Лекция 23 биосинтез жирных кислот и триацилглицеролов
- •Строение синтазы жирных кислот
- •Механизм синтеза жирных кислот
- •Транспорт ацетил-СоА из митохондрий в цитозоль
- •Образование малонил-СоА
- •Наращивание (элонгация) углеродной цепи жирной кислоты
- •Синтез других предельных и непредельных жк
- •Биосинтез триацилглицеролов
- •Лекция 24 биосинтез холестерола и желчных кислот
- •Биосинтез холестерола
- •Регуляция биосинтеза хс
- •Биосинтез желчных кислот
- •Лекция 25
- •Биологическое окисление. Ферменты, участвующие в биологическом окислении
- •Свободное окисление и его биологическая роль. Цитохром р-450
- •Микросомальная система окисления
- •Механизм гидроксилирования
- •Лекция 26
- •Цепь переноса электронов и протонов внутренней мембраны
- •Митохондрий (дыхательная цепь, редокс-цепь). Компоненты
- •Дыхательной цепи: флавопротеины, железосерные белки, коэнзим q, цитохромы в, с1, с, аа3. Топография дыхательных переносчиков
- •В редокс-цепи
- •Убихинон окисленный CoQ
- •Энергетическое значение ступенчатого транспорта электронов от окисляемых субстратов к молекулярному кислороду. Окислительное фосфорилирование в дыхательной цепи
- •Организация компонентов дыхательной цепи в виде четырех
- •Локализация пунктов сопряжения окисления и фосфорилирования в дыхательной цепи на основании редокс-потенциалов, действия специфических ингибиторов (ротенон, амитал, антимицин а, цианид, со, NaN3)
- •Полные и редуцированные дыхательные цепи
- •Лекция 27
- •Строение атp-синтазного комплекса. Механизм образования атp. Обратимость реакции, катализируемой атp-синтазой. Разобщение транспорта электронов и синтеза атp; действие 2,4-динитрофенола
- •Механизм образования атp
- •Окисление цитоплазматического nadh в дыхательной цепи. Глицеролфосфатный и малат-аспартатный челночные механизм
- •Лекция 28 интеграция клеточного метаболизма
- •Основные аспекты регуляции метаболизма
- •Регуляция на уровне транскрипции
- •Аллостерическая регуляция активности ферментов
- •Ковалентная модификация ферментов
- •Гормональная регуляция
- •Посттранскрипционная и посттрансляционная модификация макромолекул
- •Изменение концентрации метаболитов
- •Мембранная регуляция
- •Модуль III. Молекулярная биология лекция 29 репликация днк
- •Точность репликации
- •Репликация днк у эукариот
- •Репаративный синтез днк
- •Лекция 30 транскрипция (биосинтез рнк)
- •Транскрипция у прокариот
- •Инициация транскрипции
- •Элонгация транскрипции
- •Терминация транскрипции
- •Транскрипция у эукариот
- •Механизм индукции на примере Lac-оперона
- •Катаболитная репрессия
- •Лекция 31 тРансляция (биосинтез белка)
- •Роль тРнк в трансляции
- •Аминоацил-тРнк-синтетазы
- •Белоксинтезирующая система клетки
- •Эффективность трансляции
- •Точность белкового синтеза
- •Энергетические затраты на трансляцию
- •Посттрансляционные модификации полипептидной цепи
- •Библиографический список Основная литература
- •Дополнительная литература
Уравнение Михаэлиса-Ментен
Главной целью изучения кинетики ферментативных реакций является получение информации, которая может способствовать выяснению молекулярного механизма действия фермента.
Общие принципы кинетики химических реакций применимы и к ферментативным реакциям. Известно, что любая химическая реакция характеризуется константой термодинамического равновесия. Она выражает состояние химического равновесия, достигаемого системой, и обозначается Кр. Так, для реакции
|
k+1
k-1 |
|
константа равновесия равна произведению концентраций образующихся веществ, деленному на произведение концентрации исходных веществ. Значение константы равновесия обычно находят из соотношения констант скоростей прямой (k+1) и обратной (k-1) реакций, т.е. Кp = k+1/k-1. В состоянии равновесия скорость прямой реакции: v+1 = k+1[А]·[B] равна скорости обратной реакции: v1 = k-1 [С]·[D], т. е. v+1 = v-1 соответственно k+1[А]·[B] = k-1[С]·[D], или
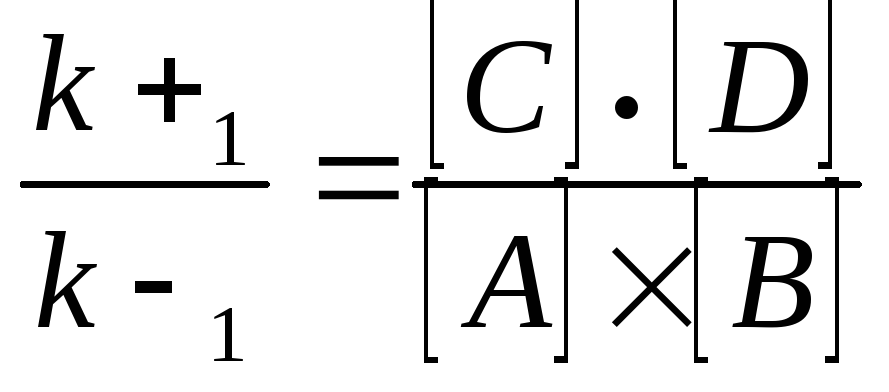 .
.
Отсюда,
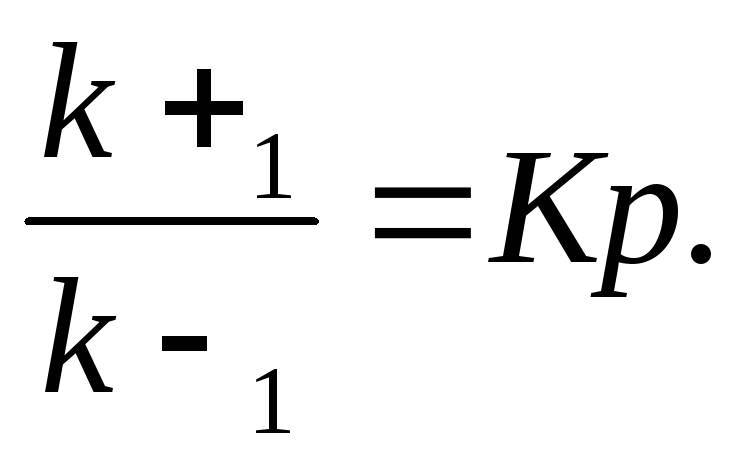
Таким образом, константа равновесия равна отношению констант скоростей прямой и обратной реакций. Величину, обратную константе равновесия, принято называть в случае ферментативной реакции константой диссоциации фермент–субстратного комплекса, и обозначать символом KS. Так, в реакции
|
k+1
k-1 |
|
т.е. KS равна отношению произведения концентрации фермента и субстрата к концентрации фермент-субстратного комплекса или отношению констант скоростей обратной и прямой реакций. Следует отметить, что константа KS зависит от химической природы субстрата и фермента и определяет степень их сродства. Чем ниже значение KS, тем выше сродство фермента к субстрату.
При изучении кинетики ферментативных реакций следует учитывать одну важную особенность этих реакций, не свойственную обычным химическим реакциям и связанную с явлением насыщения фермента субстратом. При низкой концентрации субстрата зависимость скорости реакции от концентрации субстрата (рис. 14.19) ляется почти линейной и подчиняется кинетике первого порядка.
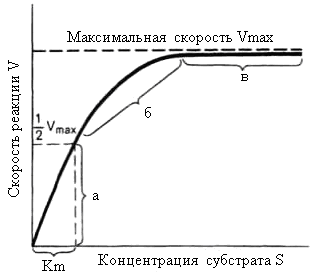
Рис. 14.19. График зависимости скорости ферментативной реакции от концентрации субстрата при постоянной концентрации фермента: а – реакция первого порядка; б – реакция смешанного порядка; в – реакция нулевого порядка
Это означает, что скорость реакции S→Р прямо пропорциональна концентрации субстрата S и в любой момент времени t определяется следующим кинетическим уравнением:
![]()
![]() ,
,
где [S] – молярная концентрация субстрата; –d[S]/dt – скорость убыли субстрата; k' – константа скорости реакции, которая в данном случае имеет размерность, обратную единице времени (мин–1 или с–1).
При высокой концентрации субстрата скорость реакции максимальна, постоянна и не зависит от концентрации субстрата. В этом случае реакция подчиняется кинетике нулевого порядка v = k′′ (при полном насыщении фермента субстратом) и целиком определяется концентрацией фермента. Кроме того, различают реакции второго порядка, скорость которых пропорциональна произведению концентраций двух реагирующих веществ. В определенных условиях при нарушении пропорциональности иногда говорят о реакциях смешанного порядка (см. рис. 14.19).
Изучая явление насыщения, Л. Михаэлис и М. Ментен разработали общую теорию ферментативной кинетики. Они исходили из предположения о том, что ферментативный процесс протекает в виде следующей химической реакции:
|
k
k-1 |
т.е. фермент Е вступает во взаимодействие с субстратом S с образованием промежуточного комплекса ES, который далее распадается на свободный фермент и продукт реакции Р. Принимая во внимание, что скорость ферментативной реакции определяется константой каталитического превращения фермент-субстратного комплекса (k+2) и его концетрации, Михаэлис и Ментен предложили уравнение, выражающее количественное соотношение между концентрацией субстрата и скоростью ферментативной реакции:
![]()
где v – наблюдаемая скорость реакции при данной концентрации субстрата; KS– константа диссоциации фермент-субстратного комплекса, моль/л; Vmax– максимальная скорость реакции при полном насыщении фермента субстратом.
Из уравнения Михаэлиса–Ментен следует, что при высокой концентрации субстрата и низком значении KS скорость реакции является максимальной, т.е. v = Vmax (реакция нулевого порядка, см. рис. 14.19). При низкой концентрации субстрата, скорость реакции напротив, оказывается прямопропорциональной концентрации субстрата в каждый данный момент (реакция первого порядка).
Следует указать, что уравнение Михаэлиса-Ментен в его классическом виде не учитывает влияние на скорость ферментативного процесса продуктов реакции и носит несколько ограниченный характер.
|
k
k-1 k-2 |
В связи с этим были предприняты попытки усовершенствовать уравнение, что было сделано Бриггсом и Холдейном:
![]() ,
,
где Кm - константа Михаэлиса, являющаяся экспериментально определяемой величиной. Она может быть представлена следующим уравнением:
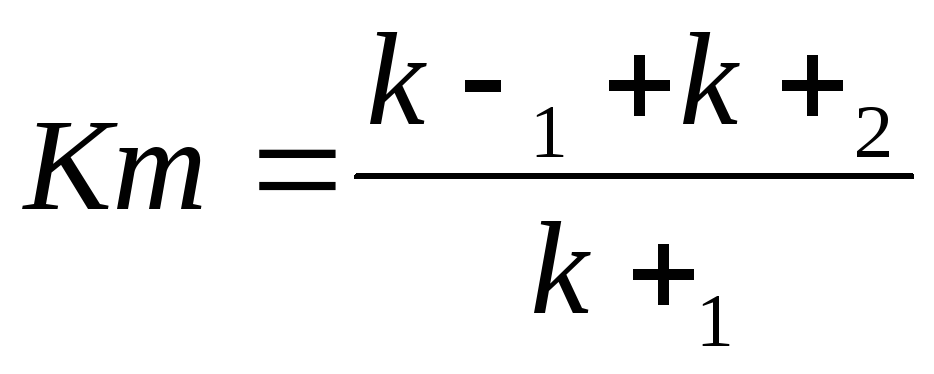 ,
или
,
или
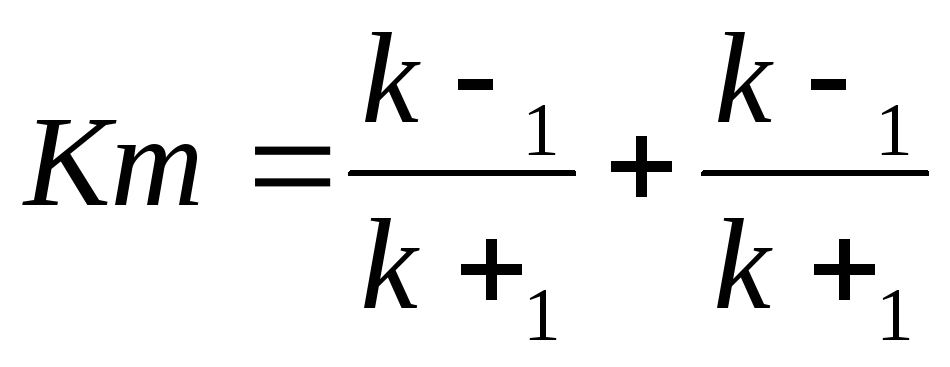 .
.
В числителе – константы скоростей распада комплекса ES в двух направлениях (в сторону исходных Е и S и в сторону конечных продуктов реакции Е и Р). Отношение k–1/ k+1 представляет собой константу диссоциации фермент-субстратного комплекса KS. Тогда
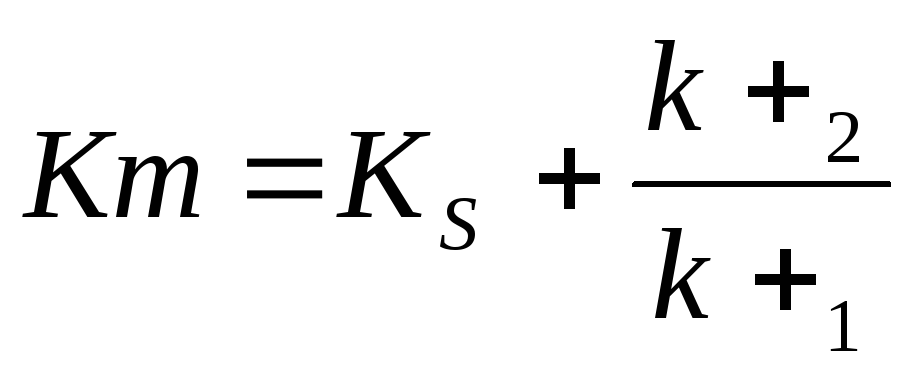
Отсюда вытекает важное следствие: константа Михаэлиса всегда больше константы диссоциации фермент-субстратного комплекса KS на величину k+2/k+1.
Для определения численного значения Кm обычно находят ту концентрацию субстрата, при которой скорость ферментативной реакции v составляет половину от максимальной Vmax, т.е. если v = 1/2 Vmaх. Подставив значение v в уравнение Бриггса–Холдейна, получаем:
![]() .
.
Разделив обе части уравнения на Vmах, получим:
![]() ,
,
откуда Km = S
Таким образом, константа Михаэлиса численно равна концентрации субстрата (моль/л), при которой скорость данной ферментативной реакции составляет половину от максимальной.
Определение величины Кm имеет важное значение при выяснении механизма действия эффекторов на активность ферментов и т.д. Константу Михаэлиса можно вычислить по графику (рис. 14.20).
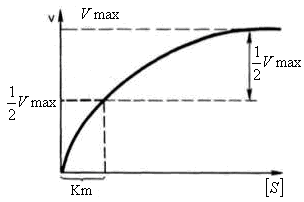
Рис. 14.20. Гиперболическая зависимость начальной скорости катализируемой ферментом реакции от концентрации субстрата (график уравнения Михаэлиса-Ментен)
Отрезок на абсциссе, соответствующий скорости, равной половине максимальной, будет представлять собой Кm.
