- •Лекции по курсу биохимия и молекулярная биология для студентов направления биология
- •Оглавление
- •Введение
- •Модуль 1. Статическая биохимия
- •Лекция 1
- •Строение, свойства, биологическая роль
- •Моно – и олигосахаридов
- •Классификация углеводов
- •Моносахариды
- •Стереоизомерия моносахаридов
- •Представители моносахаридов
- •Олигосахариды
- •Отдельные представители дисахаридов
- •Лекция 2 строение, свойства, биологическая роль
- •Отдельные представители полисахаридов
- •Лекция 3 строение, свойства, биологическая роль простых липидов
- •Классификация
- •Стероиды
- •Желчные кислоты
- •Лекция 4 строение, свойства, биологическая роль сложных липидов
- •Лекция 5 аминокислотный состав белков Белки и их функции
- •Функции белков
- •Элементарный состав белков
- •Методы выделения и очистки белков
- •Аминокислотный состав белков
- •Химические свойства аминокислот
- •Классификация аминокислот, заменимые и незаменимые аминокислоты
- •Лекция 6 уровни структурной организации белков Структурная организация белков
- •Первичная структура белка: методы исследования. Структурные особенности пептидной связи
- •Номенклатура пептидов и полипептидов. Природные пептиды: глутатион, карнозин, ансерин, грамицидин s, окситоцин, энкефалины
- •Отдельные представители пептидов
- •Вторичная структура белков: -спираль, ее основные характеристики, -структура, -изгиб. Роль водородных связей в формировании вторичной структуры. Сверхвторичные (надвторичные) структуры белка
- •Третичная структура белков. Типы нековалентных связей, стабилизирующих третичную структуру. Роль s-s-мостиков в формировании третичной структуры некоторых белков
- •Заимодействия между субъединицами, стабилизирующие четвертичную структуру. Функциональное значение четвертичной структуры белков
- •Лекция 7
- •Физико-химические свойства белков
- •Ионизация, гидратация, растворимость,
- •Осмотические и онкотические свойства, оптические свойства
- •Молекулярная масса и размеры белков. Методы определения молекулярной массы белков. Необходимость применения комплекса методов для точной оценки молекулярной массы белков
- •Денатурация белков
- •Лекция 8 классификация белков. Простые и сложные белки Принципы классификации белков
- •Фибриллярные белки
- •Глобулярные белки
- •Сложные белки
- •Липопротеины
- •Гликопротеины
- •Протеогликаны
- •Фосфопротеины
- •Металлопротеины
- •Нуклеопротеины
- •Хромопротеины
- •Гемоглобин
- •Миоглобин
- •Цитохромы электронтранспортной цепи
- •Хлорофиллы
- •Флавопротеины
- •Лекция 9 сложные белки Гликопротеины
- •Фосфопротеины
- •Липопротеины
- •Металлопротеины
- •Лекция 10 строение, свойства, биологическая роль нуклеотидов
- •Циклические нуклеотиды
- •Лекция 11 строение, свойства, биологическая роль нуклеиновых кислот
- •Рибосомальные рнк
- •Лекция 12 витамины – биологическая роль, классификация. Водорастворимые витамины
- •Витамин в1 (тиамин)
- •Витамин в2 (рибофлавин)
- •Витамин в3 (рр, никотиновая кислота, никотинамид)
- •Витамин в5 (пантотеновая кислота)
- •Витамин в6 (пиридоксин, пиридоксаль, пиридоксамин)
- •Витамин в9 (фолиевая кислота)
- •Витамин в12 (кобалами)
- •Витамин н (биотин)
- •Витамин с (аскорбиновая кислота)
- •Витамин р (рутин)
- •Лекция 13 жирорастворимые витамины Витамин а (ретинол)
- •Витамин d (кальциферол)
- •Витамин е (токоферол)
- •Витамин к (нафтохинон)
- •Лекция 14
- •Ферменты – строение: свойства, механизм действия
- •Понятие о ферментах.
- •Сущность явлений ферментативного катализа
- •Структурная организация ферментов
- •3. Роль металлов в регуляции aктивности ферментов
- •Изоферменты: биологическая роль
- •Механизм действия ферментов
- •Специфичность действия ферментов
- •Стационарная кинетика ферментативных реакций
- •Концентрация субстрата
- •Концентрация фермента
- •Температура
- •Уравнение Михаэлиса-Ментен
- •Единицы ферментов
- •Лекция 15
- •Ингибиторы ферментов
- •Регуляция каталитичекой активности ферментов
- •Изостерическая регуляция
- •Аллостерический контроль активности ферментов
- •Регуляция ферментов ковалентной модификацией
- •Регуляция ферментов ограниченным протеолизом (активация зимогенов)
- •Регуляция активности мультиэнзимных комплексов
- •Классификация и номенклатура ферментов
- •Характеристика отдельных классов ферментов
- •Ферменты в клинической диагностике. Энзимопатии
- •Модуль II. Динамическая биохимия
- •Катаболические, анаболические, амфиболические пути
- •Метаболизм углеводов
- •Расщепление углеводов в пищеварительном тракте
- •Переваривание углеводов в ротовой полости
- •Переваривание углеводов в кишечнике
- •Амилолитические ферменты: характеристика Панкреатическая -амилаза
- •Сахаразо-изомальтазный комплекс
- •Гликоамилазный комплекс
- •Трегалаза
- •Всасывание моносахаридов в тонком кишечнике и их дальнейший транспорт. Глюкозные транспортеры
- •Всасывание моносахаридов в кишечнике
- •Транспорт глюкозы из крови в клетки
- •Лекция 17
- •Анаэробный катаболизм углеводов
- •Анаэробное окисление глюкозы. Гликолиз. Внутриклеточная
- •Локализация процесса
- •Отдельные реакции гликолиза, их термодинамические характеристики. Образование 2,3-дифосфоглицерата в шунте Рапопорта-Люберинга
- •Расщепление гликогена (гликогенолиз). Строение, механизм действия и регуляция гликогенфосфорилазы
- •Спиртовое и молочнокислое брожение
- •Лекция 18
- •Аэробный катаболизм углеводов (часть 1)
- •Аэробный метаболизм пирувата. Митохондрии: структура
- •И энергетические функции
- •Окислительное декарбоксилирование пирувата. Строение
- •Цикл лимонной кислоты. Отдельные реакции цикла, их термодинамическая характеристики. Суммарное уравнение окисления ацетил-CоА в цикле Кребса
- •Лекция 19
- •Аэробный катаболизм углеводов (часть 2)
- •Регуляция цикла Кребса на уровне цитратсинтазы,
- •Изоцитратдегидрогеназы и -кетоглутаратдегидрогеназного комплекса
- •Амфиболическое значение цикла Кребса. Необходимость анаплеротических путей, пополняющих запас компонентов, участвующих в цикле
- •Зависимое от атp и биотина карбоксилирование пирувата: анаплеротический путь синтеза оксалоацетата
- •Пентозофосфатный путь (гексозомонофосфатный шунт)
- •Отдельные реакции пфп, их термодинамические характеристики.
- •Суммарное уравнение пентозофосфатного пути.
- •Регуляция пентозофосфатного пути на уровне
- •Глюкозо-6-фосфатдегидрогеназы
- •Участки перекреста пфп с гликолизом
- •Циклический характер пфп
- •Лекция 20 биосинтез углеводов
- •Глюконеогенез
- •В последующей реакции, катализируемой ферментом фосфоенолпируваткарбоксикиназой, из оксалоацетата образуется фосфоенолпируват. Реакция Mg2-зависимая и донором фосфата служит gtp.
- •Лекция 21 расщепление пищевых и тканевых липидов
- •Катаболизм липидов
- •Всасывание продуктов расщепления липидов
- •Транспорт липидов
- •Метаболизм глицерола
- •Лекция 22 катаболизм жирных кислот
- •Активация жирной кислоты
- •Транспорт ацил-СоА в митохондрии
- •Катаболизм ненасыщенных жирных кислот
- •Катаболизм жирных кислот с нечетным числом атомов углерода
- •Образование кетоновых тел (кетогенез)
- •Кетоновые тела как источники энергии
- •Глиоксилатный цикл
- •Лекция 23 биосинтез жирных кислот и триацилглицеролов
- •Строение синтазы жирных кислот
- •Механизм синтеза жирных кислот
- •Транспорт ацетил-СоА из митохондрий в цитозоль
- •Образование малонил-СоА
- •Наращивание (элонгация) углеродной цепи жирной кислоты
- •Синтез других предельных и непредельных жк
- •Биосинтез триацилглицеролов
- •Лекция 24 биосинтез холестерола и желчных кислот
- •Биосинтез холестерола
- •Регуляция биосинтеза хс
- •Биосинтез желчных кислот
- •Лекция 25
- •Биологическое окисление. Ферменты, участвующие в биологическом окислении
- •Свободное окисление и его биологическая роль. Цитохром р-450
- •Микросомальная система окисления
- •Механизм гидроксилирования
- •Лекция 26
- •Цепь переноса электронов и протонов внутренней мембраны
- •Митохондрий (дыхательная цепь, редокс-цепь). Компоненты
- •Дыхательной цепи: флавопротеины, железосерные белки, коэнзим q, цитохромы в, с1, с, аа3. Топография дыхательных переносчиков
- •В редокс-цепи
- •Убихинон окисленный CoQ
- •Энергетическое значение ступенчатого транспорта электронов от окисляемых субстратов к молекулярному кислороду. Окислительное фосфорилирование в дыхательной цепи
- •Организация компонентов дыхательной цепи в виде четырех
- •Локализация пунктов сопряжения окисления и фосфорилирования в дыхательной цепи на основании редокс-потенциалов, действия специфических ингибиторов (ротенон, амитал, антимицин а, цианид, со, NaN3)
- •Полные и редуцированные дыхательные цепи
- •Лекция 27
- •Строение атp-синтазного комплекса. Механизм образования атp. Обратимость реакции, катализируемой атp-синтазой. Разобщение транспорта электронов и синтеза атp; действие 2,4-динитрофенола
- •Механизм образования атp
- •Окисление цитоплазматического nadh в дыхательной цепи. Глицеролфосфатный и малат-аспартатный челночные механизм
- •Лекция 28 интеграция клеточного метаболизма
- •Основные аспекты регуляции метаболизма
- •Регуляция на уровне транскрипции
- •Аллостерическая регуляция активности ферментов
- •Ковалентная модификация ферментов
- •Гормональная регуляция
- •Посттранскрипционная и посттрансляционная модификация макромолекул
- •Изменение концентрации метаболитов
- •Мембранная регуляция
- •Модуль III. Молекулярная биология лекция 29 репликация днк
- •Точность репликации
- •Репликация днк у эукариот
- •Репаративный синтез днк
- •Лекция 30 транскрипция (биосинтез рнк)
- •Транскрипция у прокариот
- •Инициация транскрипции
- •Элонгация транскрипции
- •Терминация транскрипции
- •Транскрипция у эукариот
- •Механизм индукции на примере Lac-оперона
- •Катаболитная репрессия
- •Лекция 31 тРансляция (биосинтез белка)
- •Роль тРнк в трансляции
- •Аминоацил-тРнк-синтетазы
- •Белоксинтезирующая система клетки
- •Эффективность трансляции
- •Точность белкового синтеза
- •Энергетические затраты на трансляцию
- •Посттрансляционные модификации полипептидной цепи
- •Библиографический список Основная литература
- •Дополнительная литература
Механизм действия ферментов
В 1903 г. В. Генри сделал вывод о том, что необходимой стадией ферментативного катализа является соединение фермента с субстратом, в результате чего образуется фермент-субстратный комплекс. Развитие этой идеи привело к созданию общей теории действия ферментов; особенно большой вклад в неё в 1913г. внесли Л. Михаэлис и М. Ментен. Согласно их гипотезе процесс ферментативного катализа можно разделить на три стадии:
1) диффузия субстрата к ферменту и стерическое связывание его с активным центром фермента, т.е. образование фермент-субстратного комплекса (ES);
2) преобразование первичного комплекса в один или несколько активированных фермент-субстратных комплексов (ES*, ES**…);
3) отделение продуктов (Р) реакции от активного центра и диффузия его в окружающую среду.

Первая стадия обычно непродолжительна и зависит от концентрации субстрата в среде, а также его диффузии к активному центру фермента. Комплекс образуется практически мгновенно. Субстрат присоединяется к активному центру в нескольких точках, образуя хелатные (клешневидные) комплексы. Присоединение осуществляется связями разного характера, в основном слабыми (водородные, электростатические, гидрофобные, координационные), ковалентные связи встречаются редко. На этой стадии изменение энергии активации незначительно, ориентация субстрата и активного центра способствует их сближению и прохождению реакции.
Вторая стадия наиболее медленная и лимитирует скорость всего катализа в целом. Её длительность зависит от энергии активации данной химической реакции. На этой стадии происходит расшатывание связей субстрата, их разрыв или образование новых связей в результате взаимодействия с активными группами фермента. Благодаря образованию активированных переходных комплексов снижается энергия активации реакции.
Третья стадия практически мгновенна. Она определяется скоростью диффузии продуктов реакции в окружающую среду.
Ферменты – истинные катализаторы. Они значительно повышают скорость строго определённых химических реакций, которые в отсутствии ферментов протекают очень медленно. Ферменты не могут влиять на положение равновесия ускоряемых реакций; при этом в ходе реакций они не расходуются и не претерпевают необратимых изменений.
Ферменты с термодинамической точки зрения ускоряют химические реакции за счет снижения энергии активации. Энергией активации называется энергия, необходимая для перевода всех молекул моля вещества в активированное (переходное) состояние при данной температуре. Фермент снижает энергию активации путем увеличения числа активированных молекул, которые становятся реакционноспособными на более низком энергетическом уровне (рис. 14.10).

Рис. 14.10. Энергетический механизм ферментативной и неферментативной химических реакций: S – исходный субстрат; Р – продукт; Енф – энергия активации неферментативной реакции; Еф – энергия активации ферментативной реакции; G – стандартное изменение свободной энергии
Существует два основных пути повышения скорости химической реакции. Первый путь – повышение температуры, т.е. ускорение теплового движения молекул, которое приводит к увеличению доли молекул, обладающих достаточной энергией для достижения переходного состояния. В этой точке существует равная вероятность того, что достигшие её молекулы вступят в реакцию с образованием продукта или вернутся на уровень непрореагировавших молекул. Скорость любой химической реакции пропорциональна концентрации молекул, находящихся в переходном состоянии.
Второй путь – добавление катализатора. Они ускоряют химические реакции, находя «обходные пути», позволяющие молекулам преодолевать активационный барьер на более низком энергетическом уровне. На промежуточной стадии реакции катализатор (С) взаимодействует с реагентом (А) с образованием нового комплекса СА, переходному состоянию которого соответствует значительно сниженная энергия активации по сравнению с переходным состоянием реагента А в некатализируемой реакции. Затем комплекс СА распадается на продукт (Р) и свободный катализатор, который может опять соединиться с другой молекулой А и повторить весь цикл:
![]()
Существуют четыре основных фактора, определяющих способность ферментов ускорять химические реакции.
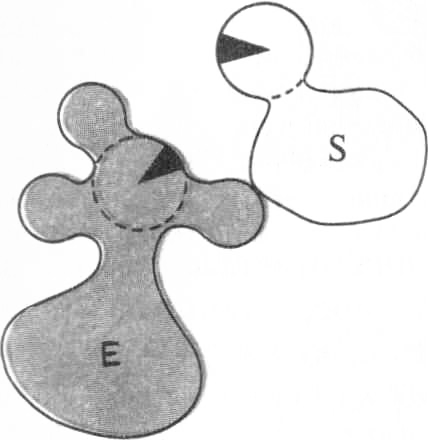
1.Сближение и ориентация. Фермент способен связывать молекулу субстрата таким образом, что атакуемая им связь оказывается не только расположенной в непосредственной близости от каталитической группы, но и правильно ориентированной по отношению к ней. В результате вероятность того, что комплекс ES достигнет переходного состояния, сильно увеличивается (рис. 14.11).
|
а |
б |
в |
|
|
|
|
|
Рис. 14.11. Процессы сближения и ориентации при взаимодействии молекулы субстрата S с каталитической группой в активном центре фермента Е: а – неправильная ориентация, неправильное сближение; б – правильное сближение, неправильная ориентация; в – правильное сближение, правильная ориентация | ||
2. Напряжение и деформация: индуцированное соответствие. Присоединение субстрата может вызывать конформационные изменения в молекуле фермента, которые приводят к напряжению структуры активного центра, а также несколько деформируют связанный субстрат, упрощая тем самым достижение комплексом ES переходного состояния.
При этом возникает так называемое индуцированное соответствие фермента субстрату. Таким образом, небольшие изменения третичной или четвертичной структуры относительно крупной молекулы фермента могут играть роль механического рычага для молекулы субстрата. Возможно, именно по этой причине ферменты представляют собой белки и, следовательно, по своим размерам значительно превосходят молекулы большинства субстратов.
3. Общий кuслотно-основный катализ. В активном центре фермента могут находиться группы специфических аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов (рис. 14.12). Такие кислотные или основные группы общего типа представляют собой мощные катализаторы многих органических реакций, протекающих в водных системах.
|
а
- СООН - +NH3 - SH
|
б
- СОО- - NH2 - S-
|
Рис. 14.12. Функциональные группы аминокислотных остатков, принимающие участие в каталитических процессах: а – протон-донорные группы; б – протон-акцепторные группы
4. Ковалентный катализ. Некоторые ферменты реагируют со своими субстратами, образуя очень нестабильные, ковалентно связанные фермент-субстратные комплексы, из которых в ходе последующей реакции образуются продукты реакции, причем значительно быстрее, чем в случае некатализируемых реакций:
|
Некатализируемая реакция |
RX + H2O → ROH + HX |
|
Катализируемая реакция
|
RX + E-OH → ROH + EX EX + H2O → E-OH + HX |
|
Суммарная реакция |
RX + H2O → ROH +HX |
В некоторых ферментативных реакциях фермент замещает функциональную группу R в субстрате RX, в результате чего образуется ковалентный комплекс ЕХ. Он нестабилен и гидролизуется значительно быстрее, чем RX. К ферментам, осуществляющим ковалентный катализ, отноcится химотрипсин.
Перечисленные выше факторы, по-видимому, в различной степени ускоряют химические реакции. Однако для многих ферментов пока не известно точного механизма, обеспечивающего ускорение той или иной специфической реакции.