
- •Лекции по курсу биохимия и молекулярная биология для студентов направления биология
- •Оглавление
- •Введение
- •Модуль 1. Статическая биохимия
- •Лекция 1
- •Строение, свойства, биологическая роль
- •Моно – и олигосахаридов
- •Классификация углеводов
- •Моносахариды
- •Стереоизомерия моносахаридов
- •Представители моносахаридов
- •Олигосахариды
- •Отдельные представители дисахаридов
- •Лекция 2 строение, свойства, биологическая роль
- •Отдельные представители полисахаридов
- •Лекция 3 строение, свойства, биологическая роль простых липидов
- •Классификация
- •Стероиды
- •Желчные кислоты
- •Лекция 4 строение, свойства, биологическая роль сложных липидов
- •Лекция 5 аминокислотный состав белков Белки и их функции
- •Функции белков
- •Элементарный состав белков
- •Методы выделения и очистки белков
- •Аминокислотный состав белков
- •Химические свойства аминокислот
- •Классификация аминокислот, заменимые и незаменимые аминокислоты
- •Лекция 6 уровни структурной организации белков Структурная организация белков
- •Первичная структура белка: методы исследования. Структурные особенности пептидной связи
- •Номенклатура пептидов и полипептидов. Природные пептиды: глутатион, карнозин, ансерин, грамицидин s, окситоцин, энкефалины
- •Отдельные представители пептидов
- •Вторичная структура белков: -спираль, ее основные характеристики, -структура, -изгиб. Роль водородных связей в формировании вторичной структуры. Сверхвторичные (надвторичные) структуры белка
- •Третичная структура белков. Типы нековалентных связей, стабилизирующих третичную структуру. Роль s-s-мостиков в формировании третичной структуры некоторых белков
- •Заимодействия между субъединицами, стабилизирующие четвертичную структуру. Функциональное значение четвертичной структуры белков
- •Лекция 7
- •Физико-химические свойства белков
- •Ионизация, гидратация, растворимость,
- •Осмотические и онкотические свойства, оптические свойства
- •Молекулярная масса и размеры белков. Методы определения молекулярной массы белков. Необходимость применения комплекса методов для точной оценки молекулярной массы белков
- •Денатурация белков
- •Лекция 8 классификация белков. Простые и сложные белки Принципы классификации белков
- •Фибриллярные белки
- •Глобулярные белки
- •Сложные белки
- •Липопротеины
- •Гликопротеины
- •Протеогликаны
- •Фосфопротеины
- •Металлопротеины
- •Нуклеопротеины
- •Хромопротеины
- •Гемоглобин
- •Миоглобин
- •Цитохромы электронтранспортной цепи
- •Хлорофиллы
- •Флавопротеины
- •Лекция 9 сложные белки Гликопротеины
- •Фосфопротеины
- •Липопротеины
- •Металлопротеины
- •Лекция 10 строение, свойства, биологическая роль нуклеотидов
- •Циклические нуклеотиды
- •Лекция 11 строение, свойства, биологическая роль нуклеиновых кислот
- •Рибосомальные рнк
- •Лекция 12 витамины – биологическая роль, классификация. Водорастворимые витамины
- •Витамин в1 (тиамин)
- •Витамин в2 (рибофлавин)
- •Витамин в3 (рр, никотиновая кислота, никотинамид)
- •Витамин в5 (пантотеновая кислота)
- •Витамин в6 (пиридоксин, пиридоксаль, пиридоксамин)
- •Витамин в9 (фолиевая кислота)
- •Витамин в12 (кобалами)
- •Витамин н (биотин)
- •Витамин с (аскорбиновая кислота)
- •Витамин р (рутин)
- •Лекция 13 жирорастворимые витамины Витамин а (ретинол)
- •Витамин d (кальциферол)
- •Витамин е (токоферол)
- •Витамин к (нафтохинон)
- •Лекция 14
- •Ферменты – строение: свойства, механизм действия
- •Понятие о ферментах.
- •Сущность явлений ферментативного катализа
- •Структурная организация ферментов
- •3. Роль металлов в регуляции aктивности ферментов
- •Изоферменты: биологическая роль
- •Механизм действия ферментов
- •Специфичность действия ферментов
- •Стационарная кинетика ферментативных реакций
- •Концентрация субстрата
- •Концентрация фермента
- •Температура
- •Уравнение Михаэлиса-Ментен
- •Единицы ферментов
- •Лекция 15
- •Ингибиторы ферментов
- •Регуляция каталитичекой активности ферментов
- •Изостерическая регуляция
- •Аллостерический контроль активности ферментов
- •Регуляция ферментов ковалентной модификацией
- •Регуляция ферментов ограниченным протеолизом (активация зимогенов)
- •Регуляция активности мультиэнзимных комплексов
- •Классификация и номенклатура ферментов
- •Характеристика отдельных классов ферментов
- •Ферменты в клинической диагностике. Энзимопатии
- •Модуль II. Динамическая биохимия
- •Катаболические, анаболические, амфиболические пути
- •Метаболизм углеводов
- •Расщепление углеводов в пищеварительном тракте
- •Переваривание углеводов в ротовой полости
- •Переваривание углеводов в кишечнике
- •Амилолитические ферменты: характеристика Панкреатическая -амилаза
- •Сахаразо-изомальтазный комплекс
- •Гликоамилазный комплекс
- •Трегалаза
- •Всасывание моносахаридов в тонком кишечнике и их дальнейший транспорт. Глюкозные транспортеры
- •Всасывание моносахаридов в кишечнике
- •Транспорт глюкозы из крови в клетки
- •Лекция 17
- •Анаэробный катаболизм углеводов
- •Анаэробное окисление глюкозы. Гликолиз. Внутриклеточная
- •Локализация процесса
- •Отдельные реакции гликолиза, их термодинамические характеристики. Образование 2,3-дифосфоглицерата в шунте Рапопорта-Люберинга
- •Расщепление гликогена (гликогенолиз). Строение, механизм действия и регуляция гликогенфосфорилазы
- •Спиртовое и молочнокислое брожение
- •Лекция 18
- •Аэробный катаболизм углеводов (часть 1)
- •Аэробный метаболизм пирувата. Митохондрии: структура
- •И энергетические функции
- •Окислительное декарбоксилирование пирувата. Строение
- •Цикл лимонной кислоты. Отдельные реакции цикла, их термодинамическая характеристики. Суммарное уравнение окисления ацетил-CоА в цикле Кребса
- •Лекция 19
- •Аэробный катаболизм углеводов (часть 2)
- •Регуляция цикла Кребса на уровне цитратсинтазы,
- •Изоцитратдегидрогеназы и -кетоглутаратдегидрогеназного комплекса
- •Амфиболическое значение цикла Кребса. Необходимость анаплеротических путей, пополняющих запас компонентов, участвующих в цикле
- •Зависимое от атp и биотина карбоксилирование пирувата: анаплеротический путь синтеза оксалоацетата
- •Пентозофосфатный путь (гексозомонофосфатный шунт)
- •Отдельные реакции пфп, их термодинамические характеристики.
- •Суммарное уравнение пентозофосфатного пути.
- •Регуляция пентозофосфатного пути на уровне
- •Глюкозо-6-фосфатдегидрогеназы
- •Участки перекреста пфп с гликолизом
- •Циклический характер пфп
- •Лекция 20 биосинтез углеводов
- •Глюконеогенез
- •В последующей реакции, катализируемой ферментом фосфоенолпируваткарбоксикиназой, из оксалоацетата образуется фосфоенолпируват. Реакция Mg2-зависимая и донором фосфата служит gtp.
- •Лекция 21 расщепление пищевых и тканевых липидов
- •Катаболизм липидов
- •Всасывание продуктов расщепления липидов
- •Транспорт липидов
- •Метаболизм глицерола
- •Лекция 22 катаболизм жирных кислот
- •Активация жирной кислоты
- •Транспорт ацил-СоА в митохондрии
- •Катаболизм ненасыщенных жирных кислот
- •Катаболизм жирных кислот с нечетным числом атомов углерода
- •Образование кетоновых тел (кетогенез)
- •Кетоновые тела как источники энергии
- •Глиоксилатный цикл
- •Лекция 23 биосинтез жирных кислот и триацилглицеролов
- •Строение синтазы жирных кислот
- •Механизм синтеза жирных кислот
- •Транспорт ацетил-СоА из митохондрий в цитозоль
- •Образование малонил-СоА
- •Наращивание (элонгация) углеродной цепи жирной кислоты
- •Синтез других предельных и непредельных жк
- •Биосинтез триацилглицеролов
- •Лекция 24 биосинтез холестерола и желчных кислот
- •Биосинтез холестерола
- •Регуляция биосинтеза хс
- •Биосинтез желчных кислот
- •Лекция 25
- •Биологическое окисление. Ферменты, участвующие в биологическом окислении
- •Свободное окисление и его биологическая роль. Цитохром р-450
- •Микросомальная система окисления
- •Механизм гидроксилирования
- •Лекция 26
- •Цепь переноса электронов и протонов внутренней мембраны
- •Митохондрий (дыхательная цепь, редокс-цепь). Компоненты
- •Дыхательной цепи: флавопротеины, железосерные белки, коэнзим q, цитохромы в, с1, с, аа3. Топография дыхательных переносчиков
- •В редокс-цепи
- •Убихинон окисленный CoQ
- •Энергетическое значение ступенчатого транспорта электронов от окисляемых субстратов к молекулярному кислороду. Окислительное фосфорилирование в дыхательной цепи
- •Организация компонентов дыхательной цепи в виде четырех
- •Локализация пунктов сопряжения окисления и фосфорилирования в дыхательной цепи на основании редокс-потенциалов, действия специфических ингибиторов (ротенон, амитал, антимицин а, цианид, со, NaN3)
- •Полные и редуцированные дыхательные цепи
- •Лекция 27
- •Строение атp-синтазного комплекса. Механизм образования атp. Обратимость реакции, катализируемой атp-синтазой. Разобщение транспорта электронов и синтеза атp; действие 2,4-динитрофенола
- •Механизм образования атp
- •Окисление цитоплазматического nadh в дыхательной цепи. Глицеролфосфатный и малат-аспартатный челночные механизм
- •Лекция 28 интеграция клеточного метаболизма
- •Основные аспекты регуляции метаболизма
- •Регуляция на уровне транскрипции
- •Аллостерическая регуляция активности ферментов
- •Ковалентная модификация ферментов
- •Гормональная регуляция
- •Посттранскрипционная и посттрансляционная модификация макромолекул
- •Изменение концентрации метаболитов
- •Мембранная регуляция
- •Модуль III. Молекулярная биология лекция 29 репликация днк
- •Точность репликации
- •Репликация днк у эукариот
- •Репаративный синтез днк
- •Лекция 30 транскрипция (биосинтез рнк)
- •Транскрипция у прокариот
- •Инициация транскрипции
- •Элонгация транскрипции
- •Терминация транскрипции
- •Транскрипция у эукариот
- •Механизм индукции на примере Lac-оперона
- •Катаболитная репрессия
- •Лекция 31 тРансляция (биосинтез белка)
- •Роль тРнк в трансляции
- •Аминоацил-тРнк-синтетазы
- •Белоксинтезирующая система клетки
- •Эффективность трансляции
- •Точность белкового синтеза
- •Энергетические затраты на трансляцию
- •Посттрансляционные модификации полипептидной цепи
- •Библиографический список Основная литература
- •Дополнительная литература
Рибосомальные рнк
Они принимают участие в образовании рибонуклеопротеинов, формирующих немембранные комплексы – рибосомы. Клетки прокариот и эукариот содержат рибосомы, имеюшие общий план строения. В рибосомы входят высокомолекулярные рРНК, дающие начало 30S-40S- и 50S-60S-субчастицам рибосом; рРНК взаимодействуют с мРНК и аминоацил-тРНК в процессе трансляции. 5S-рРНК выступает в роли посредника между пептидилтрансферазным центром и доменом белкового фактора трансляции, обладающим GTP-азной активностью.
Рибосомальные РНК содержат несколько модифицированных нуклеотидов. Чаще всего это метильные производные азотистых оснований или рибозы. Вторичная структура рРНК характеризуется спирализацией самой на себя полирибонуклеотидной цепи. Биспиральные и линейные участки этих молекул формируют постоянные вариабельные домены, которые затем укладываются в более компактные структуры более высокого порядка (рис. 11.7).
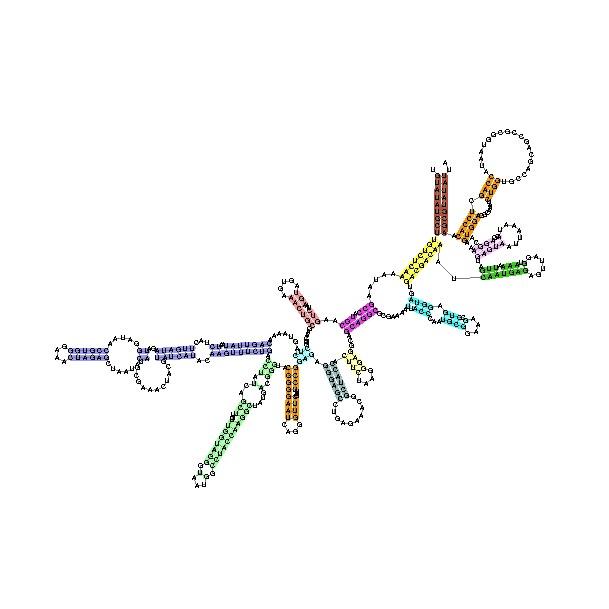
Рис. 11.7. Рибосомальная РНК
Остановимся на малых ядерных РНК. В ядрах всех эукариотических клеток содержится множество коротких и стабильных молекул РНК. Они локализованы в сплайсосомах млекопитающих и называются U-РНК из-за необычайно большого содержания урацила и его модифицированных форм.
Нуклеотидные последовательности всех U-РНК позвоночных совпадают на 95%. В сплайсосому, кроме пяти типов U-РНК, обладающих ферментативной активностью и названных рибозимами, входят еще 50 типов белков. Характерной чертой рибозимов является наличие липких концов, комплементарных концам интронов. Сплайсосома вырезает интроны – участки первичных транскриптов, не несущих информацию о белке.
В последние годы большой интерес исследователей направлен на изучение феномена малых РНК (siRNA). Различают цитоплазматические и ядерные малые РНК. В класс малых (коротких РНК) включают молекулы, содержащие от 20 до 300 нуклеотидов. Самые короткие из них – siRNA состоят из 21 – 28, а млекопитающих из 21 – 23 нуклеотидов. Особенностью этих молекул является то, что они в отличие от большинства других клеточных РНК, состоящих всего из одной цепи нуклеотидов, являются двунитчатыми. Нуклеотиды с противоположных цепей siRNA спариваются друг с другом по тем же законам комплементарности, которые формируют двунитчатые цепи в ДНК. Кроме того, по краям каждой из цепей siRNA всегда остаются два неспаренных нуклеотида.
Ядерным малым РНК отводится способность подавлять экспрессию генов у животныъх и растений. Эффект «гашения» определенных генов малыми РНК получил в молекулярной биологии название РНК-интерференции. Имеются доказательства, что у растений и низших животных организмов siRNA являются элементами «внутриклеточного иммунитета», позволяют быстро распознать и уничтожить чужую РНК.
Лекция 12 витамины – биологическая роль, классификация. Водорастворимые витамины
Витамины представляют собой сборную в химическом отношении группу низкомолекулярных органических веществ, жизненно необходимых для сбалансированного питания. Витамины не синтезируются в организме человека и животных или синтезируются, но в малых количествах, тканями, а также микрофлорой кишечника, присущей организму. Это недостаточно для нормальной жизнедеятельности. Для человека основными источниками витаминов являются высшие растения.
Между витаминами и другими составляющими частями пищи существуют тесные взаимоотношения, объясняемые общностью, единством обмена веществ. В животном мире имеется видовое различие в потребности в отдельных витаминах, что связано с возможностью или невозможностью их достаточного синтеза в организме. Так, аскорбиновая кислота является витамином для человека, обезьяны и морских свинок, тогда как крысы и собаки синтезируют его в процессе промежуточного обмена веществ.
В норме суточная потребность в витаминах мала, однако на потребность в витаминах могут существенно влиять увеличение физической нагрузки, интенсивность умственного труда, физиологическое состояние, возраст, пол, условия окружающей среды.
Поступая в организм с пищей, витамины (большинство из них) выполняют коферментную роль в ферментативных реакциях обмена. Кроме того, они являются компонентами биологическиактивных веществ, выступают в роли антиоксидантов. Анализ структуры коферментов позволяет выделить два функциональных центра, один из которых ответствен за связь с белком, а другой принимает участие непосредственно в каталитическом акте.
В витаминах нуждаются растения, которым эти вещества также необходимы для нормального развития и роста.
В ряде случаев в организм поступают предшественники витаминов, т.н. провитамины, которые в организме превращаются в активные формы витаминов.
Недостаток поступления витаминов с пищей, нарушение всасывания или их использования организмом приводит к развитию патологического состояния – первичные авитаминозы и гиповитаминозы. Напротив, чрезмерное потребление пищевых витаминных форм и/или несбалансированное питание может вызвать гипервитаминозное состояние, которое также является патологическим.
В медицинской и биологической литературе витамины подразделяются на две группы: растворимые в воде и растворимые в жирах. Отдельным витаминам присваивается буквенная, химическая и физиологическая номенклатура.
Жирорастворимые витамины приведены втаблице. 12.1.
Таблица 12.1
Жирорастворимые витамины
-
Буквенное обозначение
Наименование
Физиологическое
действие
А
Ретинол
Антиксерофтальмический
D
Эргокальциферол
Антирахитический
Е
Токоферол
Антистерильный
К
Филлохинон
Антигемморагический
Водорастворимые витамины приведены в таблице 12.2
Таблица 12.2
Водорастворимые витамины
|
Буквенное обозначение |
Наименование |
Физиологическое действие |
|
В1 |
Тиамин |
Антиневритный |
|
В2 |
Рибофлавин |
Витамин роста |
|
В3 (РР) |
Никотиновая кислота, никотинамид
|
Антипеллагрический |
|
В5 |
Пантотеновая кислота |
Антидерматитный |
|
В6 |
Пиридоксин |
Антидерматитный |
|
В9 |
Фолиевая кислота |
Антианемический |
|
В12 |
Цианкобаламин |
Антианемический |
|
Н |
Биотин |
Антисеборейный |
|
С |
Аскорбиновая кислота |
Антискорбутный |
|
Р |
Рутин |
Капилляроукрепляющий |
|
U |
S-метилметионин |
Противоязвенный |
Раскрытие причин авитаминозов и механизма их действий на организм обосновало использование витаминов как лекарственных средств. По лечебно-профилактическому действию была дана следующая групповая характеристика некоторых витаминов. Витамины В1, В2, В3, В5, А и С регулируют функциональное состояние центральной нервной системы, обмен веществ и трофику тканей, поэтому их используют как препараты, повышающие общую реактивность организма. Витамины С, Р, К обеспечивают нормальную проницаемость и устойчивость кровеносных сосудов, повышают свёртываемость крови, т.е. обладают антигеморрагическим эффектом. Витамины В9, В12, С нормализуют и стимулируют кроветворение; их используют как антианемические препараты. Витамины С и А повышают устойчивость организма к инфекциям путем стимулирования синтеза антител и противоспалительных веществ, усиления защиты эпителиев. Витамины А, В2 и С усиливают остроту зрения, расширяют поле цветного зрения.
Среди витаминов есть «отношения» синергизма и антагонизма. Так, влияние витамина Р на проницаемость кровеносных сосудов усиливает витамин С; витамин А снижает токсическое действие антирахитического витамина D, что усиливает эффект последнего. Никотиновая кислота тормозит липотропное действие холина.
В отличие от витаминов есть вещества, обладающие антивитаминными свойствами. Примером может служить тиамин, имеющий высокую структурную специфичность. Если в тиамине изменить радикалы, образуется вещество вытесняющее тиамин из фермента, коферментом которого он является. Антивитаминами являются многие антибиотики и сульфаниамидные препараты.
