
2-ХТ-45 подготовка к КР
.pdf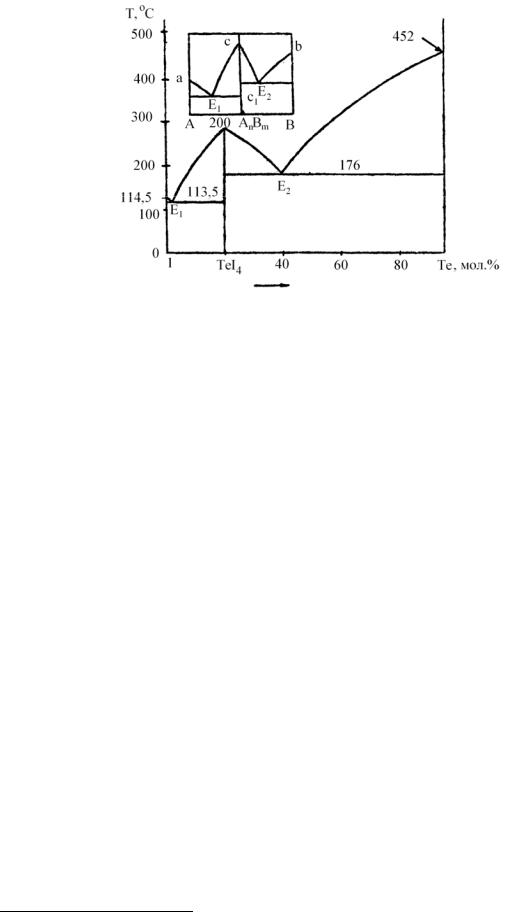
Рис. 3.5. Диаграмма плавкости веществ, образующих устойчивое химическое соединение AnBm
Острый максимум свидетельствует о прочности соединения, оно
плавится без разложения конгруэнтно – (от лат. congruentis –
соответствующий, совпадающий), то есть подобно чистому веществу. Так, легкоплавкие металлы могут дать тугоплавкий сплав. Например, при сплавлении Mg (T пл. = 651 oС) и Sb (Т пл. = 630 °С) образуется сплав Mg3Sb2 с Т пл. = 961 oС. Кристаллизация соединений AnBm по обе стороны прямой CCI протекает в неодинаковых условиях: слева от нее молекулы AnBm находятся в сочетании с молекулами А, справа – с молекулами В.
Соответственно С является точкой пересечения двух кривых |
(EIC и CE2). |
Такие точки называются сингулярными (от лат. singularis |
– отдельный, |
особый) или дальтоновскими.7 |
|
Если соединение при плавлении частично диссоциирует, то максимум на кривых ликвидуса становится округлым (рис. 3.6). Причем с ростом степени непрочности соединения его округлость увеличивается, а высота уменьшается. Это является следствием того, что понижение температуры кристаллизации тем значительнее, чем больше концентрация раствора (в данном случае содержание свободных А и В в AnBm). Особенно округлен максимум для органических систем. Так, в органических соединениях частицы связаны, как правило, сравнительно слабыми молекулярными силами.
Если по оси абсцисс концентрация отложена в атомных (мольных) долях или процентах, то вертикали, отвечающие максимумам, непосредственно дают состав соединений (см., например, рис. 3.5). Наличие на диаграмме плавкости числа максимумов больше одного означает, что компоненты
7 В честь английского физика и химика Дж. Дальтона соединения постоянного состава называют дальтонидами.

образуют несколько соединений (например, кристаллогидраты), количество их равно числу максимумов.
Рис. 3.6. Диаграмма плавкости веществ, образующих малоустойчивое химическое соединение AriBm
Наряду со стехиометрическими соотношениями между компонентами в соединениях, что особенно характерно для силикатных систем (4PbO·SiO2, 2BaO·SiO2, 3CaO·SiO2, 3CaO·2SiO2, Na2O·SiO2 и т.д.) и кристаллосольватов
(гидраты СuSO4, HNO3, H2SO4, аммиакаты), существуют соединения, состав которых не отвечает валентности образующих их элементов. К таковым можно отнести интерметаллические соединения. Так, серебро со стронцием образуют четыре соединения Ag4Sr, Ag5Sr, AgSr, Ag2Sr3, которым соответствуют четыре максимума на диаграмме плавкости системы Аg – Sr.
Для систем, образующих соединения, которые плавятся с разложением,
диаграмма имеет вид, изображенный на рис. 3.7. Выше температуры То соединение разлагается: его плавление в точке d сопровождается распадом на
жидкость d и кристаллы А (точка a1), то есть при То возникает равновесие
AnBm (к) ↔d (ж) + А (к).
Рис. 3.7. Диаграмма плавкости веществ, образующих неустойчивое химическое соединение AnBm
Как видно из рис. 3.7, соединение СuCl ·2KCl (К2СuСl3) при температуре несколько выше 200 °С распадается на кристаллы KCl и насыщенный раствор, содержащий 60 % СuС1.
Плавление, при котором составы исходной твердой фазы и получающейся жидкости не совпадают, называется инконгруэнтным. В этом случае кривая кристаллизации химического соединения перекрывается кривой кристаллизации компонента (КСl), вследствие чего максимум (точка М) отсутствует.
При образовании химических соединений характер кривых охлаждения смесей может несколько отличаться от кривых 2, 4 на рис. 3.2 а.
Пример 3
Диаграмма плавкости веществ, образующих твердые растворы
Изоморфные смеси. Вещества, молекулы (атомы) которых обладают близкими размерами, поляризуемостью, имеют сходную структуру, кристаллизуются из раствора совместно, образуя непрерывные твердые растворы (изоморфные смеси) – твердую фазу переменного состава. Это объясняется тем, что компоненты способны замещать друг друга в кристаллической решетке, вследствие чего в каждом кристалле содержатся частицы обоих компонентов, и вся твердая фаза представляет собой однородную систему. К таким системам можно отнести Аu – Аg, Мо – W, КВг – KI, К2SO4 – К2Cr2O4, NаАlSi3O8 – СaАl2Si2O8. Все они дают диаграммы плавкости, подобные представленным на рис. 3.8. Здесь кривая охлаждения будет отличаться от кривых 2, 4 на рис. 3.2 а. После ab получают наклонный отрезок, близкий к прямолинейному и отвечающий кристаллизации расплава, а затем – линию охлаждения твердого раствора. На диаграмме плавкости имеются две кривые: верхняя – кривая ликвидуса и нижняя – кривая солидуса. Верхняя кривая выражает состав кристаллов, находящихся в равновесии с расплавом. Поэтому область над ней отвечает условиям существования жидкой фазы, область под кривой солидуса – условиям существования твердого раствора, область между обеими кривыми
– сосуществованию жидкого сплава и смешанных кристаллов. Так, если охлаждать сплав, содержащий 60 % Аu (точка а), то из него начинают выделяться смешанные кристаллы, первая порция которых должна содержать 75 % Аu (точка bI). В процессе отвердевания состав насыщенного раствора будет меняться вдоль отрезка bcI кривой ликвидуса, а состав отвечающей ему твердой фазы – вдоль отрезка bIc кривой солидуса. Последняя капля жидкости будет иметь состав сI, разновесный ей кристалл –

состав с. Дальнейший отвод тепла приведет к охлаждению твердого раствора (вертикаль сd ).
Рис. 3.8. Диаграмма плавкости изоморфной смеси, образующей твердые растворы
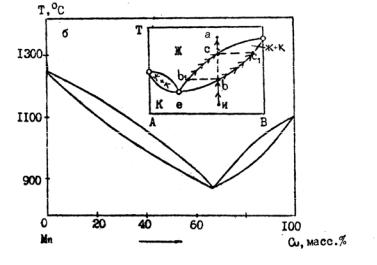
Наряду с системами, представленными на рис. 3.8, встречаются изоморфные системы, диаграммы плавкости которых схематично изображены на
рис. 3.9 (Сu – Ag, Cu2S – Ag2S, KI – КBr, NaOH – КОН, КBО2 – NaBO2, CaSiO3 – SrSiO3 и др.) и 3.10 (например, Ni – Mn). Они представляют собой
как бы две диаграммы типа изображенных на рис. 3.8, сросшиеся по вертикали экстремума. Смыкание кривых ликвидуса и солидуса (точка е) означает тождественность составов сосуществующих фаз. Поэтому для систем, представленных на рис. 3.8, и для любых систем, представленных на рис. 3.10 (кроме смеси е), охлаждение приводит к кристаллизации твердого раствора, состав которого отличается от состава жидкой фазы. Это вызывает постепенное изменение состава расплава и, как следствие, температуры его отвердевания (см. «елочки» на рис. 3.9).
Рис. 3.9. Диаграмма плавкости веществ, образующих твердые растворы (изоморфные системы) с максимумом плавления
(обозначения те же, что и на рис. 3.8)
Для состава же, соответствующего точке е, охлаждение приводит к отвердеванию всей массы при его неизменности, и соответственно кривая охлаждения будет подобна кривым 1, 5 на рис. 3.2 а. Аналогичные рассуждения применимы и к процессам нагревания (рис. 3.10, где а – нагреваемый твердый раствор; bI – cостав первой капли; сI – состав последнего кристалла; всI – кривая составов «тающих» кристаллов; b1с – кривая составов равновесных им жидких растворов).
Рис. 3.10. Диаграмма плавкости веществ, образующих твердые растворы (изоморфные системы) с минимумом точки плавления
Для большинства типов диаграмм плавкости начальные участки кривых кристаллизации ниспадают, и ход их прямолинеен (рис. 3.4 – 3.7). Так, небольшие добавки Рb к Sb или Sb к Рb приводят к пропорциональным им понижениям температур плавления (соответственно Sb и Рb). Исключением являются системы, в которых образуются твердые растворы. Как видно из рис. 3.8 и 3.9, участки линий ликвидуса, примыкающие к осям легкоплавких компонентов, идут на подъем – температура отвердевания раствора оказывается даже больше температуры отвердевания чистого растворителя.
Неизоморфные смеси. Для таких смесей характерна ограниченная растворимость в твердом состоянии. Диаграмму состояния (рис. 3.11) можно рассматривать как сочетание диаграмм рис. 3.2 б и 3.8. Левее г и правее q она сходна с диаграммой изоморфных смесей, с той лишь разницей, что вследствие частичной взаимной растворимости из расплавов кристаллизуются не А и Б, а твердые растворы (соответственно Б в А и А в Б). Поэтому нижняя часть диаграммы подобна диаграмме, приведенной на рис. 3.12.
Рассмотрим диаграмму в соответствии с правилом фаз и проследим за изменениями, происходящими с жидкостями различного состава при их охлаждении.
Точка 1. При T1 происходит выпадение твердого раствора, концентрация которого отвечает растворимости вещества Б в А при этой температуре

(точка з). При Т2 исчезает последняя капля расплава состава к и затем происходит охлаждение твердого раствора. Таким образом, процесс охлаждения смеси I совпадает с процессом охлаждения изоморфных систем
(рис. 3.8).
Рис. 3.11. Кривые охлаждения (а) и диаграмма плавкости (б) неизоморфной смеси, образующей твердые растворы
Точка 2. Если охлаждать данную смесь, то последняя капля ее будет иметь состав э, а твердый раствор – состав г.
Точка 3. |
При Тэ кристаллизуется эвтектика, состоящая из смеси твердых |
растворов г |
и q . То же будет наблюдаться и для смеси, более богатой |
веществом Б, с той лишь разницей, что сначала выпадает раствор А в Б, а затем (при Тэ) эвтектика (твердый раствор Б в А + твердый раствор А в Б). После исчезновения жидкой фазы состава э начнут снижаться температура, изменяться состав твердых растворов г и q (соответственно вдоль кривых ге, qж) и соотношение между ними. Следует, однако, отметить, что вследствие небольшой величины теплот растворения состав твердых насыщенных растворов очень мало изменяется с температурой. Поэтому линии ге и qж близки к вертикалям. Но даже в случае значительного наклона линий ге и qж составы г и q при охлаждении почти не меняются из-за малой скорости диффузии втвердых растворах.
Пример 4
Диаграмма температура – состав для ограниченно смешивающихся жидкостей
При весьма значительном положительном отклонении от идеальности раствора происходит нарушение гомогенности – обе жидкости оказываются взаимно растворимыми только до определенного предела. Поэтому если к первой жидкости прибавлять вторую, то в конце концов образуется насыщенный раствор; то же произойдет и при прибавлении ко второй
жидкости первой. При переходе от индивидуальных веществ к растворам давление пара будет непрерывно изменяться, оставаясь одинаковым над обоими насыщенными растворами, независимо от того, каково соотношение между растворами и каковы давления паров чистых жидкостей. (Равенство давлений над сопряженными растворами отвечает правилу Коновалова.)
Возьмем жидкости А и Б (рис. |
3.12) и при Таб = const приготовим |
промежуточные смеси с различным |
количественным соотношением, но так, |
чтобы общая масса систем оставалась неизменной.
Для перемещения от точки а до точки б включительно необходимо одновременно с прибавлением жидкости Б отбирать соответствующее
количество жидкости А. При этом вдоль аб |
будет образовываться раствор Б |
||
в А вплоть до точки |
м |
(состав В), |
соответствующей насыщенному |
раствору Б в А. Дальнейшее увеличение содержания Б приведет к образованию второй фазы – насыщенного раствора А в Б (состава Д).
По мере прибавления Б соотношение между сопряженными растворами изменится: количество фазы состава Д (точка н) возрастет, а количество
фазы |
состава В (точка м) уменьшится. Так, если количество А и Б в обеих |
||||
фазах |
определяется точкой системы и, то согласно правилу рычага: |
||||
|
колич.раствора В |
отрезок |
ин |
, |
|
|
|
|
|
||
|
колич.раствора Д |
отрезок ми |
|||
раствора состава В примерно в 3 раза больше раствора состава Д. Когда в
результате дальнейшего увеличения |
концентрации Б соотношение между А |
и Б будет отвечать точке н, то |
раствор состава В исчезает (его плечо |
становится равным нулю), при дальнейшем прибавлении Б образуется ненасыщенный раствор А в Б. С исчезновением одной из фаз система становится двухвариантной.
На основе изложенного нетрудно проанализировать изменение свойств системы в процессе прибавления А к Б.
При повышении температуры фазовые точки м и н поднимаются и сближаются (так как увеличивается взаимная растворимость жидкостей). Уменьшение разницы в составах сопряженных растворов объясняется тем, что процессы растворения Б в А и А в Б эндотермичны, т.е. теплоты растворения ( Нраств.) положительны, точнее, растворение 1 моля вещества в бесконечно большом количестве его насыщенного раствора должно сопровождаться поглощением тепла для обоих растворов. Поэтому в соответствии с принципом Ле-Шателье подвод тепла благоприятствует растворению.
Кривые ЕмК и ЖнК характеризуют влияние температуры на растворимость соответственно Б в А и А в Б. Точка К (в которой оба раствора тождественны по составу, т.е. существует одна жидкая фаза) называется
критической точкой растворения или точкой Алексеева. В ней система условно безвариантна. При Т ≥ ТК оба компонента смешиваются в любом соотношении. Таким образом, часть диаграммы, ограниченная кривой ЕКЖ, отвечает двухфазной, а часть, находящаяся вне кривой, – гомогенной

области. Поэтому при нагревании до Таб смесь состава В будет двухфазной, а при более высокой температуре – однофазной. То же будет наблюдаться и для состава Д, с той лишь разницей, что в первом случае нагревание приведет к уменьшению количества раствора А в Б и к исчезновению этого раствора в точке м, во втором случае при нагревании будет уменьшаться количество раствора Б в А: этот раствор исчезает в точке н. Если же взять смесь состава М, то при нагревании обе фазы исчезают одновременно (в точке К); при этом в процессе нагревания граница раздела между фазами будет перемещаться, так как кривые ЕмК и ЖнК в общем случае ассиметричны. Наоборот, при охлаждении однофазная смесь распадается на два раствора (рис. 3.12).
Рис. 3.12. Диаграмма температура – состав для ограниченно смешивающихся жидкостей с верхней критической точкой
C6H5N, масс. %
Рис. 3.13. Диаграмма состояния системы вода – триэтиламин с нижней критической температурой растворения
Согласно правилу Алексеева, точки, делящие конноды пополам, ложатся на прямую линию (ИК на рис. 3.12). Это правило позволяет восполнить экспериментальные данные о взаимной растворимости жидкостей, а также найти состав в критической точке по известному значению Ткр. Оно является

приближенным и точнее соблюдается при выражении состава в весовых процентах.
В тех случаях, когда проявляется стремление к химическому взаимодействию, взаимная растворимость жидкостей с повышением температуры уменьшается. В подобных случаях конноды сокращаются при понижении температуры. Такие системы (например, триэтиламин – вода, диэтиламин – вода, β коллидин – вода и др.) обладают нижней критической точкой (рис. 3.13).
Имеются системы с двумя критическими точками (верхней и нижней). К ним относятся, например, системы никотин – вода, 2-метилпиперидин – вода, глицерин–м–толуидин (рис. 3.14).
Состав, масс. % никотина
3.14.Диаграмма состояния системы вода – никотин
сверхней и нижней критическими температурами растворения
3.7. Водно-солевые системы
Простейшие системы соль – вода (или другой растворитель) являются частными случаями рассмотренного типа бинарных систем с тем лишь отличием, что температура плавления соли лежит обычно очень высоко, часто выше критической температуры растворителя. Поэтому приготовить смеси жидкая (расплавленная) соль + растворитель практически невозможно. Другими словами, правая часть диаграммы типа «сурьма – свинец» (рис. 3.4) в большей или меньшей близости к точке В (температуре плавления
соли) не реальна |
(рис. 3.15). |

Рис. 3.15. Диаграмма растворимости |
Рис. 3.16. Диаграмма растворимости |
CrО3 в воде |
AgNO3 в воде |
Одним из редких исключений является соль AgNO3, смешивающаяся с водой во всех отношениях (рис. 3.16). На этой диаграмме точка А – точка плавления льда. Она понижается вплоть до эвтектической точки К, где раствор AgNO3 в Н2О (47,1 %) замерзает сплошь. Вдоль кривой АК из растворов (с различным относительным содержанием компонентов) выделяется лед. Кривая КВ – кривая плавкости смесей AgNO3 + Н2О, обычно называемая кривой растворимости AgNO3. Справа от КВ – область пересыщенных растворов, легко распадающихся на кристаллы AgNO3 и насыщенный раствор.
Эвтектика в таких системах называется криогидратом, точка К – криогидратной точкой, а отвечающая ей температура – криогидратной температурой.
Термин криогидрат – отголосок того времени (той эпохи), когда считали, что эвтектика и, в частности, криогидрат – химическое соединение. Он был введен во второй половине XIX в. при сложившемся убеждении: двухкомпонентная система из воды и соли при наиболее низкой температуре затвердевания кристаллизуется в виде соединений соли с водой, подобно кристаллогидратам.
Позднее твердо установлено, что криогидрат – тонкая механическая смесь кристаллов льда и соли. Тот факт, что криогидрат (подобно любой эвтектике) есть механическая смесь, а не химическое соединение, доказывается не только неподчинением его состава закону кратных отношений, но и результатам непосредственных микроскопических исследований криогидратов окрашенных солей.
Различные соли дают самые разнообразные криогидратные температуры. Так как криогидраты плавятся при постоянных пониженных температур, они служат источниками таких температур.
3.8. Трехкомпонентные системы
На рис. 3.17 представлена диаграмма взаимной растворимости трех жидкостей А, Б и В. Кривой EКЖ она делится на две части. Область, расположенная на ней, отвечает неограниченной растворимости, под ней – ограниченной растворимости. В тех случаях, когда компоненты А и Б
