
2-ХТ-45 подготовка к КР
.pdfФАЗОВЫЕ ПЕРЕХОДЫ И ФАЗОВЫЕ РАВНОВЕСИЯ
3.1. Фазовые переходы первого и второго рода
Наряду с процессами, сопровождающимися химическими превращениями, для химии, физики и многих других естественных наук значительный интерес представляют физические процессы перехода чистых веществ из одного агрегатного состояния в другое (превращения одной фазы данного вещества в другую фазу того же вещества). Например, процессы плавления, испарения, возгонки, а также полиморфные превращения твердых тел. Такие процессы относятся к фазовым переходам первого рода. Они характеризуются равенством изобарно-изотермических потенциалов двух сосуществующих в равновесии фаз (G1 = G2) и скачкообразными изменениями энтропии и объема при переходе из одной фазы в другую.
Кроме фазовых переходов первого рода, существуют также фазовые переходы второго рода. Для них характерно не только равенство изобарноизотермических потенциалов, но и равенство энтропий и объемов сосуществующих в равновесии фаз, то есть отсутствие теплового эффекта процесса и изменения объема при температуре превращения ( G = 0, S = 0, V = 0). К фазовым переходам второго рода относятся многие превращения, весьма различные по своему характеру и природе фаз. Такими, например, являются превращения ферромагнитных тел при температуре, называемой точкой Кюри, выше которой тела теряют ферромагнитные свойства; превращение металлов в сверхпроводники при низких температурах; процессы распада и образования интерметаллических
соединений в твердых металлических растворах и т.д. |
|
Обратимся к фазовым переходам первого рода. Их |
основной |
характеристикой является температура, при которой фазы находятся в равновесии – температура фазового превращения (точка перехода). Последняя для чистых веществ не зависит от условий опыта, количества равновесных фаз, а зависит только от давления, что может быть доказано на основе второго закона термодинамики.
Так, температура плавления льда или температура перехода α – Fe в γ –
Fe изменяется в зависимости от р. При данной температуре давление насыщенного пара (в равновесии с жидкостью) имеет вполне определенное значение. То есть состояние равновесия определяется связью между равновесной температурой и равновесным давлением.
Зависимость температуры фазового превращения от давления была найдена Клапейроном в 1834 г. и затем более строго обоснована Клаузиусом
в1850 г.
Уравнение Клапейрона – Клаузиуса
Рассмотрим равновесный переход одного моля вещества из одной фазы
(1) в другую (2), совершающийся при постоянном давлении.
Соответствующее изменение внутренней энергии системы при совершении только работы расширения равно
U2 – U1 = T(S2 – S1) – р(V2 – V1),
откуда |
|
|
|
|
U2 |
TS2 |
рV2 U1 |
TS1 |
рV1 |
, |
||||
|
G1 |
|
G2 |
|
или |
|
(3.1) |
|
G1 = G2. |
|
|
|
|
|
То есть изобарно-изотермические потенциалы одного моля чистого вещества в двух фазах, находящихся в равновесии, равны между собой. Запишем для них выражения полных дифференциалов
d G1 V1 d p S1 d T , d G2 V2 d p S2 d T .
Вычитая верхнее уравнение из нижнего, получим
d G2 d G1 (V2 V1 )dp ( S2 S1 )d T .
Изменения р и Т здесь не независимые, а такие, при которых сохраняется
равновесие между фазами 1 и 2. То есть между р и Т существует функциональная связь, соответствующая фазовому равновесию. Поэтому, если G1 = G2 (равновесие при давлении р и температуре Т ), то G1 + dG1 = G2
+dG2 (равновесие при давлении р + dp и температуре Т + dT), отсюда
Следовательно,
или
(3.2)
dG1 = dG2 |
или dG1 – dG2 = 0. |
(V2 – V1) dp – (S2 – S1) dT = 0
d p S2 S1 . d T V2 V1
Взаимное превращение фаз здесь рассматривается как обратимый (равновесный) и изотермический процесс. Поэтому, согласно II закону термодинамики,
S2 S1 |
Q |
|
|
, |
(3.3.) |
|
T |
|
T |
|
|
где λ – теплота фазового превращения – перехода 1 моля вещества из фазы 1
вфазу 2; V2 – V1 – разность мольных объемов двух фаз. Из уравнений (3.2) и (3.3) следует

|
dp |
|
|
|
|
|
|
(3.4) |
||
|
dT |
Т(V |
|
V ) |
||||||
|
|
|
|
|
||||||
|
|
|
|
2 |
|
1 |
|
|
||
или Т |
dp |
(V |
|
V ) . |
(3.5) |
|||||
|
|
|||||||||
|
|
|
dT |
2 |
1 |
|
|
|||
|
|
|
|
|
|
|
|
|||
Можно отнести все величины к 1 г вещества. Тогда
dp |
|
|
L |
|
|
(3.6) |
|
dT |
Т(V |
V ) |
|
||||
|
|
|
|||||
|
|
2 |
1 |
|
|
|
|
|
|
или |
|
L Т |
dp |
(V |
V ), |
|
|
|
|
||||
|
|
|
|
|
dT |
2 |
1 |
|
|
|
|
|
|
(3.7) |
|
|
|
|
|
|
|
|
|
где L = λ/М; М – молекулярная масса.
Уравнение (3.4) или (3.6) – уравнение Клапейрона – Клаузиуса в своей первоначальной форме.
Наибольшее распространение получила другая форма записи уравнения Клапейрона – Клаузиуса. К ней можно подойти, используя уравнение (3.4), в частности для испарения, 1 и ряд допущений.
Запишем уравнение (3.4) для процесса испарения
dp |
|
исп |
|
||
|
|
|
. |
(3.8) |
|
dT |
Т(V |
V ) |
|||
|
|
2 |
1 |
|
|
Теплота испарения положительна. В этом случае объем (удельный, мольный) газа больше соответствующего объема жидкости, то есть в уравнении (3.8)
всегда V2 > V1. Поэтому dр/dТ, а значит, и dТ/dр всегда положительны. Следовательно, температура испарения повышается с ростом давления.
При температурах, далеких от критической (намного ниже), плотность насыщенного пара во много раз меньше плотности жидкости, а обратная
величина – мольный |
(удельный) объем |
во |
много |
|
раз больше мольного |
||||||||||||||
(удельного) объема жидкости. Поэтому значением |
V1 = Vж |
в уравнении |
|||||||||||||||||
(3.8) можно пренебречь, и оно примет вид |
|
|
|
|
|
|
|
|
|||||||||||
|
dp |
|
|
исп |
|
или |
|
|
|
Т |
dp |
|
V . |
(3.9) |
|||||
|
|
Т V |
|
|
dT |
|
|||||||||||||
|
dT |
|
|
|
|
исп |
|
|
|
г |
|
||||||||
|
|
|
|
|
г |
|
|
|
|
|
|
|
|
|
|
|
|
||
Если вдали от критической температуры насыщенный пар можно считать |
|||||||||||||||||||
идеальным газом, тогда Vг= RT/р, |
и из уравнения (3.9) имеем |
|
|||||||||||||||||
|
|
|
|
|
RT 2 |
dp |
|
1 |
RT 2 |
d ln p |
|
|
или |
|
|||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
исп |
|
|
dT |
p |
|
|
dT |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1 Из всех фазовых переходов I рода наибольший интерес представляют плавление и испарение.
d ln p |
|
исп |
. |
(3.10) |
dT |
|
|||
|
RT 2 |
|
||
Аналогичным уравнением можно описать и процесс возгонки:
d ln p |
|
возг. |
, |
(3.11) |
dT |
|
|||
|
RT 2 |
|
||
а общий случай фазового превращения – уравнением
d ln p |
|
|
. |
(3.12) |
|
dT |
RT 2 |
||||
|
|
|
Считая теплоту испарения (возгонки) постоянной в небольшом интервале температур и представив уравнение (3.12) в виде определенного и неопределенного интервалов, получим
ln |
p2 |
|
( T2 |
T1 ) |
или |
lg |
p2 |
|
|
|
|
|
|
(T2 T1 ) |
, |
|
(3.13) |
|||||||
p |
p |
4,575 |
|
|
|
|||||||||||||||||||
|
|
|
RT T |
|
|
|
|
|
T T |
|
|
|
|
|||||||||||
|
1 |
|
|
|
1 |
2 |
|
|
|
1 |
|
|
|
|
|
|
1 |
2 |
|
|
|
|
||
ln p |
|
1 |
c |
или |
lg p |
|
|
|
|
1 |
|
|
c |
|
A |
B . |
(3.14) |
|||||||
T |
4,575 |
T |
2,303 |
T |
||||||||||||||||||||
|
|
|
|
R |
|
|
|
|
|
|
|
|
|
|
||||||||||
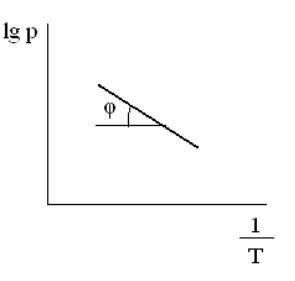
В соответствии с уравнениями (3.14) зависимость давления насыщенного пара жидкости (или кристаллического вещества) от температуры может быть
выражена прямой линией в координатах lg p |
1 |
(рис. 3.1). В этом случае |
|
T |
|||
|
|
тангенс угла наклона прямой равен λ / 4,575, откуда легко находится λ .
Рис. 3.1. Зависимость давления насыщенного пара от температуры
в координатах lg p |
1 |
|
T |
||
|

Такая зависимость имеет место лишь в некотором (небольшом) интервале температур, далеких от критической. Однако во всем интервале температур – от температуры плавления до критической – уравнение (3.14) не охватывает зависимости давления насыщенного пара от температуры. Часто они оказываются сложными функциями. Несоответствие между уравнением
(3.14) и реальными формами зависимости p = f(T) обусловлено следующим: 1.Теплота испарения (возгонки) зависит от температуры и
интегрирование должно производиться с учетом этой зависимости.
2. Насыщенный пар при высоких температурах нельзя считать
идеальным газом. Поэтому уравнение, охватывающее зависимость p = f(T) в широком интервале температур, неизбежно становится эмпирическим. Такое уравнение можно получить на основании уравнения Клапейрона – Клаузиуса, применив к процессу парообразования уравнение Кирхгоффа. Для случая испарения оно принимает вид
d |
Cнас.п. Сж ~ Ср( п) Ср( ж ) ~ Ср |
2. |
(3.15) |
|
dT |
||||
|
|
|
Интеграл уравнения (3.15) можно записать
Т
о СрdT ,
о
где λо – постоянная величина, получаемая экстраполяцией кривой λ = f (T) до 0 К.
Подставляя это выражение в уравнение Клапейрона – Клаузиуса (3.12), с учетом эмпирической зависимости теплоемкости от температуры (2.38), находим
lg p |
o |
|
a |
lg T |
в |
T |
e |
T 2 ... const . |
(3.16) |
|
4,575 T |
1,987 |
4,575 |
2 4,575 |
|||||||
|
|
|
|
|
|
Нернст упрощает уравнение (3.16) тем, что принимает а /1,987 = 7/2·2= ~ 1,75, ограничивается только одним членом после логарифмического и вводит обозначение – Е, вместо в.
lg p |
o |
1,75lg T |
E |
T i . |
(3.17) |
|
4,575T |
4,575 |
|||||
|
|
|
|
Для вычисления λо, Е, i требуется ряд опытных определений р и Т. Обычно эти константы подбираются эмпирически; величина i называется
2 Замена на Ср возможна только при невысоких давлениях, при высоких давлениях – является грубым допущением.
условной химической постоянной. Она для многих веществ, молекулы которых состоят из двух, трех и более атомов, близка к трем (если р в атм).
Как показывает уравнение (3.17), кривая зависимости давления пара от температуры должна быть значительно проще, если откладывать на оси
абсцисс 1/Т, а на оси ординат lg p. Действительно, в ряде случаев получают практически прямые линии, что свидетельствует об очень малом суммарном влиянии членов с Т, Т 2 в данном уравнении.
3.2. Равновесие в гетерогенных системах, состоящих из любого числа веществ (компонентов) и любого числа фаз
Равновесию гетерогенных систем соответствует равенство химических потенциалов каждого компонента во всех фазах, а также минимальное значение одного из термодинамических потенциалов и максимальное значение энтропии всей системы при соответствующих условиях.
Так как наиболее часто встречающимися (обычными) условиями на практике являются постоянные температура и давление, равновесие гетерогенных систем оценивается по их изобарно-изотермическому потенциалу.
При изучении равновесия гетерогенных систем возможны два принципиально различных случая.
Если в систему входит хотя бы одна фаза, состав которой изменяется в процессе приближения к равновесию, то для этой фазы может быть найдена константа равновесия, которая и определит конечное равновесное состояние всей системы. Такое наблюдается, например, в случае системы, состоящей из индивидуальных веществ в конденсированном состоянии и газов.
Если же система состоит из индивидуальных веществ только в конденсированном состоянии, то есть состав фаз в ходе реакции не изменяется, то понятие константа равновесия делается неприложимым, и
реакция идет до полного исчезновения одного из исходных веществ. Это становится понятным, если учесть, что закон действующих масс отражает закономерности, относящиеся к равновесию в однородных (гомогенных) системах.
Общие закономерности, которым подчиняются равновесные гетерогенные системы, состоящие из любого числа фаз и любого числа веществ, выражаются правилом фаз, установленным Гиббсом в 1876 г.
Систематическим анализом вопросов о равновесии гетерогенных систем занимались Н.С. Курнаков и его ученики.
Основными понятиями правила фаз Гиббса являются фаза, компонент,
степень свободы.
Фаза – совокупность всех гомогенных частей системы, одинаковых во всех точках по составу, по всем химическим и физическим свойствам (не
зависящим от количества) и отделенных (отграниченных) от других частей некоторой поверхностью раздела.
Так, газовая смесь всегда представляет собой одну фазу, так как газы смешиваются между собой во всех отношениях, а жидкости в случае ограниченной взаимной растворимости могут образовать две и большее число фаз (слоев).
В системе, состоящей из воды и льда, все куски льда образуют одну фазу, а вода – другую фазу. То есть каждое твердое вещество образует одну фазу, независимо от его раздробленности, так как при наличии поверхностей раздела и даже прослоек другого вещества по составу и всем свойствам все кристаллы (куски) данного вещества ничем не отличаются друг от друга.
Когда одно твердое вещество растворимо в другом и система представляет собой однородную смесь двух твердых веществ, она тоже рассматривается как одна фаза.
Система, состоящая из жидкости и ее пара, имеет две фазы – жидкую и парообразную. Система, включающая насыщенный раствор соли, осадок соли на дне и насыщенный пар над раствором, является трехфазной (фазы – пар, жидкий раствор, твердая соль).
Рассмотрим более сложный случай: в замкнутом сосуде имеется углекислый кальций при температуре около 825 оС. При этой температуре он частично разлагается на СаО и СО2. В такой системе имеются три фазы – две твердые (СаО и СаСО3) и одна газообразная (СО2).
Поверхности раздела фаз образуются некоторым количеством молекул, расположенных на границе области, заполненной данной фазой. Молекулы, образующие поверхностный слой, находятся в особых условиях, поэтому поверхностный слой обладает свойствами (например, избыточной внутренней энергией), не присущими веществу, находящемуся в глубине фазы. Образования, состоящие из небольшого числа молекул, не могут быть разделены на поверхностный слой и внутреннюю массу вещества, поэтому к таким образованиям понятие фаза неприложимо.
Составляющие вещества, компоненты, число компонентов системы
Каждое вещество, входящее в состав системы, которое может быть выделено из нее и существовать независимо, называется составляющим веществом системы.
Например, водный раствор сахара образован двумя составляющими – водой и сахаром. Составляющими веществами водного раствора электролита, например, хлористого натрия являются электролит (NaCl) и вода. Ионы (в данном случае Na+ и Cl–) к составляющим веществам не могут быть причислены: являясь самостоятельно перемещающимися, кинетически независимыми частицами в растворе, вне его, то есть вне системы, они не существуют.
Количество каждого из составляющих веществ, входящих в систему, в которой отсутствуют химические реакции, не зависит от количества других

веществ. В таком случае состав фаз равновесной системы определяется концентрациями всех составляющих веществ.
Если в системе протекают химические реакции, то количества составляющих веществ, входящих в равновесную систему, зависят друг от друга, и состав фаз такой системы можно определить, зная концентрации лишь части составляющих веществ.
Составляющие вещества, концентрации которых определяют состав фаз данной равновесной системы, называются независимыми составляющими веществами или компонентами системы. Другими словами, компоненты системы – независимые составляющие, наименьшего числа которых (знания концентраций которых) достаточно для определения состава всей равновесной системы.
Свойства системы определяются не тем, какие составляющие вещества выбраны в качестве компонентов (или могут быть любые составляющие вещества), а их числом, то есть числом компонентов.
Подсчет числа компонентов системы производится следующим образом. Если вещества, входящие в состав системы, между собой химически не взаимодействуют, то равновесие в системе может быть достигнуто при любых концентрациях каждого из них. В этом случае число компонентов в системе равно числу составляющих веществ. Например, в смеси, состоящей из газообразных водорода, гелия и аргона, число компонентов равно трем. При наличии химического взаимодействия между веществами, образующими систему, с каждым уравнением, связывающим их концентрации, число компонентов в системе уменьшается на единицу. Следовательно, число компонентов равно числу составляющих веществ за вычетом числа уравнений, связывающих концентрации этих веществ в
равновесной системе.
Например, система состоит из газообразных водорода, йода и йодистого водорода, реагирующих между собой по уравнению
Н2 (г) + J2 (г) = 2 НJ (г).
При равновесии концентрации составляющих веществ подчиняются уравнению
HJ 2 K ,
H2 J2
где К – константа равновесия, имеющая определенное значение при заданной температуре.
В этом случае для определения состава равновесной системы (смеси) достаточно знать концентрации двух произвольно взятых веществ, так как концентрацию третьего вещества (она будет иметь строго определенное значение) можно найти по уравнению. То есть в системе имеется только два независимых составляющих вещества или два компонента.
Другими словами, физический смысл найденного числа компонентов заключается в том, что, имея любые два из перечисленных трех веществ,

можно получить равновесную систему с помощью химической реакции, осуществляемой в прямом и обратном направлениях.
Если концентрации названных трех веществ связаны двумя
уравнениями, например, HJ 2 |
|
[Н2] = [J2] , |
H2 J2 K |
и |
тогда число независимых составляющих (и их концентраций) уменьшится на два. Это означает, что в данной системе лишь одно независимое составляющее вещество и она однокомпонентна.
Число степеней свободы
Число степеней свободы – число независимых параметров3 (условий) состояния системы (температура, давление, концентрация компонентов), которые можно в известных пределах произвольно изменять, не изменяя этим числа и вида равновесных фаз системы.
Термин «число степеней свободы системы» часто заменяют кратным термином «вариантность системы». В соответствии с этим системы подразделяются на нонвариантные (число степеней свободы f = 0),
моновариантные (f = 1), дивариантные (f = 2) и т.д.
Так, система, состоящая одновременно из льда, жидкой воды и пара, сосуществующих совместно только при Т = 0,0075 оС и Р = 4,579 мм рт.ст., нон-вариантна, так как малейшее изменение температуры или давления повлечет за собой либо превращение воды в лед или в пар, либо наоборот. Для системы вода–пар существует одна степень свободы: не изменяя числа фаз системы, можно по своему усмотрению выбирать либо температуру, либо давление. Изменять оба параметра независимо (без изменения числа фаз) нельзя, так как каждому давлению должна соответствовать определенная температура и наоборот. Для системы, представляющей собой либо лед, либо жидкую воду, либо пар, число степеней свободы равно двум, то есть в известных пределах произвольно можно изменять и температуру, и давление.
Правило фаз
Это правило устанавливает соотношение между числом фаз ( f ), числом компонентов ( К ) и числом степеней свободы ( С ).
Как уже отмечалось, уравнение, математически выражающее такое соотношение, было выведено Гиббсом. При этом в основу положены некоторые известные сведения из математики.
С точки зрения математики свойства любой системы являются ее переменными. Среди них на основании опыта выбирают независимые переменные, через которые выражают другие зависимые свойства системы и так определяют ее состояние.
3 На языке математики – число независимых переменных.
Число независимых переменных равно разности общего числа переменных и числа связывающих их уравнений.
В рассматриваемом случае число независимых переменных равно числу степеней свободы, а общее число переменных – числу тех переменных (параметров), которые определяют состав и состояние системы (всех ее равновесных фаз).
Такими переменными являются: во-первых, температура и давление, а во-вторых, концентрации компонентов в каждой фазе.
Во всех фазах равновесной гетерогенной системы температура и давление одинаковы, одинаковы и химические потенциалы каждого из компонентов.
Составим уравнения, выражающие эти условия равновесия для наиболее
общего случая, когда гетерогенная система состоит из |
f фаз, в каждую из |
|
которых входят все К компонентов без исключения. |
|
|
Т I = T II = T III = ··· T f, |
|
|
pI = pII = pIII = ···p f, |
(3.18) |
|
II |
III IIII If , |
|
2I |
2II 2III 2f , |
(3.19) |
кI |
кII кIII к f . |
|
(нижними индексами обозначены компоненты, а верхними – фазы).
Подсчитаем общее число переменных П – общее число параметров состояния системы. Для каждой фазы нужно знать столько концентраций, сколько имеется компонентов. Поэтому для всех f фаз число параметров, характеризующих концентрации, равно Кf. Учитывая еще два общих для всей системы параметра – температуру и давление, найдем
П = K f + 2.
Важно отметить, что не все эти параметры (переменные) независимы друг от друга. Так, концентрации компонентов в разных фазах связаны условиями равенства химических потенциалов, то есть совокупностью уравнений (3.19).
Так как величина μ какого-либо компонента в данной фазе равна его химическому потенциалу во всех остальных фазах, то число уравнений,
связывающих все величины μ для одного компонента, составит (f – 1) и соответственно для К компонентов – К (f – 1). Кроме того, для каждой фазы существует одно уравнение состояния, а для всей системы, состоящей из f фаз, число таких уравнений f.
