
- •Лекція № 6. Транскрипція: еукаріоти
- •Промотор рнк-полімерази іі
- •Базальні фактори транскрипції
- •Ініціація транскрипції рнк-полімеразою іі
- •Ініціація транскрипції рнк-полімеразою ііі
- •Механізми активації транскрипції
- •Транскрипційні фактори
- •Зовнішня регуляція активності транскрипційних факторів
- •Ацетилювання гістонів
- •Доступність промоторів
- •Комплекси ремоделювання хроматину
- •Роль білків hmg в активації транскрипції
- •Елонгація рнк-полімерази через хроматин
- •Конститутивна репресія транскрипції: гетерохроматин
- •Деацетилювання гістонів
- •Метилювання днк
- •Контрольні запитання
- •Рекомендована література
Конститутивна репресія транскрипції: гетерохроматин
Великий розмір еукаріотичного геному (майже половина якого припадає на послідовності, що повторюються) вимагає існування систем, які б визначали гарантовану інактивацію значної частини генетичного матеріалу. При цьому інактивований стан як некодуючої ДНК, так і значної частини генів у клітинах певного типу має відтворюватись у дочірніх клітинах після мітозу.
Успадкування такої тканино-специфічної системи репресії (при збереженні повної генетичної програми даного організму) називають епігенетичною спадковістю. В її основі лежить передача клітинам-нащадкам не просто батьківської ДНК, а хроматину разом із певними хімічними маркерами (маються на увазі патерни посттрансляційних модифікацій гістонів і метилювання ДНК). Такі маркери впізнаються відповідними білками, котрі вступають у різноманітні взаємодії з репресорами та корепресорами транскрипції, ферментами, що здійснюють посттрансляційні модифікації, і білками, які додатково компактизують хроматинову фібрилу. Подібні системи в першу чергу працюють у ділянках гетерохроматину – частини хроматину, що зберігає високий ступінь компактності протягом інтерфази.
Прикладами конститутивного гетерохроматину (такого, що утворюється в усіх клітинах) є теломерні та центромерні зони хромосом, одна з Х-хромосом самок ссавців. Інші гетерохроматинові зони є специфічними для клітин певного типу.
Деацетилювання гістонів
Якщо ацетилювання гістонів завжди корелює з підвищеною транскрипційною активністю, деацетилювання, яке здійснюється гістондеацетилазними комплексами (HD), завжди пов’язане з репресією. Як і ацетилтрансферази, деацетилази постійно безадресно працюютьу хроматині, підтримуючи певний базовий баланс ацетилювання / деацетилювання гістонів. При активації певного промотора ацетилтрансферази здійснюють адресне гіперацетилювання, а після зникнення активуючого сигналу HD повертають промотор до базового неактивного стану. Деацетилази також можуть бути адресно рекрутовані до промоторів репресорами транскрипції для підтримання гарантованого деацетильованого статусу.
Поряд із такою динамічною регуляцією активності, деацетилювання гістонів завжди здійснюється в гетерохроматинових ділянках. Прикладом, який демонструє визначальну роль деацетилювання у підтриманні гетерохроматинового стану є теломери дріжджів (рис. 24).

Рис. 24. Розповсюдження та самопідтримання гетерохроматинового стану в теломерах дріжджів.
Теломерні повтори на кінці хромосоми впізнаються ДНК-зв’язувальним білком Rap1 (Repressor activator protein), який рекрутує білок Sir4 (Silencing information regulator). Цей останній зв’язує ще два білки – Sir3 та Sir2, останній є гістондеацетилазою. Sir2 здійснює деацетилювання Lys16 гістону Н4. Цей деацетильований залишок упізнається новим Sir3, утворюється новий Sir-комплекс, здійснюється деацетилювання нової нуклеосоми – процес деацетилювання та збирання Sir-комплексу розповсюджується вздовж фібрили. Розповсюдження гетерохроматинової зони блокуються межею, фізична природа якої є не зовсім зрозумілою.
За рахунок взаємодії між Sir-комплексами на кінцях хромосоми утворюється компактна зіперподібна структура (рис. 24). Утворення подібних структур завдяки певним білкам є досить загальною ознакою інших гетерохроматинових ділянок.
НР1-залежна система репресії
Білок НР1 (Heterochromatin Protein 1) містить два структурні домени: хромодомен (модуль, що впізнає метильовані лізинові залишки) і так званий хромошедоу (chromoshadow) – домен, який має спорідненість до певних специфічних HD і гістонметилтрансферази (HMT), а також здатен взаємодіяти з іншою молекулою НР1.
Прикладом залучення НР1 до утворення гетерохроматину є центромери хромосом (рис. 25). Деацетилювання Lys9 і Lys14 гістону Н3 сприяє зв’язуванню специфічної НМТ, яка здійснює метилювання Lys9 гістону Н3. Цей метильований Lys (MeLys9) упізнається хромодоменом НР1. Завдяки хромошедоу домену НР1 рекрутує HD, яка підтримує деацетильований статус суміжних нуклеосом, і ту саму НМТ, що здійснює метилювання Lys9 у складі суміжних нуклеосом: знов виникає лавиноподібний процес, що самопідтримується та розповсюджується на сусідні ділянки. Взаємодія між білками НР1 (деталі якої не з’ясовані) забезпечує додаткову компактизацію фібрили. Природа обмежувача, який не дозволяє гетерохроматину розповсюджуватися поза центромерну зону, не з’ясована, але гранична ділянка містить свій специфічний маркер – метильований Lys4 гістону Н3 (і деметильований Lys9).

Рис. 25. Розповсюдження та самопідтримання гетерохроматинового стану в центромерах. На вставках: стан модифікацій двох ключових залишків у N-кінцевому хвості гістону Н3.
При реплікації білки тимчасово знімаються з ДНК у точці реплікаці. Реплікація ДНК здійснюється нерівномірно – гетерохроматин реплікується в останню чергу. За точкою реплікації гістони батьківського хроматину (які несуть на собі гетерохроматинові маркери) повертаються на дочірні молекули ДНК разом із гістонами, синтезованими de novo, НР1 також повертається на той самий локус, де він був присутній, і відновлює патерни модифікацій гістонів і компактний (репресований) стан гетерохроматинової ділянки, тобто, гетерохроматиновий стан даного локусу відтворюється в дочірніх клітинах. При цьому НР1 має спорідненість до білків ламіни, що зумовлює розташування гетерохроматину в периферичних зонах клітинного ядра.
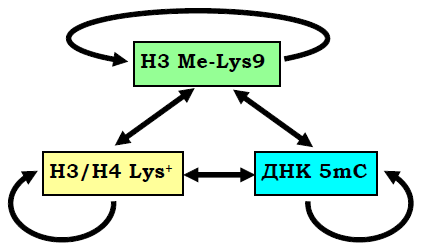
Рис. 26. Взаємний вплив деацетилювання гістонів,метилювання Lys9 гістону Н3 і метилювання ДНК у гетерохроматині.
Подібна система репресії за участю НР1 широко використовується в інших ділянках гетерохроматину, а також для гарантованого блокування генів в еухроматинових зонах. Метилювання Lys9 гістону Н3 та деацетильований стан лізинів гістонів Н3/Н4 є найхарактернішою ознакою таких ділянок. Як описано вище, обидві модифікації самопідримуються та підтримують одна одну через опосередковану дію НР1. При цьому важливу роль у забезпеченні репресованого стану відіграє метилювання цитозинів ДНК – інша ковалентна модифікація, яка також відновлюється при клітинному поділі й замикає своєрідне коло репресії (рис. 26).
