
- •Лекція № 6. Транскрипція: еукаріоти
- •Промотор рнк-полімерази іі
- •Базальні фактори транскрипції
- •Ініціація транскрипції рнк-полімеразою іі
- •Ініціація транскрипції рнк-полімеразою ііі
- •Механізми активації транскрипції
- •Транскрипційні фактори
- •Зовнішня регуляція активності транскрипційних факторів
- •Ацетилювання гістонів
- •Доступність промоторів
- •Комплекси ремоделювання хроматину
- •Роль білків hmg в активації транскрипції
- •Елонгація рнк-полімерази через хроматин
- •Конститутивна репресія транскрипції: гетерохроматин
- •Деацетилювання гістонів
- •Метилювання днк
- •Контрольні запитання
- •Рекомендована література
Лекція № 6. Транскрипція: еукаріоти
-
РНК-полімераза II
-
Структура РНК-полімерази ІІ
-
Промотор РНК-полімерази ІІ
-
Базальні фактори транскрипції
-
Ініціація транскрипції РНК-полімеразою ІІ
-
РНК-полімерази І і ІІІ
-
Ініціація транскрипції генів рибосомної РНК
-
Ініціація транскрипції РНК-полімеразою ІІІ
-
Механізми активації транскрипції
-
Транскрипційні фактори
-
Зовнішня регуляція активності транскрипційних факторів
-
Ацетилювання гістонів
-
Доступність промоторів
-
Комплекси ремоделювання хроматину
-
Роль білків HMG в активації транскрипції
-
Елонгація РНК-полімерази через хроматин
-
Конститутивна репресія транскрипції: гетерохроматин
-
Деацетилювання гістонів
-
НР1-залежна система репресії
-
Метилювання ДНК
-
РНК-інтерференція
-
В еукаріотичних клітинах функціонують РНК-полімерази трьох типів:
• РНК-полімераза І працює на кластерах генів рибосомної РНК і здійснює синтез рРНК 18S, 28S та 5,8S.
• РНК-полімераза ІІ транскрибує білкові гени, а також гени маленьких ядерних РНК та інших РНК, що не транслюються.
• РНК-полімераза ІІІ здійснює синтез тРНК, рибосомної РНК 5S і кількох інших низькомолекулярних РНК.
Кожна з цих полімераз містить чотири гомологічні корові субодиниці, які є водночас гомологами субодиниць α, β і β’ прокаріотичної полімерази. Крім того, до складу полімераз входять п’ять спільних для всіх трьох ферментів субодиниць, а також певний набір специфічних субодиниць (у кількостях 5, 3 і 7 для РНК-полімераз І, ІІ та ІІІ відповідно). Загальна архітектура еукаріотичних полімераз (наявність щелеп, між якими зв’язується ДНК, каналу виходу РНК, вторинного каналу для входу нуклеозидтрифосфатів) дуже схожа на так у прокаріотичної полімерази. Між про- та еукаріотичними полімеразами спостерігається також висока гомологія внутрішньої поверхні щілини щелеп та активного центру; спільними є й основні механізми роботи полімераз, розглянуті раніше. Проте відсутня гомологія зовні: додаткові до чотирьох корових субодиниці еукаріотичних полімераз створюють специфічну поверхню для взаємодії з елементами еукаріотичної системи транскрипції.
РНК-полімераза II
Структура РНК-полімерази ІІ
РНК-полімераза ІІ, яка відповідає за синтез мРНК, складаєтьсяз 12 субодиниць (рис. 1). Найбільша субодиниця (гомолог субодиниці β'-прокаріотичної полімерази) формує, зокрема, активний центр, структура і найближче оточення якого є практично ідентичними таким бактеріальної полімерази.
Відповідно, ідентичними є й механізми елонгації синтезу РНК. На рис. 6.2 показано структуру оточення активного центру на різних стадіях елонгаційного циклу: вхід NTP через вторинний канал; зв'язування NTP з матрицею та його фіксація в активному центрі завдяки двом іонам Mg2+, які утримуються трьома залишками Asp; каталіз реакції приєднання нуклеотиду до 3′-кінця транскрипту; транслокація полімерази на один нуклеотид уздовж матриці, унаслідок чого система здатна вступити в новий цикл елонгації.
Під час елонгації, так само як і для бактеріальної полімерази, за умови нестабільності РНК-ДНК-гібрида на 3′-кінці можливий зворотний рух полімерази з виходом 3′-кінця транскрипту у вторинний канал. У цьому випадку взаємодія з фактором транскрипції TFIIS (Transcription Factor S of RNA-polymerase II, аналог бактеріальних факторів GreA/B) індукує нуклеазну активність, яка забезпечує редагування помилок при транскрипції.
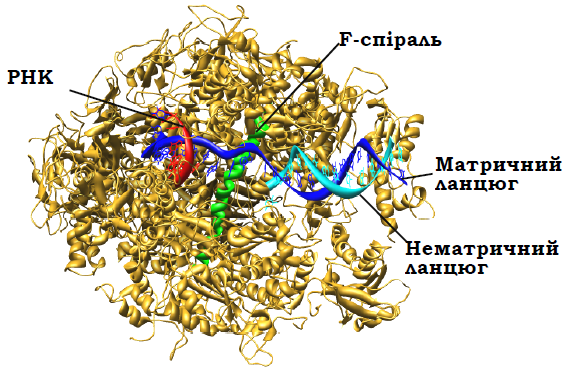
Рис. 1. Структура елонгаційного комплексу РНК-полімерази ІІ (1R9T).
Особливістю РНК-полімерази ІІ (характерною тільки для цієї полімерази) є наявність у найбільшої субодиниці С-кінцевого домену – CTD (CTerminal Domain). CTD – це довгий невпорядкований хвіст (не показаний на рис. 1), амінокислотна послідовність якого є гептапептидом Tyr-Ser-Pro-Thr-Ser-Pro-Ser, що тандемно повторюється 52 рази. Три залишки Ser у складі гептапептиду є субстратами фосфорилювання / дефосфорилювання для специфічних кіназ і фосфатаз. CTD, який відходить від полімерази поблизу від каналу виходу мРНК, є платформою для зв’язування численних білків, спорідненість яких залежить від патерна фосфорилювання. Зокрема, CTD відіграє ключову роль у перемиканні між ініціацією та елонгацією транскрипції (див. нижче) та у збиранні елементів системи процесингу мРНК під час елонгації.
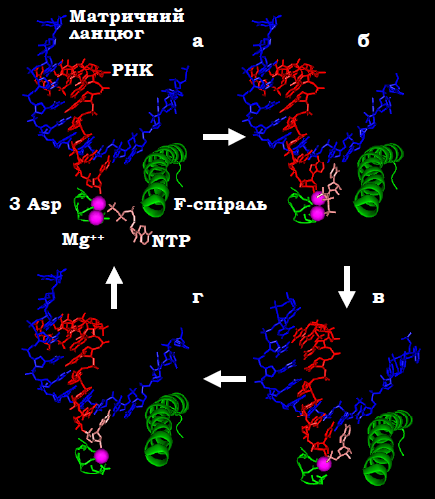
Рис. 2. Стадії елонгаційного циклу РНК-полімерази ІІ:(а) – вхід NTP до активного центру (1R9T); (б) – впізнання матриці та зв’язування NTP (1R9S); (в) – претранслокаційний стан після приєднання нуклеотиду до транскрипту (1I6H); (г) – посттранслокаційний стан (1SFO).
Для ініціації транскрипції є необхідним збирання на промоторі преініціаторного комплексу (PIC – PreInitiation Complex) за участю принаймні 12-субодиничної РНК-полімерази ІІ та шести базальних (загальних) факторів транскрипції TFIIA, TFIIB, TFIID, TFIIE, TFIIF, TFIIH.
