
- •Лекція 8. Синтез білків
- •Структура рибосоми
- •Елонгаційний цикл
- •Елонгаційний фактор ef1
- •Зв'язування аа-тРнк з а-сайтом рибосоми
- •Транспептидація
- •Транслокація
- •Ініціація трансляції
- •Ініціація трансляції у прокаріотів
- •Ініціація трансляції в еукаріотів
- •Термінація трансляції
- •Регуляція трансляції
- •Формування просторової структури білка
- •Закономірності укладання білкової глобули
- •Шаперони hsp70
- •Шапероніни
- •Контрольні запитання
- •Рекомендована література
Елонгаційний цикл
Робота рибосоми під час елонгації трансляції полягає в послідовному (потриплетно) зчитуванні інформації з мРНК і відповідному приєднанні амінокислот до поліпептидного ланцюга. Кожен такий крок складається з трьох операцій, що циклічно повторюються (елонгаційний цикл). Цикл розпочинається з такої конфігурації системи, коли в Р-сайті знаходиться пептидил-тРНК, А-сайт є вільним від тРНК і в його межах на маленькій субодиниці розташований черговий кодон, який має бути впізнаним (рис. 15). Перша операція циклу – зв’язування аа-тРНК з А-сайтом. Зв’язування має відбутися з високою специфічністю щодо взаємодій між кодоном і антикодоном – тільки споріднена до даного кодона тРНК має бути відібрана системою. Процес розміщення аа-тРНК в А-сайті часто супроводжується дисоціацією з Е-сайта деаміноацильованої тРНК, яка залишилася там з попереднього циклу. Наслідком зв’язування є належне розташування акцепторних частин аа-тРНК і пептидил-тРНК відносно одна одної та каталітичного активного центру. У результаті рибосома здійснює другу операцію – транспептидацію – перенесення пептидилу з пептидил-тРНК на амінокислоту у складі аа-тРНК. Наслідком є перебудова системи: в А-сайті опиняється пептидил-тРНК із подовженим на одну амінокислоту пептидилом, у Р-сайті – деаміноацильована тРНК. Третя операція транслокація – полягає в переміщенні рибосоми на один кодон уздовж мРНК (молекули тРНК залишаються зв’язаними зі своїми кодонами), після чого розпочинається наступний елонгаційний цикл.
Відбір серед різних молекул аа-тРНК на першому етапі, коли неспоріднені молекули мають швидко звільнятися, а також рух рибосоми при транслокації, передбачають реалізацію певної відкритої, не жорстко зафіксованої, рухливої структурної форми рибосоми. Каталіз транспептидації, навпаки, вимагає жорсткої фіксації субстратіву закритій, жорсткій і нерухливій формі рибосоми. Ефективне вирішення цих суперечливих завдань залежить від полегшення реалізації відкритих форм рибосоми на першому та третьому етапах елонгаційного циклу завдяки двом факторам елонгації (EF – Elongation Factors): EF1 (еукаріотичний аналог позначається як eEF1 або eEF1А, eEF – eukariotic Elongation Factor) і EF2 (еукаріотичний аналог – eEF2). Обидва фактори належать до родини G-білків, або GTP-зв’язувальних білків. Інші білки цієї родини залучені до багатьох різноманітних процесів, зокрема, є елементами асоційованих із мембранами клітинних сигнальних систем.

Рис. 15. Схема елонгаційного циклу.
Елонгаційний фактор ef1
Фактор EF1 (часто також позначається як EFTu) – мономерний білок, що має три структурні домени, – може існувати у двох структурних станах (рис. 16). Співвідношення між вільними енергіями цих станів, а відповідно й імовірність переважної реалізації одного з них, залежить від типу ліганду (GTP чи GDP), що зв’язаний з білком. У комплексі з GDP (гуанозиндифосфат) реалізується відкрита конформація EF1 з порушеними взаємодіями між структурними доменами. Заміна GDP на GTP (гуанозинтрифосфат) приводить до локальної конформаційної перебудови в межах GTP-зв’язувального домену, унаслідок якої певні амінокислотні групи виводяться до інтерфейсу взаємодії з іншими доменами – така взаємодія відбувається і структура замикається. Гідроліз GTP (який здійснюється за певних умов самим білком, див. нижче) проводить до заміни ліганду і, відповідно, до зворотного перемикання конформації. Структурна перебудова EF1 є важливою не сама по собі. GDP і GTP-асоційовані структурні форми мають відповідно низьку та високу спорідненість до аа-тРНК і рибосом: саме у вигляді потрійного комплексу EF1·GTPаа-тРНК (рис. 17) і відбувається зв’язування аа-тРНК з рибосомою на першому етапі елонгаційного циклу. При цьому вже потрійний комплекс відіграє роль ліганду, що перемикає структурні стани рибосоми.

Рис. 16. Структура фактора EF1 у комплексіз GDP (1TUI) і GTP (1TFT). Зелена кулька – іон Mg2+.
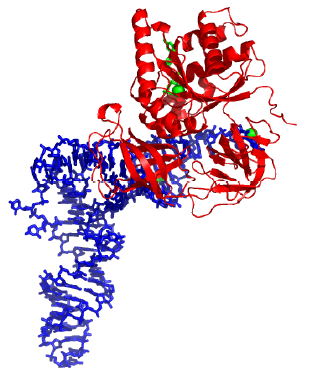
Рис. 17. Комплекс EF1·GTP з аа-тРНК (1В23).
Зв’язування EF1·GTP із акцепторною частиною аа-тРНК (рис. 17) відбувається відразу після аміноацилювання тРНК. При завершенні процесу взаємодії з рибосомою (див. нижче) EF1 здійснює гідроліз GTP, що веде до втрати спорідненості та дисоціації EF1·GDP. Після дисоціації молекула GDP витісняється білковим кофактором EFTs (еукаріотичний аналог – eEF1В), який, у свою чергу, замінюється на молекулу GTP, і знову відбувається зв’язування EF1·GТP з новою молекулою аа-тРНК.
