
- •Лекція 8. Синтез білків
- •Структура рибосоми
- •Елонгаційний цикл
- •Елонгаційний фактор ef1
- •Зв'язування аа-тРнк з а-сайтом рибосоми
- •Транспептидація
- •Транслокація
- •Ініціація трансляції
- •Ініціація трансляції у прокаріотів
- •Ініціація трансляції в еукаріотів
- •Термінація трансляції
- •Регуляція трансляції
- •Формування просторової структури білка
- •Закономірності укладання білкової глобули
- •Шаперони hsp70
- •Шапероніни
- •Контрольні запитання
- •Рекомендована література
Шаперони hsp70
Процес укладання поліпептидного ланцюга у глобулу має відбуватися саме посттрансляційно – поза рибосомою. Тунель, через який синтезований ланцюг виходить за межі рибосоми має довжину ~100 Å, середній діаметр ~15 Å – у тунелі може розміститися тільки витягнутий ланцюг довжиною ~30 амінокислот. Отже, укладання не може починатися в тунелі. Білки hsp70 (тут і далі цифрами позначено молекулярну вагу в кілодальтонах) зв’язують розгорнутий поліпептидний ланцюг відразу після того, як його частина виходить з рибосоми при білковому синтезі. Молекула має два структурні домени – пептид-зв’язувальний, який взаємодіє з елементом розгорнутого поліпептидного ланцюга (рис. 35), та АТР-азний.
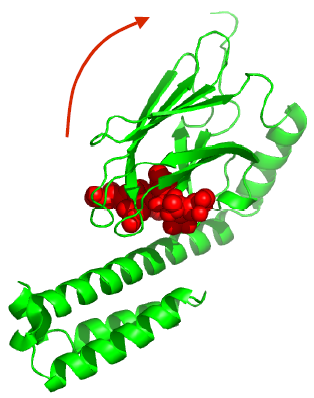
Рис. 35. Комплекс пептид-зв’язувального домену бактеріального hsp70 (білок DnaK) із фрагментом поліпептиду (червоний) довжиною 7 амінокислот (1DKZ). Стрілка вказує напрямок конформаційної зміни білка, яка індукується АТР.
Зв’язування з розгорнутим ланцюгом здійснюється неспецифічно за рахунок гідрофобних взаємодій з неполярними амінокислотними залишками: ланцюг вкривається –шубою – молекул шаперона. Власне, підтримання розгорнутого стану ланцюга при запобіганні агрегації – одна з основних функцій hsp70.
Молекула шаперону може існувати у двох структурних станах залежно від типу зв’язаного ліганду – АТР чи ADP. У комплексі з АТР реалізується структурна форма, яка допускає швидку рівновагу між зв’язаним / дисоційованим поліпептидом. Гідроліз АТР (здійснюється АТР-азним доменом hsp70 за сприяння ко-шаперонів hsp40) викликає структурну зміну з міцною фіксацією поліпептиду пептид-зв’язувальним доменом. За допомогою інших ко-шаперонів ADP знову замінюється на АТР (рис. 36).
У процесі такої циклічної АТР-залежної зміни спорідненості шаперону до поліпептиду створюються умови для рівноважного пошуку нативної конформації під час короткострокової дисоціації. Цей механізм є цілком аналогічним зі збиранням хроматину за допомогою проміжних переносників гістонів, які також називають хроматиновими шаперонами: звільнений поліпептид з нестабільною структурою (з великою кількістю гідрофобних залишків на поверхні) знов розгортається hsp70 і здійснює нову спробу при наступній дисоціації. Для багатьох білків такий процес виявляється достатнім, щоб знайти нативну конформацію – структуру з гідрофобним ядром у середині, яка не може бути субстратом для hsp70. Іноді процес укладки поліпептидного ланцюга відбувається котрансляційно: укладається С-кінцева частина ланцюга, яка вже вийшла з рибосоми, тоді як решта поліпептиду ще синтезується. Зокрема, такий процес іноді спостерігається для мультидоменних білків. Інші поліпептиди переносяться на інші шаперони (наприклад, на шапероніни, див. нижче), частина нестабільних білків, звільняючись від hsp70, піддається протеолітичній деградації.
У складі міцного комплексу з hsp70·АDР поліпептид транспортується крізь мембрану до інших компартментів клітини, у середину мітохондрій, до місця збірки мультибілкових комплексів тощо: близько третини всіх синтезованих білків мають бути транспортованими в інше місце клітини або секретованими в позаклітинний простір. Транспортування комплексу поліпептиду з hsp70 відбувається за рахунок наявності у складі ланцюга специфічних сигнальних послідовностей (які відщеплюються в місці призначення), що упізнаються білковими факторами та шаперонами типу hsp90.
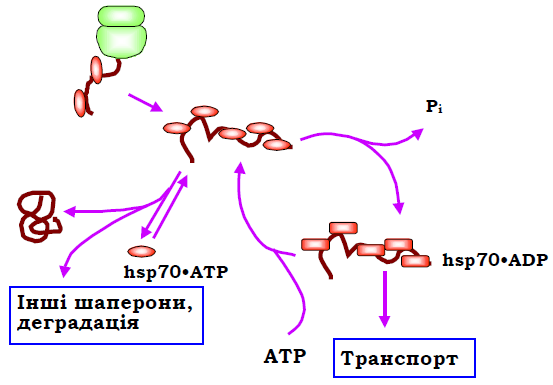
Рис. 36. АТР-залежний робочий цикл hsp70.
У деяких випадках hsp70 та аналогічні білки теплового шоку беруть участь у контролі активності регуляторних білків. Першим прикладом є система регуляції транскрипції самих білків теплового шоку пойкілотермних організмів. За низьких температур фактор транскрипції HSF (Heat Shock Factor) перебуває в неактивній формі – у недоструктурованому вигляді в комплексі з білками hsp40, hsp70, hsp90, які синтезуються за рахунок фонової активності своїх генів. Підвищення температури, яке зумовлює дестабілізацію багатьох білків і експонування гідрофобних груп у їхньому складі, викликає зв’язування hsp з цими білками – HSF звільняється, набуває остаточної структури і зв’язується з промоторами генів hsp, активуючи їхню транскрипцію. Підвищення концентрації hsp знов інактивує HSF.
Інший приклад залучення білків теплового шоку до регуляції транскрипції вже розглядався у зв’язку з гормоновими рецепторами: після синтезу рецептора hsp70 (що зв’язується з його ланцюгом після виходу з рибосоми) замінюється на hsp90 та ко-шаперон р23, і в складі цього комплексу гормон-зв’язувальний домен підтримується в недоструктурованому стані до моменту зв’язування з гормоном.
