
лекция 1 заочники 3207 pdf
.pdf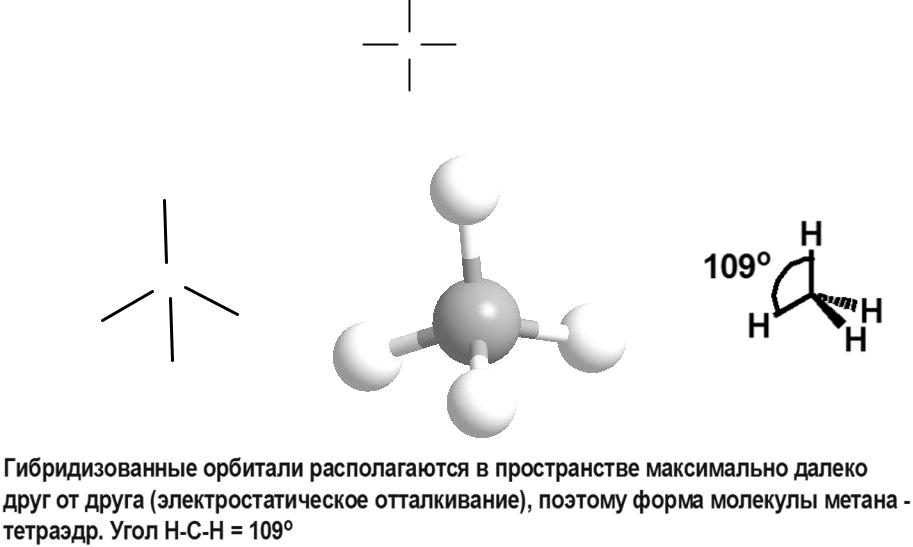
H
H C H
H
H
|
C |
H |
H |
|
|
|
H |

12

σ-связь— ковалентная связь, образующаяся при перекрывании гибридных орбиталей вдоль линии, соединяющей ядра атома.
CH3-CH3 этан С-Н С:Н
С-С С:С

Характеристика σ-связей С-С и С-Н (длина, энергия, полярность и поляризуемость).
|
длина связи |
энергия связи |
С-С |
0,154 нм |
343-350 кДж/моль |
С-Н |
0,109 нм |
340 - 420 кДж/моль |
С-С и С-Н - ковалентные неполярные или малополярные связи.

43
Свойства алканов
1. Горение
O2
CnH2n+2  nCO2 + (n+1)H2O + Q
nCO2 + (n+1)H2O + Q
2. Радикальное галогенирование
|
CH |
|
Cl2 |
|
|
|
|
|
|
|
+ УФ |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
CH Cl + |
CH2Cl2 |
+ |
CCl4 |
+ |
HCl + C2H6 |
и др. |
|
||||||||
|
4 |
|
h |
|
|
3 |
|
CHCl3 |
|
|
+ |
HCl |
|||||||||
CH |
|
|
|
|
|
Cl2 |
|
|
|
|
|
|
|
|
CH3Cl |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Cl2 |
h |
2Cl |
|
|
|
инициирование |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
CH4 |
+ Cl |
|
|
|
|
CH3 |
+ HCl |
рост цепи |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
CH |
+ Cl |
|
|
|
|
CH3Cl + Cl |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
3 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2Cl
 Cl2
Cl2
CH3 + Cl |
CH3Cl |
обрыв цепи |
2CH3
 C2H6
C2H6

|
|
CH |
|
|
|
|
|
CH2Cl |
|
|
CH3 |
45 |
||||
|
|
|
3 |
Cl2 |
H3C |
|
|
CH + |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
H C |
|
|
CH |
|
|
|
|
H3C |
|
C |
|
Cl |
|
|||
|
|
|
|
|
|
|
|
|
||||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
h |
|
|
CH3 |
|
|
|
|
|
|
|
||
|
|
CH |
|
|
|
|
|
|
CH3 |
|
||||||
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
9 |
: |
5 |
|
а не 9:1! |
||||||
|
|
|
CH2 |
|
|
|
CH3 |
+ H3C |
|
C |
|||||
H3C |
|
|
CH |
|
|||
|
|
|
|||||
|
|
||||||
|
|
|
|||||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
CH3 |
|
|
|||
|
|
|
|
|
|
|
|
Во всех случаях, когда в молекуле присутствует «нештатное» количество электронов: радикал, катион, анион – молекула тем более устойчива, чем в большей степени эта «нештатность» распределена (делокалазована)!
Электронный эффект – эффект гиперконъюгации

49
3. Сульфохлорирование
CH4 + SO2 + Cl2 |
h |
|||
|
CH3SO2Cl |
|||
|
||||
|
|
|
|
|
Cl2 |
h |
|
|
|
|
2Cl |
|
инициирование |
|
|
|
|||
лимитирующая CH4 + Cl
 CH3 + HCl стадия
CH3 + HCl стадия
CH3 + SO2 |
|
CH3SO2 |
рост цепи |
|
CH3SO2 + Cl2  CH3SO2Cl + Cl
CH3SO2Cl + Cl
|
|
|
NaOH |
|
|
h |
|
CnH2n+2SO3Na |
|
CnH2n+2 + SO2 + Cl2 |
|
CnH2n+2SO2Cl |
|
|
|
|
|||
|
|
|
H2O |
|
алкилсульфонаты - ПАВ (синтетические моющие средства, детергенты)
4. Нитрование
CH4 + HNO3 (конц.) 500о CH3NO2 140o CH4 + HNO3 (разб.)
парофазное нитрование по Коновалову
Алканы
•Источники:
•Природный газ ~ 75% метан, 15% этан, 5% пропан
•Нефть
•Озокерит (церезин)

40
Методы синтеза алканов
а) Промышленные
1.Ректификация газа и нефти
2.Синтетический бензин, газификация угля
С + H2 |
|
500o |
||
|
|
CnH2n+2 |
||
|
|
|||
|
|
250 атм. |
||
3. Синтез Тропша |
|
Fe |
||
CO + H2 |
200o |
|||
|
|
CnH2n+2 + H2O |
||
|
|
|||
|
|
|||
Fe/Co
4. Крекинг нефти
CnH2n+2 |
500-700o |
алканы + алкены |
алюмосиликаты

41
Лабораторные методы синтеза алканов
1. Декарбоксилирование
CH3CO2Na |
NaOH |
|
|
CH4 + Na2CO3 |
|
|
||
|
t |
|
3. Реакция Вюрца
2Na
2RX  R-R
R-R
X = I, Br > Cl R - первичный алкил > вторичный алкил, но не третичный!
4. Электрохимический синтез Кольбе
RCOONa 
 RCOO
RCOO  Na
Na
анод
RCO - |
-e |
|
R |
||||
|
RCO |
|
|
R |
|
R-R |
|
|
|
|
|
||||
2 |
|
2 - CO2 |
|
|
|||
