
- •Глава1. История развития биоорганической химии …………………………………
- •Глава 2. Лекции по биоорганической химии …………………………………………
- •Глава 1
- •1.. Характеристика химических связей в биоорганических соединениях
- •2. Сопряженные системы
- •2.1. Общие понятия о строении сопряженных систем
- •2 . 3 . Циклические сопряженные системы. Ароматичность
- •1. Устойчивость к действию окислителя перманганата калия в растворе.
- •3. Способность к реакциям замещения в растворе по ионному( катионному,
- •2.3.1. Современные представления о строении бензола
- •2. 3. 2. Медико-биологическое значение карбоциклических ароматических
- •2. 3. 3. Гетероциклические ароматические соединения
- •2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
- •2.2. Кислотно-основные свойства органических соединений
- •2.3. Медико- биологическое значение изучения темы « Кислотно-основные
- •3.1. Виды изомерии
- •3.2. Структурная изомерия.
- •3.2.1. Изомерия скелета
- •3.3. Динамическая изомерия.
- •3. 3.1. Кето-енольная таутомерия.
- •3.3.2. Лактим-лактамная таутомерия
- •3.4 Пространственная изомерия
- •3.4.1 Геометрическая( цис, транс) изомерия
- •3.4.4. Медико-биологическое значение стереоизомерии
- •4.1 Классификация реакций в биоорганической химии
- •4.1.1 Типы разрыва химических связей
- •4.1.2. Гомолитический тип разрыва связей.
- •4.1.3. Гетеролитический тип разрыва связей
- •4.2.1. Реакции электрофильного присоединения в ряду алкенов(а е)
- •4.2.2. Реакции нуклеофильного присоединения
- •7.Реакции у α- углеродного атома в карбонильных соединениях
- •8. Альдольная конденсация
- •1. Реакция нитрования
- •2. Реация сульфирования
- •3.Реакция галогенирования
- •4. Реакция алкилирования
- •4.2.4. Реакции нуклеофильного замещения ( s n )
- •Лекция 5 карбоновые кислоты и их гетерофункциональные
- •5.1. Классификация карбоновых кислот
- •5.2. Строение карбоксильной группы
- •5.2.1. Значение величин рКа некоторых карбоновых кислот :
- •5.3. Химические свойства карбоновых кислот
- •Этилацетат
- •5.4. Характеристика отдельных представителей монокарбоновых кислот ,
- •Масляная кислота ( н- бутановая кислота)
- •5.5. Непредельные монокарбоновые кислоты
- •5.6. Дикарбоновые кислоты
- •5.7. Непредельные ди- и трикарбоновые кислоты
- •5.8. Гидроксикислоты
- •5.8.3. Дигидроксидикарбоновые кислоты
- •5.9. Oксокарбоновые кислоты( альдегидо -, кетокарбоновые кислоты)
- •5.10 Приложение : Происхождение названий карбоновых кислот Сn н2n о2
- •6.1. Определение « липиды»
- •6.3. Основные представители липидов
- •6.3.1.Природные высшие карбоновые кислоты
- •3. Тиоэфиры
- •4. Дегидрирование насыщенной кислоты в активной форме с участием фермента.
- •6.3.2. Триацилглицерины( триглицериды)
- •6.3.3. Фосфатиды ( фосфолипиды ) и фосфатидовая кислота
- •6. 4. Принципы создания липотропных лекарственных препаратов
- •6.5 . Строение и химический состав мембран клеток
- •7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
- •7. 2 Классификация природных аминокислот
- •7. 3Физические свойства природных аминокислот
- •7.4 Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка
- •7.5. Качественная реакция обнаружения аминокислот
- •7. 6 . Химические свойства аминокислот
- •7 .6. 1 Химические свойства аминокислот in vitro
- •7.6.2. Химические свойства аминокислот in vivo
- •7.7. Строение витамина в6 и механизм реакции с его участием
- •7.8. Реакция поликонденсации, образование полипептидов
- •7. 9. Медико - биологическое значение аминокислот
- •7. 10. Применение аминокислот и их производных в качестве
- •Незаменимые аминокислоты обозначены звездочкой*
- •8.1. Определения « пептид» «белок»
- •8.2. Классификация белков
- •8.3. Строение пептидов и белков.
- •8.3.1. Первичная структура белка
- •8.3.2. Вторичная структура белка
- •8.3.3. Третичная и четвертичная структура белка
- •8.4. Физико-химические свойства белка
- •8.4.1. Амфотерность - кислотно- основные свойства белков.
- •8.4.2. Денатурация белка
- •8.5.Качественные реакции обнаружения белков в биологических объектах.
- •8. 6. Приложение. История развития химии белков
- •9. 1. Классификация углеводов
- •9.2. Моносахариды
- •9.3. Изомерия моносахаридов. Стереоизомерия. L- и д- ряды. Диастереомеры, энантиомеры, эпимеры. Значение отдельных представителей
- •9.4 Химические свойства моносахаридов
- •9.4. 3. Фосфорные эфиры
- •9.4.3 Образование гликозидов
- •9.4.4. Реакции восстановления
- •9.4.5Реакции окисления моносахаридов
- •9.5. Биологическое значение моносахаридов и их производных.
- •10.1. Олигосахариды. Дисахариды
- •10.1.1. Нередуцирующие дисахариды
- •10.1.2 Редуцирующие дисахариды.
- •10.2. Полисахариды
- •10.2.1.Гомополисахариды
- •11.1. Классификация нуклеиновых кислот, отличия в строении и составе как следствие различных биологических функций
- •11.2.Азотистые основания нуклеиновых кислот
- •11.2.2. Азотистые основания- производные пурина( аденин, гуанин)
- •11.3. Нуклеозиды
- •11.4. Нуклеотиды
- •11.5.Строение нуклеиновых кислот
- •11.6.Метаболизм пуриновых соединений в клетке
- •11.7. Биологически важные соединения- мононуклеотиды, динуклеотиды- участники важнейших биохимических процессов
- •11.8 Приложение . Справочные материалы к теме лекции
- •1953 – Дж. Уотсон и ф. Крик - модель двухцепочечной структуры днк.
- •12.1 Современная концепция создания биоорганических соединений –
- •12.1.1. Особые химические требования к лекарственному веществу
- •12.1.3. . Пути поиска и создания лекарственных препаратов
- •12.1.4 Классификация лекарственных веществ
- •12.2 Синтез, химические и физическиесвойства лекарственных соединений
- •12.2.1. Производные 4-аминобензойной кислоты
- •12.2.2. Производные 4-аминобензолсульфокислоты
- •Hso3Cl сульфохлорирование h2nr’ амин
- •Ацетиланилин
- •12. 2. 3. Лекарственные средства, производные салициловой кислоты
- •12.2.4. Лекарственные средства, производные 4 –аминофенола
- •12.2.5 Лекарственные средства на основе пиридинкарбоновых кислот
- •12. 2. 6. Производные пиримидина
- •12. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
- •13.1. Номенклатура алкалоидов
- •13.2. Классификация алкалоидов
- •13. 3. Функции алкалоидов
- •13.4. Содержание в растениях
- •13.5. Качественные реакции обнаружения алкалоидов
- •13.6. Фармакологическая активность- общий взгляд
- •13.7. Отдельные представители
- •13. 7.1. Алкалоиды группы фенилэтиламина
- •7.2 Производные пяти – и шестичленных гетероциклических соединений
- •137.3. Группа тропана
- •13.8. Витамины
- •Действие в организме
- •Стадии зрительного процесса на сетчатке глаза
- •14.1. Полимеры-определение. Виды полимеров
- •14. 2. Классификация вмс
- •14.3. Реакции полимеризации
- •14.3.1. Номенклатура полимеров.
- •14.3.2 . Общая характеристика мономеров.
- •14.3.3. Механизмы реакции полимеризации
- •14.4. Радикальная полимеризация
- •14.5. Ионная полимеризация
- •14.5.1. Катионная полимеризация
- •14.5.2. Анионная полимеризация
- •14.6. Координационная полимеризация
- •14.7.1. Блочная полимеризация
- •14.7.2. Эмульсионная полимеризация
- •14.7.3. Полимеризация в растворе
- •14.8. Конфигурация полимеров
- •14. 10. Физическое состояние полимеров
- •14.10.1. Аморфные полимеры
- •14 10.2. Кристаллические полимеры
- •14.11. Натуральный каучук
- •14.12 . Конденсационные полимеры
- •14. 13 Основные представители вмс
- •2. Структурные формулы биоорганических соединений
- •Сопряженные соединения
- •Карбоновые кислоты (указаны тривиальные названия)
- •Незаменимые аминокислоты обозначены звездочкой -*
- •Углеводы и их производные
- •Азотистые основания и их производные
- •1. Теоретические положения строения и свойств биоорганических
- •2. Важнейшие биополимеры организма
- •3. Липиды и низкомолекулярные регуляторы метаболизма.Важнейшие группы лекарственных средств
- •Курс лекций по биоорганической химии
- •060103 – Педиатрия
- •060104 –Медико-профилактическое дело
- •060105 - Стоматология
12. 2. 6. Производные пиримидина
Снотворные препараты
В основе снотворных препаратов пиримидинового ряда лежит барбитуровая кислота, которую синтезируют из мочевины и диэфира малоновой кислоты.
Мочевина диэфир малоновой кислоты
NН2 R- О -C=О
/ \
О=С CH2 ———> 2ROH +
\ /
NН2R–O–C=Oбарбитуровая кислота(2,4.6-триоксопиримидин)


мочевина малоновая кислота
Барбитуровая кислота - кристаллическое соединение, разлагается при нагревании, плохо растворяется в холодной воде, хорошо в горячей. Соединение может существовать в нескольких таутомерных формах( лактим-лактамная, кето-енольная), образует соль при действии щелочи как одноосновная кислота, которая сильнее уксусной. Барбитуровая кислота не обладает лекарственным действием.
Лекарственные соединения барбитураты являются производными барбитуровой кислоты, в которыхоба атома водорода у С5 замещенына различные алкильные или арильные радикалы. Барбитураты применяют в виде натриевых солей для усиления их растворимости( соль образуется в случае таутомерной лактимной формы ).
Впервые снотворная активность барбитуратов была обнаружена Э. Фишером и Ф. Мерингом в начале ХХ века, а в 1904 г. Э. Фишер опубликовал способ получения препарата, который он назвал вероналом.( в честь города Верона)
Барбитураты оказывают угнетающее влияние на центральную нервную систему, оказывают снотворное, успокаивающее, противосудорожное действие. Широкий спектр фармакологической активности связан с природой радикалов. Барбитураты – опасные препараты, при передозировке возможна остановка дыхания, а при длительном применении возникают привыкание и зависимость1
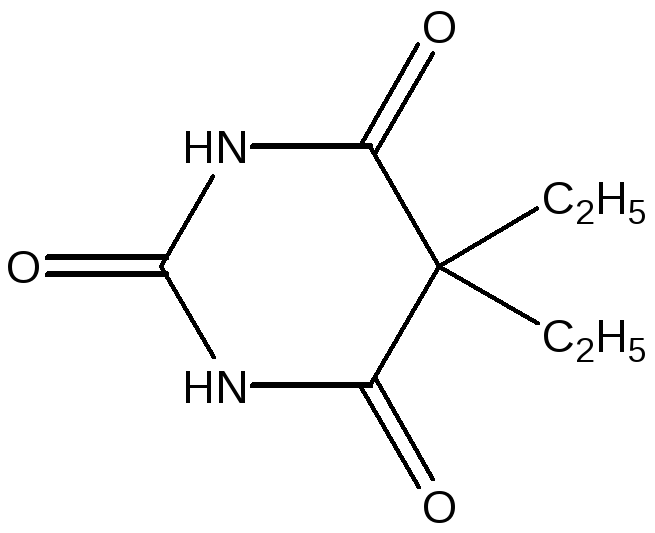

фенобарбитал (люминал)
веронал 5-этил-5-фенилбарбитуровая кислота
5,5-диэтилбарбитуровая кислота
Название люминалпроисходит отлат.- lumen –свет.
Противоопухолевые препараты
Противоопухолевые соединения класса пиримидина - производные урацила –являются антиметаболитами, подавляют синтез ДНК в раковой клетке. Первым препаратом этого ряда был 5-фторурацил ( см. лекцию» Нуклеиновые кислоты» ).
12. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
Психостимулирующие средства
Психостимулирующие средства оказывают стимулирующее действие на функции головного мозга и активируют психическую и физическую деятельность организма. Давно известными препаратами являются кофеин и фенилэтиламины.
Кофеин- 1,3, 7- триметилксантин
Алкалоид кофеин- кристаллическое вещество, содержится в листьях чая, зернах кофе (1- 3%), , орехах кола, впервые выделен в 1819г. В настоящее время получают синтетическим путем. Кристаллическое вещество, растворим в воде( 1: 80 при Т=150, 1 : 2 при Т=1000 ), умеренно в спирте, хлороформе , эфире.. Растворимость кофеина повышается в присутствии некоторых солей, например, бензоата натрия, образующих с ним двойное соединение. По этой именно причине распространенный лекарственный препарат кофеина имеет состав «кофеин-бензоат натрия» Кофеин- очень слабое основание, дает неустойчивые соли с кислотами. Токсическая доза составляет от 5 до 10 г, вызывает сильную двигательное и эмоциональное возбуждение, которые могут закончиться судорогами. В организме подвергается деметилированию, в начале превращается в ксантин, а затем в мочевую кислоту. В течение 6 часов разрушается половина введенной дозы. Отмечено определенное привыкание- «кофеиномания», которая может сформироваться при неумеренном употреблении напитков кока-кола и различных видов «энерджи»..
Кофеин применяют в качестве стимулятора сердечно- сосудистой системы. Механизм действия кофеина изучал известный русский физиолог И.П. Павлов.
|
Кофеин (1,3,7-триметилксантин)
|
Теофиллин (1,3-диметилксантин) |
|
Теобромин (3,7-диметилксантин) |
|
Миолитики
Близкие по строению и составу другие метилированные производные ксантина –теофиллин и теобромин-обладают иным лекарственным действием и относятся к миолитикам. Миолитики снижают тонус гладкой мускулатуры.
Изомеры теобромин и теофиллин вместе с кофеином содержатся в листьях чайного дерева, зернах какао
Теобромин-3,7-диметилксантин- алкалоид, который выделяют из шелухи плодов какао. Впервые описан в 1843 г. Белые кристаллы горького вкуса, плохо растворимы в теплой воде, еще хуже в холодной, нерастворим в органических растворителях.. Фармакологическое действие проявляется в расширении бронхов, коронарных сосудов и усилении мочеотделения.
Теофиллин -1,3-диметилксантин-выделяют вместе с кофеином из листьев чая. Тоже кристаллы горького цвета, в холодной воде растворим плохо, лучше в горячей и в спирте. Обладает амфотерными свойствами: растворим в щелочах - проявляет кислотные свойства и растворим в кислотах ( в структуре пуринового цикла есть основные пиридиновые и кислотные пиррольные атомы азотаNH).
Имеет более сильные диуретические свойства и возбуждающее действие по сравнению с теобромином.
Для проверки усвоения темы рекомендуем ответить на вопросы:
1. Почему сульфаниламидные препараты относятся по механизму биологического действия к антиметаболитам?
2. Верно ли утверждение, что 4-аминобензойная и сульфаниловая кислоты - амфотерные соединения и могут образовать биполярный ион?
3. Запишите структурную формулу хлороводородной соли новокаина. Какой атом азота присоединяет протон? Найдите то структурное подобие между медиатором ацетилхолином и солью новокаина, которое связано с проявлением лекарственного действия?
4. Какая качественная реакция позволяет обнаружить отсутствие примеси салициловой кислоты в аспирине?
5. Лекарственный препарат снотворного действия - барбитал-натрий (5,5-диэтилбарбитурат натрия). Запишите возможные структурные формулы этой соли. Какое химическое свойство позволяет образовать соль?
6. Пациент не переносит новокаин, возникает сильная аллергическая реакция. Почему врач, зная химические формулы лекарственных веществ, не назначает этому больному сульфаниламидные препараты?
ПРИЛОЖЕНИЕ
К истории открытия анестезина
Академик Постовский И.Я. рассказывал студентам в своих лекциях : исследователь, проводивший синтез этилового эфира п-аминобензойной кислоты, неосторожно переливал спиртовый раствор эфира из одной колбы в другую и сплеснул на руку несколько капель раствора . Рука, на которую попали капли раствора, потеряла чувствительность. Так начались целенаправленные поиски соединений с анестезирующим действием среди производных 4- аминобензойной кислоты.
История открытия аспирина
В медицинской практике осталось несколько лекарств вековой давности, которые прочно сохранили свое место в «золотом фонде» лекарственных средств. Одним из таких препаратов, безусловно, является аспирин (АСК, ацетилсалициловая кислота), 100-летие создания которого немецкая фирма «Байер» отмечалась в 1999 г.
Аспирин - одним из наиболее распространенных в мире медикаментов. В настоящее время в России предлагают более 100 различных болеутоляющих средств, и почти все они содержат в качестве основного ингредиента аспирин.
Показания к применению АСК в последние годы значительно расширились, на первый план выходит о антитромбическое действие:
-аспирин пожизненно вынуждены принимать пациенты с протезами клапанов сердца с целью профилактики тромбообразования в области искусственных клапанов, после операции аортокоронарного шунтирования при ишемической болезни сердца, для профилактики повторных инфарктов миокарда, больные с преходящими расстройствами
мозгового кровоснабжения с целью профилактики ишемического инсульта
Не менее 4,5 млн. человек принимают аспирин не реже одного раза в неделю, а 500 тыс. – более 5 таблеток в неделю. Общий масштаб производства аспирина в мире составляет тысячи тонн в год . В 1994 г. в мире было употреблено 11600 тонн аспирина, или около 30 лечебных доз на человека в год.
История аспирина начиналась около 4000 лет назад. Египетские папирусы, которые датируются приблизительно 1550 годами до нашей эры упоминают использование отвара из листьев ивы белой при многих заболеваниях. Гиппократ (460-377 г. до н.э.) рекомендовал для лечения боли и жара сок, приготовленный из коры того же дерева. Лечебное действие ивы в медицине были известны также хорошо в Америке ( до ее «открытия» Колумбом) . Ива — первый источник аспирина. К середине XVIIIв. кора ивы уже была широко известным народным средством для лечения простуд.
В 1757 г. священник Э. Стоун из графства Оксфордшир (Великобритания), заинтересовался чрезвычайной горечью коры ивы, сходной по вкусу с изготовляемой из коры хинного дерева хиной – редким и дорогим средством для лечения малярии .
2 июня 1763 года, выступая перед Королевским обществом, Стоун на основе результатов своих исследований обосновал использование настоя из ивовой коры при заболеваниях, сопровождающихся лихорадочным состоянием.
Спустя более чем полвека начались интенсивные исследования действующего начала ивовой коры. В 1829 г. французский фармацевт Пьер-Жозеф Леру получил из коры ивы кристаллическое вещество, которое он назвал салицилом (это название происходит от латинского названия «salix»-наименование растения, впервые упоминающегося в трудах римского ученого- энциклопедиста Варрона (116-27 гг до н. э.) и относящегося к иве (вербе, ветле), Содержание салицина в иве примерно 2% по массе сухого вещества.. В 1838-1839 гг. итальянский ученый Р. Пириа расщепил салицил, показав, что это соединение является гликозидом, и, окислив его ароматический фрагмент, получил вещество, которое назвал салициловой кислотой.
Сначала салицил получали промышленным путем из очищенной ивовой коры, являвшейся отходом на корзиночных производствах в Бельгии, и это небольшое количество салицина удовлетворяло текущие потребности. Однако уже в 1874 г. в Дрездене была основана первая большая фабрика по производству синтетических салицилатов.
В 1888 г. на фирме «Байер», занимавшейся до этого только производством анилиновых красителей, был создан отдел фармацевтики, и компания одной из первых включилась в процесс производства лекарств.
Дешевизна салициловой кислоты позволяла широко пользовать ее в медицинской практике, но лечение этим препаратом таило в себе немало опасностей, связанных с ее токсическими свойствами. Токсичность салициловой кислоты и явилось причиной, которая привела к открытию аспирина..
У сотрудника фирмы «Байер» Феликса Гофмана ( 1868-1946) пожилой отец страдал артритом, но не переносил салицилаты натрия из-за хронического острого раздражения желудка. Заботливый сын-химик в химической литературе нашел данные об ацетилсалициловой кислоте, . которая была синтезирована 30 годами раньше Шарлем Герхардтом в 1853 г и обладала меньшей кислотностью..
10 октября 1897 г. Ф. Гофман описал способ получения почти чистой ацетилсалициловой кислоты ( АСК ) и ее испытания выявили высокую фармакологическую активность. Ацетилсалициловая кислота оказалась более приятной на вкус и не оказывала раздражающего действия.
Новому препарату дали название «аспирин», взяв букву «а» от слова «acetyl» (ацетил) и часть «спирин» от немецкого слова «Spirsaure», которое в свою очередь произошло от латинского названия лабазника вязолистного (Spiraeaulmaria) – растение содержащее большое количество салициловой кислоты.
В 1899 г. на фирме «Байер» началось производство препарата под названием «аспирин» в качестве анальгезирующего, жаропонижающего и болеутоляющего препарата.
В течение столетия химики компании «Байер», а так же другие исследователи предприняли многочисленные попытки изучить влияние изменений в строении производных салициловой кислоты на их активность, и таким образом найти соединения, имеющие превосходство над аспирином. Исследовали влияние длины цепи ацильной группы аспирина, и различных заместителей в цикле. Изучали различные соли аспирина – кальциевую, натриевую, литиевую, а также лизинацетилсалицилат, которые лучше растворимы в воде, чем сама ацетилсалициловая кислота.
Присутствие ацетильной группы в составе аспирина- условие фармацевтического действия. ( Молекулярные основы механизма действия изучаются в курсе биохимии)
Часть из перечисленных выше соединений была введены в медицинскую практику, и хотя некоторые препараты имели перед аспирином преимущество (особенно при лечение ревматизма), ни один из них никогда не завоевал столь широкой популярности
ЛЕКЦИЯ 13
АЛКАЛОИДЫ. ВИТАМИНЫ
Содержание лекции
13.1 Номенклатура алкалоидов
13.1 Классификация алкалоидов
13.2 Функции алкалоидов
13.3 Содержание в растениях
13.4 Качественные реакции обнаружения алкалоидов
13.5 Фармакологическая активность – общий взгляд
13.6 Отдельные представители
13.7.1 Алкалоиды группы фенилэтиламина
- Тирамин
- Эфедрин и псевдоэфедрин
- Мескалин
13.7.2 Производные пяти – и шестичленных гетероциклических соединений
- Никотин
-Анабазин
- Морфин, кодеин, героин
13.7.3 Группа тропана
- Атропин
- Кодеин
13.8. Витамины.
- Витамин С - аскорбиновая кислота
- Витамин РР- никотинамид
- Витамин А – ретиналь, ретинол
Исходный уровень знаний для усвоения темы:
Химические свойства природных аминокислот, пяти- и шестичленных гетероциклических , ароматических карбоциклических соединений, нуклеотидов, макроэргических соединений, механизмы реакций нуклеофильного замещения, окисления, восстановления, строение и свойства синтетических лекарственных препаратов.
Ключевые слова к теме
Алкалоид, анабазин, аскорбиновая кислота, атропин, витамин, героин, кодеин, никотин, никотиновая кислота, морфин ,тирамин, ретиналь, ретинол.
Алкадоиды-азотсодержащие соединения, основания природного, преимущественно, растительного происхождения. ( название «алкалоиды»от позднелат. alcali-щёлочь и греч. eidos-вид).
Кроме атомов углерода, водорода, азота содержат атомы кислорода, серы, встречаются галогены. Могут иметь циклическое, полициклическое, лактонное стороение



