- •Глава1. История развития биоорганической химии …………………………………
- •Глава 2. Лекции по биоорганической химии …………………………………………
- •Глава 1
- •1.. Характеристика химических связей в биоорганических соединениях
- •2. Сопряженные системы
- •2.1. Общие понятия о строении сопряженных систем
- •2 . 3 . Циклические сопряженные системы. Ароматичность
- •1. Устойчивость к действию окислителя перманганата калия в растворе.
- •3. Способность к реакциям замещения в растворе по ионному( катионному,
- •2.3.1. Современные представления о строении бензола
- •2. 3. 2. Медико-биологическое значение карбоциклических ароматических
- •2. 3. 3. Гетероциклические ароматические соединения
- •2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
- •2.2. Кислотно-основные свойства органических соединений
- •2.3. Медико- биологическое значение изучения темы « Кислотно-основные
- •3.1. Виды изомерии
- •3.2. Структурная изомерия.
- •3.2.1. Изомерия скелета
- •3.3. Динамическая изомерия.
- •3. 3.1. Кето-енольная таутомерия.
- •3.3.2. Лактим-лактамная таутомерия
- •3.4 Пространственная изомерия
- •3.4.1 Геометрическая( цис, транс) изомерия
- •3.4.4. Медико-биологическое значение стереоизомерии
- •4.1 Классификация реакций в биоорганической химии
- •4.1.1 Типы разрыва химических связей
- •4.1.2. Гомолитический тип разрыва связей.
- •4.1.3. Гетеролитический тип разрыва связей
- •4.2.1. Реакции электрофильного присоединения в ряду алкенов(а е)
- •4.2.2. Реакции нуклеофильного присоединения
- •7.Реакции у α- углеродного атома в карбонильных соединениях
- •8. Альдольная конденсация
- •1. Реакция нитрования
- •2. Реация сульфирования
- •3.Реакция галогенирования
- •4. Реакция алкилирования
- •4.2.4. Реакции нуклеофильного замещения ( s n )
- •Лекция 5 карбоновые кислоты и их гетерофункциональные
- •5.1. Классификация карбоновых кислот
- •5.2. Строение карбоксильной группы
- •5.2.1. Значение величин рКа некоторых карбоновых кислот :
- •5.3. Химические свойства карбоновых кислот
- •Этилацетат
- •5.4. Характеристика отдельных представителей монокарбоновых кислот ,
- •Масляная кислота ( н- бутановая кислота)
- •5.5. Непредельные монокарбоновые кислоты
- •5.6. Дикарбоновые кислоты
- •5.7. Непредельные ди- и трикарбоновые кислоты
- •5.8. Гидроксикислоты
- •5.8.3. Дигидроксидикарбоновые кислоты
- •5.9. Oксокарбоновые кислоты( альдегидо -, кетокарбоновые кислоты)
- •5.10 Приложение : Происхождение названий карбоновых кислот Сn н2n о2
- •6.1. Определение « липиды»
- •6.3. Основные представители липидов
- •6.3.1.Природные высшие карбоновые кислоты
- •3. Тиоэфиры
- •4. Дегидрирование насыщенной кислоты в активной форме с участием фермента.
- •6.3.2. Триацилглицерины( триглицериды)
- •6.3.3. Фосфатиды ( фосфолипиды ) и фосфатидовая кислота
- •6. 4. Принципы создания липотропных лекарственных препаратов
- •6.5 . Строение и химический состав мембран клеток
- •7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
- •7. 2 Классификация природных аминокислот
- •7. 3Физические свойства природных аминокислот
- •7.4 Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка
- •7.5. Качественная реакция обнаружения аминокислот
- •7. 6 . Химические свойства аминокислот
- •7 .6. 1 Химические свойства аминокислот in vitro
- •7.6.2. Химические свойства аминокислот in vivo
- •7.7. Строение витамина в6 и механизм реакции с его участием
- •7.8. Реакция поликонденсации, образование полипептидов
- •7. 9. Медико - биологическое значение аминокислот
- •7. 10. Применение аминокислот и их производных в качестве
- •Незаменимые аминокислоты обозначены звездочкой*
- •8.1. Определения « пептид» «белок»
- •8.2. Классификация белков
- •8.3. Строение пептидов и белков.
- •8.3.1. Первичная структура белка
- •8.3.2. Вторичная структура белка
- •8.3.3. Третичная и четвертичная структура белка
- •8.4. Физико-химические свойства белка
- •8.4.1. Амфотерность - кислотно- основные свойства белков.
- •8.4.2. Денатурация белка
- •8.5.Качественные реакции обнаружения белков в биологических объектах.
- •8. 6. Приложение. История развития химии белков
- •9. 1. Классификация углеводов
- •9.2. Моносахариды
- •9.3. Изомерия моносахаридов. Стереоизомерия. L- и д- ряды. Диастереомеры, энантиомеры, эпимеры. Значение отдельных представителей
- •9.4 Химические свойства моносахаридов
- •9.4. 3. Фосфорные эфиры
- •9.4.3 Образование гликозидов
- •9.4.4. Реакции восстановления
- •9.4.5Реакции окисления моносахаридов
- •9.5. Биологическое значение моносахаридов и их производных.
- •10.1. Олигосахариды. Дисахариды
- •10.1.1. Нередуцирующие дисахариды
- •10.1.2 Редуцирующие дисахариды.
- •10.2. Полисахариды
- •10.2.1.Гомополисахариды
- •11.1. Классификация нуклеиновых кислот, отличия в строении и составе как следствие различных биологических функций
- •11.2.Азотистые основания нуклеиновых кислот
- •11.2.2. Азотистые основания- производные пурина( аденин, гуанин)
- •11.3. Нуклеозиды
- •11.4. Нуклеотиды
- •11.5.Строение нуклеиновых кислот
- •11.6.Метаболизм пуриновых соединений в клетке
- •11.7. Биологически важные соединения- мононуклеотиды, динуклеотиды- участники важнейших биохимических процессов
- •11.8 Приложение . Справочные материалы к теме лекции
- •1953 – Дж. Уотсон и ф. Крик - модель двухцепочечной структуры днк.
- •12.1 Современная концепция создания биоорганических соединений –
- •12.1.1. Особые химические требования к лекарственному веществу
- •12.1.3. . Пути поиска и создания лекарственных препаратов
- •12.1.4 Классификация лекарственных веществ
- •12.2 Синтез, химические и физическиесвойства лекарственных соединений
- •12.2.1. Производные 4-аминобензойной кислоты
- •12.2.2. Производные 4-аминобензолсульфокислоты
- •Hso3Cl сульфохлорирование h2nr’ амин
- •Ацетиланилин
- •12. 2. 3. Лекарственные средства, производные салициловой кислоты
- •12.2.4. Лекарственные средства, производные 4 –аминофенола
- •12.2.5 Лекарственные средства на основе пиридинкарбоновых кислот
- •12. 2. 6. Производные пиримидина
- •12. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
- •13.1. Номенклатура алкалоидов
- •13.2. Классификация алкалоидов
- •13. 3. Функции алкалоидов
- •13.4. Содержание в растениях
- •13.5. Качественные реакции обнаружения алкалоидов
- •13.6. Фармакологическая активность- общий взгляд
- •13.7. Отдельные представители
- •13. 7.1. Алкалоиды группы фенилэтиламина
- •7.2 Производные пяти – и шестичленных гетероциклических соединений
- •137.3. Группа тропана
- •13.8. Витамины
- •Действие в организме
- •Стадии зрительного процесса на сетчатке глаза
- •14.1. Полимеры-определение. Виды полимеров
- •14. 2. Классификация вмс
- •14.3. Реакции полимеризации
- •14.3.1. Номенклатура полимеров.
- •14.3.2 . Общая характеристика мономеров.
- •14.3.3. Механизмы реакции полимеризации
- •14.4. Радикальная полимеризация
- •14.5. Ионная полимеризация
- •14.5.1. Катионная полимеризация
- •14.5.2. Анионная полимеризация
- •14.6. Координационная полимеризация
- •14.7.1. Блочная полимеризация
- •14.7.2. Эмульсионная полимеризация
- •14.7.3. Полимеризация в растворе
- •14.8. Конфигурация полимеров
- •14. 10. Физическое состояние полимеров
- •14.10.1. Аморфные полимеры
- •14 10.2. Кристаллические полимеры
- •14.11. Натуральный каучук
- •14.12 . Конденсационные полимеры
- •14. 13 Основные представители вмс
- •2. Структурные формулы биоорганических соединений
- •Сопряженные соединения
- •Карбоновые кислоты (указаны тривиальные названия)
- •Незаменимые аминокислоты обозначены звездочкой -*
- •Углеводы и их производные
- •Азотистые основания и их производные
- •1. Теоретические положения строения и свойств биоорганических
- •2. Важнейшие биополимеры организма
- •3. Липиды и низкомолекулярные регуляторы метаболизма.Важнейшие группы лекарственных средств
- •Курс лекций по биоорганической химии
- •060103 – Педиатрия
- •060104 –Медико-профилактическое дело
- •060105 - Стоматология
2. Сопряженные системы
Ключевые слова
Делокализация. Неподеленная пара электронов. Сопряжение( конъюгация)
Сопряженная система. Цепь сопряжения. Энергия сопряжения.
2.1. Общие понятия о строении сопряженных систем
Среди природных биоорганических веществ большое место занимают соединения, которые относят к сопряженным системам.
Сопряженными( конъюгированными) называют кратные связи( двойные или тройные), разделенные одинарной связью.
..-С=С-С=С-С=С-С=С-…
|_______________|
цепь сопряжения
Чередующиеся кратные и простые связи образуют цепь сопряжения
Различают два вида сопряженных систем:
ациклические ( цепь сопряжения разомкнута)
циклические ( цепь сопряжения замкнута).
Атомы, присутствующие в цепи сопряжения, находятся в гибридном состоянии sp2,spили содержат неподеленные пары электронов( эти атомы тоже приобретают тип гибридизацииsp2)
Такими атомами могут быть атомы азота, кислорода, серы, галогенов.
Неподеленнаяпара электронов- это пара валентных( находится на внешнем энергетическом уровне) электронов, не участвует в обра зовании связи между двумя атомами. К ним относятся атомы –О- , -N-, -S-, -F-Cl.
Неподеленные пары электронов элементов второго периода( азот, кислород,
фтор) не могут быть распарены, поскольку в атоме нет свободных орбиталей. Их условно обозначают двумя точками над символом элемента.
Распределение электронов на внешнем энергетическом уровне атомов азота и
кислорода в невозбужденном состоянии представлено на диаграммах:
-↑- -↑-- - ↑- (одна неподеленная пара)
N1s22s22p3-↑↓- на внешнем уровне
--↑↓-- --↑-- --↑-- ( две неподеленные пары)
О 1s22s22p4-↑↓-
.
Распределение электронов на внешнем энергетическом уровне атома азота в
возбужденном состоянии N sp2возможно в двух вариантах.
---↑↓--- --↑--
N sp2-↑-- --↑-- ---↑--N sp2--↑↓-- --↑-- --↑---
«пиррольный» атом азота «пиридиновый» атом азота
В следующем разделе мы еще будем обсуждать распределение электронов на
орбиталях атома азота в ароматических гетероциклических соединениях.
Если в цепи сопряжения находятся только атомы в sp2- гибридном состоянии,
то такой вид сопряжения называется – π- π- сопряжение. Если присутствуют дополнительно гетероатомы( азот, кислород ), то обозначают какπ-р – сопряжение.
CН2=СН-СН=СН- СН=СН2СН2=СН-О-СН=СН2
π- π-сопряжениеπ-р- сопряжение
К ациклическим молекулам с сопряженными связями относятся :
* Бутадиен-1,3 , метилбутадиен-1,3( изопрен), который является мономером природного каучука, хлорвинил, который применяют для получения полимера полихлорвинила. В результате включения в сопряженную систему атом хлора малоподвижен, хлорвинил при попадании в организм накапливается, не подвергаясь обезвреживанию. Обнаружено, что он провоцирует развитие рака печени.
* Каротиноиды- каротин( пигмент моркови и красного перца), витамин А
формах ретинола и ретиналя, ликопин( пигмент помидора). Все они относятся к классу природных веществ терпеноидов. Имеют окраску от желтого до красного цветов, что связано с наличием длинной цепи сопряжения. Каротиноиды хорошо растворимы в жирах, их называют липохромами ; накапливаясь в подкожно-жировой клетчатке при избыточном поступлении в организм, придают коже оранжево- желтый оттенок.
Каротиноиды относятся к биологически активным веществам- витаминам
Витамин А участвует в акте фоторецепции, обладает антиоксидантным действием, используется как лекарственный препарат.
* Биологически активные карбоновые кислоты, занимающие видное место в процессе обмена веществ: пировиноградная , фумаровая, кротоновая.
|
Бутадиен-1,3 |
Метилбутадиен-1,3 (изопрен) |
|
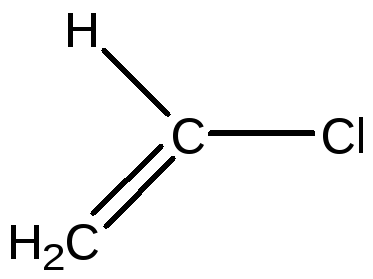
Хлорвинил |
СН3- С – О - СН = СН2 | | O |
|
Ретинол |
Ретиналь |
Ациклические сопряженные системы. Особенности электронного строения
Бутадиен-1,3 представляет собой простейшую π- π-сопряженную систему. Все четыре атома углерода находятся вsp2-гибридном состоянии( формула А )
1 2 3 4 …… …………..
СН2=СН-СН=СН2бутадиен-1,3 СН2-СН- СН-СН2
( А ) ( Б )
На участке сопряжения возможно взаимодействие негибридных р-электронов. Возникает делокализованная связь( условно обозначена. пунктирной линией над участком сопряжения, формула Б).
Делокализованная связь-это ковалентная связь , в которой π–электронная
плотность не локализована между двумя соседними р-орбиталями, а распределяется по всей π-орбитальной системе.
Только сопряжение создает возможность делокализации.
Какие имеются доказательства существования делокализованной системы в бутадиене?
1.Изменяется длина связей и геометрия молекулы. Связи С1-С2и С3-С4становятся длиннее по сравнению с двойной связью в этене, а связь С2-С3короче по сравнению с одинарной связью этана. Делокализация всегда сопровождается стремлением к выравниванию длин связей на участке сопряжения. Атомы на участке сопряжения располагаются в одной плоскости.
2.Реальная теплота гидрирования( присоединение водорода) меньше по сравнению с расчетной. Это означает, что энергия соединения меньше теоретически расчетной.
Выигрыш в энергии, получаемый в результате сопряжения, называется энергией сопряжения.
3.Изменяются химические свойства бутадиена-1,3. Возникает возможность присоединения брома в условиях ионной реакции в растворе при температуре 400С по краям сопряженной цепи ( присоединение по правилу 1,4 к бутадиену 1,3).
СН2=СН-СН=СН2+Br2—> СН2Bг-CH=CH-CH2Br
1,4- дибромбутен-2