- •Глава1. История развития биоорганической химии …………………………………
- •Глава 2. Лекции по биоорганической химии …………………………………………
- •Глава 1
- •1.. Характеристика химических связей в биоорганических соединениях
- •2. Сопряженные системы
- •2.1. Общие понятия о строении сопряженных систем
- •2 . 3 . Циклические сопряженные системы. Ароматичность
- •1. Устойчивость к действию окислителя перманганата калия в растворе.
- •3. Способность к реакциям замещения в растворе по ионному( катионному,
- •2.3.1. Современные представления о строении бензола
- •2. 3. 2. Медико-биологическое значение карбоциклических ароматических
- •2. 3. 3. Гетероциклические ароматические соединения
- •2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
- •2.2. Кислотно-основные свойства органических соединений
- •2.3. Медико- биологическое значение изучения темы « Кислотно-основные
- •3.1. Виды изомерии
- •3.2. Структурная изомерия.
- •3.2.1. Изомерия скелета
- •3.3. Динамическая изомерия.
- •3. 3.1. Кето-енольная таутомерия.
- •3.3.2. Лактим-лактамная таутомерия
- •3.4 Пространственная изомерия
- •3.4.1 Геометрическая( цис, транс) изомерия
- •3.4.4. Медико-биологическое значение стереоизомерии
- •4.1 Классификация реакций в биоорганической химии
- •4.1.1 Типы разрыва химических связей
- •4.1.2. Гомолитический тип разрыва связей.
- •4.1.3. Гетеролитический тип разрыва связей
- •4.2.1. Реакции электрофильного присоединения в ряду алкенов(а е)
- •4.2.2. Реакции нуклеофильного присоединения
- •7.Реакции у α- углеродного атома в карбонильных соединениях
- •8. Альдольная конденсация
- •1. Реакция нитрования
- •2. Реация сульфирования
- •3.Реакция галогенирования
- •4. Реакция алкилирования
- •4.2.4. Реакции нуклеофильного замещения ( s n )
- •Лекция 5 карбоновые кислоты и их гетерофункциональные
- •5.1. Классификация карбоновых кислот
- •5.2. Строение карбоксильной группы
- •5.2.1. Значение величин рКа некоторых карбоновых кислот :
- •5.3. Химические свойства карбоновых кислот
- •Этилацетат
- •5.4. Характеристика отдельных представителей монокарбоновых кислот ,
- •Масляная кислота ( н- бутановая кислота)
- •5.5. Непредельные монокарбоновые кислоты
- •5.6. Дикарбоновые кислоты
- •5.7. Непредельные ди- и трикарбоновые кислоты
- •5.8. Гидроксикислоты
- •5.8.3. Дигидроксидикарбоновые кислоты
- •5.9. Oксокарбоновые кислоты( альдегидо -, кетокарбоновые кислоты)
- •5.10 Приложение : Происхождение названий карбоновых кислот Сn н2n о2
- •6.1. Определение « липиды»
- •6.3. Основные представители липидов
- •6.3.1.Природные высшие карбоновые кислоты
- •3. Тиоэфиры
- •4. Дегидрирование насыщенной кислоты в активной форме с участием фермента.
- •6.3.2. Триацилглицерины( триглицериды)
- •6.3.3. Фосфатиды ( фосфолипиды ) и фосфатидовая кислота
- •6. 4. Принципы создания липотропных лекарственных препаратов
- •6.5 . Строение и химический состав мембран клеток
- •7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
- •7. 2 Классификация природных аминокислот
- •7. 3Физические свойства природных аминокислот
- •7.4 Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка
- •7.5. Качественная реакция обнаружения аминокислот
- •7. 6 . Химические свойства аминокислот
- •7 .6. 1 Химические свойства аминокислот in vitro
- •7.6.2. Химические свойства аминокислот in vivo
- •7.7. Строение витамина в6 и механизм реакции с его участием
- •7.8. Реакция поликонденсации, образование полипептидов
- •7. 9. Медико - биологическое значение аминокислот
- •7. 10. Применение аминокислот и их производных в качестве
- •Незаменимые аминокислоты обозначены звездочкой*
- •8.1. Определения « пептид» «белок»
- •8.2. Классификация белков
- •8.3. Строение пептидов и белков.
- •8.3.1. Первичная структура белка
- •8.3.2. Вторичная структура белка
- •8.3.3. Третичная и четвертичная структура белка
- •8.4. Физико-химические свойства белка
- •8.4.1. Амфотерность - кислотно- основные свойства белков.
- •8.4.2. Денатурация белка
- •8.5.Качественные реакции обнаружения белков в биологических объектах.
- •8. 6. Приложение. История развития химии белков
- •9. 1. Классификация углеводов
- •9.2. Моносахариды
- •9.3. Изомерия моносахаридов. Стереоизомерия. L- и д- ряды. Диастереомеры, энантиомеры, эпимеры. Значение отдельных представителей
- •9.4 Химические свойства моносахаридов
- •9.4. 3. Фосфорные эфиры
- •9.4.3 Образование гликозидов
- •9.4.4. Реакции восстановления
- •9.4.5Реакции окисления моносахаридов
- •9.5. Биологическое значение моносахаридов и их производных.
- •10.1. Олигосахариды. Дисахариды
- •10.1.1. Нередуцирующие дисахариды
- •10.1.2 Редуцирующие дисахариды.
- •10.2. Полисахариды
- •10.2.1.Гомополисахариды
- •11.1. Классификация нуклеиновых кислот, отличия в строении и составе как следствие различных биологических функций
- •11.2.Азотистые основания нуклеиновых кислот
- •11.2.2. Азотистые основания- производные пурина( аденин, гуанин)
- •11.3. Нуклеозиды
- •11.4. Нуклеотиды
- •11.5.Строение нуклеиновых кислот
- •11.6.Метаболизм пуриновых соединений в клетке
- •11.7. Биологически важные соединения- мононуклеотиды, динуклеотиды- участники важнейших биохимических процессов
- •11.8 Приложение . Справочные материалы к теме лекции
- •1953 – Дж. Уотсон и ф. Крик - модель двухцепочечной структуры днк.
- •12.1 Современная концепция создания биоорганических соединений –
- •12.1.1. Особые химические требования к лекарственному веществу
- •12.1.3. . Пути поиска и создания лекарственных препаратов
- •12.1.4 Классификация лекарственных веществ
- •12.2 Синтез, химические и физическиесвойства лекарственных соединений
- •12.2.1. Производные 4-аминобензойной кислоты
- •12.2.2. Производные 4-аминобензолсульфокислоты
- •Hso3Cl сульфохлорирование h2nr’ амин
- •Ацетиланилин
- •12. 2. 3. Лекарственные средства, производные салициловой кислоты
- •12.2.4. Лекарственные средства, производные 4 –аминофенола
- •12.2.5 Лекарственные средства на основе пиридинкарбоновых кислот
- •12. 2. 6. Производные пиримидина
- •12. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
- •13.1. Номенклатура алкалоидов
- •13.2. Классификация алкалоидов
- •13. 3. Функции алкалоидов
- •13.4. Содержание в растениях
- •13.5. Качественные реакции обнаружения алкалоидов
- •13.6. Фармакологическая активность- общий взгляд
- •13.7. Отдельные представители
- •13. 7.1. Алкалоиды группы фенилэтиламина
- •7.2 Производные пяти – и шестичленных гетероциклических соединений
- •137.3. Группа тропана
- •13.8. Витамины
- •Действие в организме
- •Стадии зрительного процесса на сетчатке глаза
- •14.1. Полимеры-определение. Виды полимеров
- •14. 2. Классификация вмс
- •14.3. Реакции полимеризации
- •14.3.1. Номенклатура полимеров.
- •14.3.2 . Общая характеристика мономеров.
- •14.3.3. Механизмы реакции полимеризации
- •14.4. Радикальная полимеризация
- •14.5. Ионная полимеризация
- •14.5.1. Катионная полимеризация
- •14.5.2. Анионная полимеризация
- •14.6. Координационная полимеризация
- •14.7.1. Блочная полимеризация
- •14.7.2. Эмульсионная полимеризация
- •14.7.3. Полимеризация в растворе
- •14.8. Конфигурация полимеров
- •14. 10. Физическое состояние полимеров
- •14.10.1. Аморфные полимеры
- •14 10.2. Кристаллические полимеры
- •14.11. Натуральный каучук
- •14.12 . Конденсационные полимеры
- •14. 13 Основные представители вмс
- •2. Структурные формулы биоорганических соединений
- •Сопряженные соединения
- •Карбоновые кислоты (указаны тривиальные названия)
- •Незаменимые аминокислоты обозначены звездочкой -*
- •Углеводы и их производные
- •Азотистые основания и их производные
- •1. Теоретические положения строения и свойств биоорганических
- •2. Важнейшие биополимеры организма
- •3. Липиды и низкомолекулярные регуляторы метаболизма.Важнейшие группы лекарственных средств
- •Курс лекций по биоорганической химии
- •060103 – Педиатрия
- •060104 –Медико-профилактическое дело
- •060105 - Стоматология
2. 3. 2. Медико-биологическое значение карбоциклических ароматических
соединений
Бензольные циклы присутствуют в природных биоактивных соединениях.
К ним следует отнести аминокислоты фенилаланин, тирозин
Производные аминокислоты тирозина- гормон адреналин, гормон и нейромедиатор норадреналин , гормон щитовидной железы тироксин, медиатор дофамин. Ароматическая бензольная система присутствует в женских половых гормонах эстрогенах, в то время как структурно им близкие мужские половые гормоны андрогены эту систему не содержат.
На основе ароматических соединений получено множество лекарств.
К производным бензола следует отнести сульфаниламидные препараты, обезболивающие ( новокаин, анестезин и их аналоги), аспирин и многие другие. Цикл нафталина содержится в витамине К и его синтетическом препарате викасоле. Викасол останавливает кишечные кровотечения , витамин К участвует в образовании факторов свертывающей системы крови и необходим для правильного формирования минерализованных тканей костей и зубов.
Устойчивость бензольной системы к действию окислителей замедляет метаболизм бензола и его производных в организме.
Отмечено накопление ароматических соединений в тканях с высоким содержанием липидов ( кроветворные органы, подкожно-жировая клетчатка, легкие), задержка в печени, где происходит основное разрушение этих веществ. Бензол избирательно накапливается в эндометрии матки и может оказывать тератогенное действие, вызывая появление уродств при развития плода.
Женщинам-химикам в детородном возрасте не рекомендуется работать с бензолом. Высокая токсичность многоядерных конденсированных ароматических соединений связывают с тем, что продукты их метаболизма обладают канцерогенной активностью. Многоядерные ароматические соединения легче и быстрее метаболизируют ( изменяются) в организме, поскольку в них наблюдается неравномерное распределение электронной плотности, и они легче поддаются реакциям окисления, которые лежат в основе детоксикации чужеродных для организма соединений ( ксенобиотиков). Процессы обезвреживания происходят в печени, почках, легких, коже и других тканях и органах с участием особого фермента цитохрома
р-450. Длительная работа с ароматическими углеводородами без соблюдения надлежащих правил техники безопасности сопровождается хроническим отравлением организма и развитием у химиков профессиональной болезни.
2. 3. 3. Гетероциклические ароматические соединения
Наиболее важные биоорганические соединения, встречающиеся в составе нуклеиновых кислот, витаминов, аминокислот, белков , содержат пятичленные и шестичленные циклы. В составе этих циклов присутствуют атомы азота, кислорода, серы, что и обусловило их название- гетероциклы ( гетер- греч- разный, другой)
Шестичленные ароматические гетероциклы
Шестичленные природные гетероциклические ароматические соединения содержат один или несколько атомов азота. В пиридине присутствует один атом азота, а в пиримидине два атома в положении 1,3 относительно друг друга.
|
.. Пиридин один основный центр |
.. Пиримидин два основных центра |
Рассмотрим диаграммы распределения электронов на валентных орбиталях в
шестичленных ароматических гетероциклах.
Вспомним диаграммы распределения электронов атомов углерода и азота в возбужденном sp2-состоянии.
--↑--
С sp2--↑-- --↑-- --↑--электрон π- связи.
3электрона σ - связей
--↑--
пиридиновый атом азотаNsp2--↑↓-- --↑-- --↑-электрон π- связи
2электрона σ - связей
неподеленная
пара
Все атомы углерода и азота находятся в sp2- гибридном состоянии . У атома азота на трех гибридизованных орбиталях находятся 2 одиночных электрона, которые образуют 2σ -связи цикла и неподеленная пара электронов , которая не участвует в образовании химических связей в соединении.
Негибридная орбиталь содержит один электрон, который включается в образовании
π- связи.
Таким образом, атом азота образует 3 связи ( две( σ) и одну ( π ) , сохраняя при этом свободную неподеленную пару электронов, которая отвечает за основные свойства «пиридинового» атома азота
Шестичленные гетероциклы сохраняют основные свойства( более слабые по сравнению с аммиаком) В молекуле пиридина один основный атом азота, а в пиримидине- два основных атома азота. Образование соли не нарушает ароматическую систему, но усиливает неравномерное распределение электронной плотности .
 +H+—>
+H+—>
.. | +
пиридин Н ион пиридиния
Ароматические свойства шестичленных азотсодержащих гетероциклов менее выражены по сравнению с бензолом.
Электроотрицательность Nsp2больше, чемCsp2, возникает неравномерное распределение электронной плотности, которое не согласуется с классическим понятиемароматическоесостояние ( делокализованная , равномерно распределенная электронная плотность). Гетероатомы снижают энергию делокализации.
Чем больше атомов азота, тем больше отклонение от ароматического состояния. Пиридин и пиримидин называют « π -недостаточные циклы илиπ- дефицитные»
Ароматические свойства убывают в последовательности
бензол > пиридин > пиримидин
Пятичленные ароматические гетероциклы
Пятичленные ароматические гетероциклы образованы с участием атомов азота, кислорода, серы.
|
Фуран |
Тиофен |
|
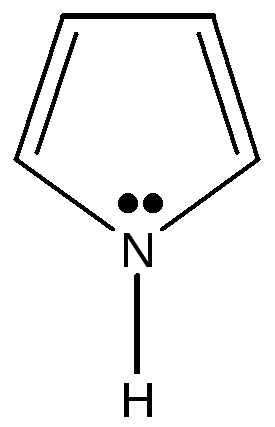
Пиррол |
Имидазол |
Все атомы, формирующие цикл, находятся в sp2- гибридном состоянии. Неподеленная пара электронов гетероатома участвует в образовании ароматического секстета: каждый атом углерода отдает по одному р-электрону, а гетероатом- неподеленную пару электронов, которая находится на негибридизованной р-орбитали.
Распределение электронов(электронная конфигурация) атома азота в пятичленном
гетероцикле пирроле изображено на диаграмме:
--↑↓---
Nsp2 --↑-- --↑-- --↑----2 электронапоступают в общую π - систему
3 электрона σ -связей
пиррольный атом азота
Имеется доказательство включения пары электронов гетероатома в ароматический секстет : пиррол не проявляет основных свойств, в обычных условиях не взаимодействует с кислотами и не образует солей.
Применяют два термина для обозначения атомов азота в составе ароматического гетероциклического соединения : пиридиновый атом азота и пиррольный атом азота.
Пиридиновый – обладает основными свойствами, пиррольный – не обладает, т.к. вкладывает свою пару электронов в образование ароматической системы.
Для примера можно привести соединение имидазол, который содержит оба вида атомов азота.
пиридиновый атом азота
 пиррольный атом азота
пиррольный атом азота
имидазол
Ароматические свойства пятичленных гетероциклических соединений выражены достаточно в сравнении с бензолом : у тиофена реакции ионного замещения проходят легче, при более низкой температуре. Возможно такое объяснение этому явлению : ароматический секстет распределен между пятью атомами цикла, на каждом атоме электронная плотность выше по сравнению с бензолом ( 6\5 и 6\6 соответственно).
Пиррол, фуран, тиофен относятся к «π -избыточным циклам».
Ароматические свойства пятичленных гетероциклических соединений зависят от величины электроотрицательности гетероатома.
Чем больше величина электроотрицательности, тем труднее гетероатом отдает свою неподеленную пару электронов в общую систему.
Известно, что электроотрицательность изменяется в ряду О > N > S и ароматические свойства убывают в ряду :
тиофен > пиррол > фуран
Медико- биологическое значение гетероциклических ароматических соединений
Изученные соединения имеют огромное значение в понимании многих биохимических процессов, на их основе синтезированы сотни лекарственных препаратов.
Пиридин.
Его производными являются никотиновая кислота, никотинамид ( витамин РР), который входит в состав переносчика электронов кофермента NAD+, витамина В6, регулирующего обмен аминокислот и синтез гликогена . На основе пиридина получены противотуберкулезные препараты ( изониазид)
Пиримидин. Три главных производных его- урацил, тимин и цитозин- входят в состав нуклеиновых кислот и носят название « азотистые основания» нуклеиновых кислот.
Пиррол. В составе сложной четырехпиррольной ароматической порфириновой системы , включающей в себя ионы металлов, образует гем( содержит ионы железа и меди) и хлорофилл( содержит ион магния). Сопряженная система гема содержит 30
π-электронов. ( Проверьте сами на соответствие правилу Хюккеля)
Пурин-конденсированное соединение, содержащее два цикла- имидазол и пиримидин, его производные аденин и гуанин входят в состав нуклеиновых кислот и АТФ- основное макроэргическое соединение организма содержит вещество аденин.

Пурин и пиримидин и их производные нашли широкое применение в производстве противоопухолевых. противовирусных, сульфаниламидных и других лекарственных препаратов( меркаптопурин, фторурацил, метилурацил, кофеин)
Для проверки усвоения раздела рекомендуем ответить на вопросы:
.
1.Укажите число π -электронов в сопряженной системе циклооктатетраена-1,3,5,7.
Варианты ответа а. 4 б. 6. в. 7. г. 8 д. 10. е. 12.
2.Несколько циклических соединений имеют плоское строение, сопряженная
система связей .Число π –электронов в этих соединениях может быть ( несколько ответов):
а. 14 б 12. в 10 г. 8 д. 6 е. 4
Какие из них являются ароматическими.?
3.Три соединения- пиррол, пиридин, тиофен. Расположите их в ряд в соответствии с увеличением ароматичности.
4.Три соединения- пиридин, бензол, пиримидин. Расположите их в ряд в соответствии с уменьшением ароматичности.
5.Составьте ряд из соединений в соответствии с увеличением ароматических свойств : пиридин, тиофен, пиримидин, фуран.
6. Изучите формулу пурина. Запомните порядок нумерации атомов в обоих циклах. Определите, какой атом не проявляет основные свойства?
Варианты ответа : а. N1б.N3в.N7г.N9
.
ЛЕКЦИЯ 2
ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛАХ БИООРГАНИЧЕСКИХ СОЕДИЕНИЙ. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ. КИСЛОТНЫЕ И ОСНОВНЫЕ СВОЙСТВА БИООРГАНИЧЕСКИХ МОЛЕКУЛ
Содержание лекции.
Взаимное влияние атомов в молекулах биоорганических соединений
2.1.1. Электронные эффекты заместителей. Индуктивный и мезомерный эффект. Донорные и акцепторные группы-заместители.
2.1.2. Распределение электронной плотности в биоорганических молекулах.
2.2. Кислотно-основные свойства органических соединений.
2.2.1. Теория Бренстеда-Лоури. Определения « кислоты и основания» в соответствии с теорией Бренстеда-Лоури.
2.2.2. Биоорганические соединения- кислоты. Влияние типа кислотного центра и
заместителей кислотные свойства.
2.2.3. Биоорганические соединения- основания. . Влияние типа основного центра и
заместителей основные свойства. свойства
Медико- биологическое значение изучения темы « Кислотно-основные свойства биоорганических соединений»
Исходный уровень знаний для усвоения темы
Гибридизация орбиталей и пространственная ориентация орбиталей элементов 2 периода., виды химических связей, особенности образования ковалентных σ- и π –связей, полярные и неполярные ковалентные связи, изменение электроотрицательности элементов в периоде и группе, функциональные группы, сопряженные системы, делокализация .