
- •Глава1. История развития биоорганической химии …………………………………
- •Глава 2. Лекции по биоорганической химии …………………………………………
- •Глава 1
- •1.. Характеристика химических связей в биоорганических соединениях
- •2. Сопряженные системы
- •2.1. Общие понятия о строении сопряженных систем
- •2 . 3 . Циклические сопряженные системы. Ароматичность
- •1. Устойчивость к действию окислителя перманганата калия в растворе.
- •3. Способность к реакциям замещения в растворе по ионному( катионному,
- •2.3.1. Современные представления о строении бензола
- •2. 3. 2. Медико-биологическое значение карбоциклических ароматических
- •2. 3. 3. Гетероциклические ароматические соединения
- •2.1. Взаимное влияние атомов в молекулах биоорганических соединений.
- •2.2. Кислотно-основные свойства органических соединений
- •2.3. Медико- биологическое значение изучения темы « Кислотно-основные
- •3.1. Виды изомерии
- •3.2. Структурная изомерия.
- •3.2.1. Изомерия скелета
- •3.3. Динамическая изомерия.
- •3. 3.1. Кето-енольная таутомерия.
- •3.3.2. Лактим-лактамная таутомерия
- •3.4 Пространственная изомерия
- •3.4.1 Геометрическая( цис, транс) изомерия
- •3.4.4. Медико-биологическое значение стереоизомерии
- •4.1 Классификация реакций в биоорганической химии
- •4.1.1 Типы разрыва химических связей
- •4.1.2. Гомолитический тип разрыва связей.
- •4.1.3. Гетеролитический тип разрыва связей
- •4.2.1. Реакции электрофильного присоединения в ряду алкенов(а е)
- •4.2.2. Реакции нуклеофильного присоединения
- •7.Реакции у α- углеродного атома в карбонильных соединениях
- •8. Альдольная конденсация
- •1. Реакция нитрования
- •2. Реация сульфирования
- •3.Реакция галогенирования
- •4. Реакция алкилирования
- •4.2.4. Реакции нуклеофильного замещения ( s n )
- •Лекция 5 карбоновые кислоты и их гетерофункциональные
- •5.1. Классификация карбоновых кислот
- •5.2. Строение карбоксильной группы
- •5.2.1. Значение величин рКа некоторых карбоновых кислот :
- •5.3. Химические свойства карбоновых кислот
- •Этилацетат
- •5.4. Характеристика отдельных представителей монокарбоновых кислот ,
- •Масляная кислота ( н- бутановая кислота)
- •5.5. Непредельные монокарбоновые кислоты
- •5.6. Дикарбоновые кислоты
- •5.7. Непредельные ди- и трикарбоновые кислоты
- •5.8. Гидроксикислоты
- •5.8.3. Дигидроксидикарбоновые кислоты
- •5.9. Oксокарбоновые кислоты( альдегидо -, кетокарбоновые кислоты)
- •5.10 Приложение : Происхождение названий карбоновых кислот Сn н2n о2
- •6.1. Определение « липиды»
- •6.3. Основные представители липидов
- •6.3.1.Природные высшие карбоновые кислоты
- •3. Тиоэфиры
- •4. Дегидрирование насыщенной кислоты в активной форме с участием фермента.
- •6.3.2. Триацилглицерины( триглицериды)
- •6.3.3. Фосфатиды ( фосфолипиды ) и фосфатидовая кислота
- •6. 4. Принципы создания липотропных лекарственных препаратов
- •6.5 . Строение и химический состав мембран клеток
- •7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
- •7. 2 Классификация природных аминокислот
- •7. 3Физические свойства природных аминокислот
- •7.4 Поведение аминокислот в водных растворах: образование цвиттер-ионов, изменение заряда и электрофоретической подвижности в зависимости от рН-среды. Изоэлектрическая точка
- •7.5. Качественная реакция обнаружения аминокислот
- •7. 6 . Химические свойства аминокислот
- •7 .6. 1 Химические свойства аминокислот in vitro
- •7.6.2. Химические свойства аминокислот in vivo
- •7.7. Строение витамина в6 и механизм реакции с его участием
- •7.8. Реакция поликонденсации, образование полипептидов
- •7. 9. Медико - биологическое значение аминокислот
- •7. 10. Применение аминокислот и их производных в качестве
- •Незаменимые аминокислоты обозначены звездочкой*
- •8.1. Определения « пептид» «белок»
- •8.2. Классификация белков
- •8.3. Строение пептидов и белков.
- •8.3.1. Первичная структура белка
- •8.3.2. Вторичная структура белка
- •8.3.3. Третичная и четвертичная структура белка
- •8.4. Физико-химические свойства белка
- •8.4.1. Амфотерность - кислотно- основные свойства белков.
- •8.4.2. Денатурация белка
- •8.5.Качественные реакции обнаружения белков в биологических объектах.
- •8. 6. Приложение. История развития химии белков
- •9. 1. Классификация углеводов
- •9.2. Моносахариды
- •9.3. Изомерия моносахаридов. Стереоизомерия. L- и д- ряды. Диастереомеры, энантиомеры, эпимеры. Значение отдельных представителей
- •9.4 Химические свойства моносахаридов
- •9.4. 3. Фосфорные эфиры
- •9.4.3 Образование гликозидов
- •9.4.4. Реакции восстановления
- •9.4.5Реакции окисления моносахаридов
- •9.5. Биологическое значение моносахаридов и их производных.
- •10.1. Олигосахариды. Дисахариды
- •10.1.1. Нередуцирующие дисахариды
- •10.1.2 Редуцирующие дисахариды.
- •10.2. Полисахариды
- •10.2.1.Гомополисахариды
- •11.1. Классификация нуклеиновых кислот, отличия в строении и составе как следствие различных биологических функций
- •11.2.Азотистые основания нуклеиновых кислот
- •11.2.2. Азотистые основания- производные пурина( аденин, гуанин)
- •11.3. Нуклеозиды
- •11.4. Нуклеотиды
- •11.5.Строение нуклеиновых кислот
- •11.6.Метаболизм пуриновых соединений в клетке
- •11.7. Биологически важные соединения- мононуклеотиды, динуклеотиды- участники важнейших биохимических процессов
- •11.8 Приложение . Справочные материалы к теме лекции
- •1953 – Дж. Уотсон и ф. Крик - модель двухцепочечной структуры днк.
- •12.1 Современная концепция создания биоорганических соединений –
- •12.1.1. Особые химические требования к лекарственному веществу
- •12.1.3. . Пути поиска и создания лекарственных препаратов
- •12.1.4 Классификация лекарственных веществ
- •12.2 Синтез, химические и физическиесвойства лекарственных соединений
- •12.2.1. Производные 4-аминобензойной кислоты
- •12.2.2. Производные 4-аминобензолсульфокислоты
- •Hso3Cl сульфохлорирование h2nr’ амин
- •Ацетиланилин
- •12. 2. 3. Лекарственные средства, производные салициловой кислоты
- •12.2.4. Лекарственные средства, производные 4 –аминофенола
- •12.2.5 Лекарственные средства на основе пиридинкарбоновых кислот
- •12. 2. 6. Производные пиримидина
- •12. 2 .7. Производные пурина- кофеин, теофиллин, теобромин
- •13.1. Номенклатура алкалоидов
- •13.2. Классификация алкалоидов
- •13. 3. Функции алкалоидов
- •13.4. Содержание в растениях
- •13.5. Качественные реакции обнаружения алкалоидов
- •13.6. Фармакологическая активность- общий взгляд
- •13.7. Отдельные представители
- •13. 7.1. Алкалоиды группы фенилэтиламина
- •7.2 Производные пяти – и шестичленных гетероциклических соединений
- •137.3. Группа тропана
- •13.8. Витамины
- •Действие в организме
- •Стадии зрительного процесса на сетчатке глаза
- •14.1. Полимеры-определение. Виды полимеров
- •14. 2. Классификация вмс
- •14.3. Реакции полимеризации
- •14.3.1. Номенклатура полимеров.
- •14.3.2 . Общая характеристика мономеров.
- •14.3.3. Механизмы реакции полимеризации
- •14.4. Радикальная полимеризация
- •14.5. Ионная полимеризация
- •14.5.1. Катионная полимеризация
- •14.5.2. Анионная полимеризация
- •14.6. Координационная полимеризация
- •14.7.1. Блочная полимеризация
- •14.7.2. Эмульсионная полимеризация
- •14.7.3. Полимеризация в растворе
- •14.8. Конфигурация полимеров
- •14. 10. Физическое состояние полимеров
- •14.10.1. Аморфные полимеры
- •14 10.2. Кристаллические полимеры
- •14.11. Натуральный каучук
- •14.12 . Конденсационные полимеры
- •14. 13 Основные представители вмс
- •2. Структурные формулы биоорганических соединений
- •Сопряженные соединения
- •Карбоновые кислоты (указаны тривиальные названия)
- •Незаменимые аминокислоты обозначены звездочкой -*
- •Углеводы и их производные
- •Азотистые основания и их производные
- •1. Теоретические положения строения и свойств биоорганических
- •2. Важнейшие биополимеры организма
- •3. Липиды и низкомолекулярные регуляторы метаболизма.Важнейшие группы лекарственных средств
- •Курс лекций по биоорганической химии
- •060103 – Педиатрия
- •060104 –Медико-профилактическое дело
- •060105 - Стоматология
5.7. Непредельные ди- и трикарбоновые кислоты
Малеиновая ( цис - бутендиовая) и фумаровая (транс - бутендиовая) кислоты – геометрические изомеры, кристаллические вещества. Малеиновая кислота хорошо растворима в воде, а фумаровая- трудно.
Фумаровая кислота- биологически активное соединение - содержится в грибах, лишайниках, клетках растений, выделена из повилики ( Fumariaofficinalis) ; в тканях животных и человека образуется в митохондриях в процессе реакций цикла Кребса. Малеиновая кислота- токсичное соединение для животных и человека, в природе не обнаружена.
Н Н Н СООН
\ / УФ, Т0,R·\ /
С = С ——————> С= С более устойчивая форма
/ \ / \
НООС СООН НООС Н
малеиновая кислота фумаровая кислота
Не может быть катализатора , осуществляющего обратный переход фумаровой кислоты в малеиновую.
Обе кислоты восстанавливаются в янтарную кислоту., in vivo это происходит с фумаровой кислотой с участием молекулы ФАДН2
НООС- СН=СН - СООН + ФАДН2 —фермент—>НООС - СН2 –СН 2– СООН +ФАД
фумаровая кислота янтарная кислота
В ферментативных реакциях in vivoприсоединение воды к фумаровой кислоте ( гидратация) приводит к образованию одного определенного пространственного изомера яблочной кислоты (DилиL) [чтобы лучше понять материал, посмотрите снова лекцию « Изомерия» ]
НООС- СН=СН - СООН + НОН — (фермент ) ———> НООС - СН –СН2– СООН
|
ОН
яблочная кислота
( в биохимии называют – малат)
5.8. Гидроксикислоты
Содержат функциональную гидроксильную группу. В природе встречаются моно- , ди -, трикарбоновые кислоты, содержащие одну или несколько гидроксильных групп.
5.8.1.Моногидроксимонокарбоновые кислоты
Содержат две функциональные группы
- карбоксильную и гидроксильную ( первичную, вторичную, третичную) , которые определяют их химические свойства
Химические свойства связаны с наличием двух функциональных групп
ОН-R–CООН
/ \
образуют производные образуют производные с участием
с участие гидроксильной карбоксильной группы
( спиртовой) группы - соли
- простые эфиры - сложные эфиры
- сложные эфиры - амиды
- замещение на атом галогена
- вступают в реакции
- окисления ( образуется карбонильная групп)
- дегидратации ( получается непредельная кислота)
Для моногидроксикарбоновых кислот характерна изомерия:
- структурная ( связана со строением скелета и положением гидроксильной группы)
- оптическая (стерео ), проявляющаяся в существовании энантиомеров.
Гидроксикарбоновые кислоты хорошо растворимы в воде .
Гомологический ряд начинается с гидроксиуксусной ( гликолевой ) кислоты.
СН 2– СООН
|
ОН
Твердое кристаллическое вещество. Обнаружена в свекловичном соке, репе, незрелом винограде. Применяется в промышленности для дубления кож, а в косметологии- самостоятельно или в составе «фруктовых кислот» в качестве химического пилинга для удаления части наружного мертвого эпителиального слоя кожи.
Гидроксипропановые кислоты- возможны 2 структурных изомера.
2-гидроксипропановая кислота( молочная, лактат) - важнейший природный метаболит, образуется из углеводов( глюкозы, крахмала, гликогена) в условиях анаэробного обмена ( в отсутствии кислорода).
Содержит асимметрический( * ) атом углерода, существует в виде двух изомеров: L-лактата иD–лактата.
энантиомеры-зеркальные изомеры
СООН СООН
СН3-*СН - СООН | |
| НО- С - Н Н- С - ОН
ОН | |
СН 3СН3
(+) L-лактат ( - ) D –лактат
Впервые открыта химиком Шееле в кислом молоке. D –лактатобразуется в мышцах и других органах человека и животных в процессе анаэробного превращения глюкозы
( анаэробного гликолиза)
Напоминаем, что физические свойства энантиомеров одинаковы( Т0плавл. = 26 -280) Отличия только в знаке вращения плоскополяризованного луча. Обратите внимание, что в данном случае изомерL– ряда является правовращающим, аD– ряда – левовращающим. Соли молочной кислоты носят название лактаты, в медицине молочную кислоту используют для пилинга, для оценки функции печени. В пищевой промышленности ее добавляют к сокам, эссенциям.
В биохимических реакциях важную роль играет обратимая реакция окисления молочной кислоты в пировиноградную, которая протекает в печени, миокарде и других органах и тканях организма в присутствии кислорода.
фермент лактатдегидрогеназа
СН3– СН- СООН + НАД+<—————> СН3-С - СООН + НАДН + Н+
| | |
ОН О
молочная кислота пировиноградная кислота
Гидроксибутановые кислоты.
Биологическое значение имеют 2 изомера: 3-гидроксибутановая кислота и 4-гидроксибутановая кислота
3-гидроксибутановая кислота (ß-оксимасляная) – образуется в связанном состоянии с белком-ферментом в процессе биосинтеза высших карбоновых кислот,L –стереоизомеробразуется в печени и в свободном виде выделяется в кровь, поступает в мышцы и выполняет энергетические функции, участвуя в реакциях цикла Кребса. Эта биологическая функция обозначается как «кетоновое тел».
СН3– СН –СН 2- СООН СООН
| |
ОН СН 2
3-гидроксибутановая кислота| L -3-гидроксибутановая кислота
(ß-оксимасляная) НО –*С – Н ( β -гидроксимасляная )
|
СН3
В биохимических реакциях in vivo 2 превращения имеют важное значение для протекания обмена веществ :
- реакция окисления ( образуется 3 –оксобутановая кислота)
- реакция дегидратации ( образуется 2-бутеновая – кротоновая- кислота )
Окисление фермент
СН3– СН –СН 2- СООН + НАД+< —————> СН3– С –СН 2- СООН + НАДН + Н+
| | |
ОН О
3-оксобутановая кислота
( ацетоуксусная)
Дегидратация
4 3 2 1 фермент
СН3– СН –СН 2- СООН <—————> СН3– СН = СН - СООН + Н2О
| более сильный
ОН кислотный центр 2-бутеновая( кротоновая) кислота
В таком же направлении проходит реакция in vitro ( по правилу Попова-Зайцева)
Дегидратация 3-гидроксибутановой кислоты относится к реакциям элиминирования. Из двух возможных изомеров образуется только один, поскольку атомы водорода , связанные с атомом углерода С-2 являются более подвижными. Вследствие акцепторного действия карбоксильной группы у атома С-2 образуется более сильный кислотный центр, чем у С-4. Реакция обратима, при гидратации кротоновой кислоты образуется 3-гидроксибутановая кислота.
4- гидроксибутановая(γ – оксимасляная, ГОМК ) кислота превращается в циклический сложный эфир - лактон ( бутиролактон) – внутримолекулярная реакция дегидратации.
СН 2– СН2–СН 2- СООН Н2С —— СН2
| ————> | | + Н2О
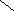 ОН
Н2С С = Обутиролактон
ОН
Н2С С = Обутиролактон
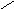
О
В организме человека γ - оксимасляная кислота образуется в нейронах мозга и обладает фармакологическим эффектом, является медиатором торможения центральной нервной системы.
Используется как лекарственный препарат только в виде соли- натрия оксибутирата (Natriiоxybutyras) , чтобы исключить образование лактона, поскольку лактон не
обладает фармакологическом эффектом.
СН 2– СН2–СН 2- СООNa γ – гидроксибутират ( ГОМК – Na)
|
ОН
NB!Врач-анестезиолог должен помнить, что при изменении нормального значения рН крови в кислую сторону ( что часто встречается при недостатке кислорода) происходит превращение натрия оксибутирата вγ-оксимасляную кислоту, которая сразу образует неактивный бутиролактон и эффективность действия препарата снижается.
5.8.2 Гидроксидикарбоновые кислоты(содержат две карбоксильные группы)
Моногидроксидикарбоновая кислота – 2-гидроксибутандиовая (оксиянтарная,. яблочная кислота, малат) – биологически активное соединение, присутствует в тканях животных, человека, в растениях ( много в рябине, барбарисе). Впервые выделена К.Шееле в 1785 г. из незрелых яблок
НООС – СН2 – СН – СООН
|
ОН
Существует в виде двух стереоизомеров и рацемической смеси. L-малат образуется в процессе реакций цикла Кребса. Присутствие гидроксильной группы делает возможным две реакции: элиминирования и окисления.
Обратимая реакция элиминирования ( дегидратации) приводит к образованию более устойчивого транс-изомера бутендиовой кислоты – фумаровой. В условияхin vivo эта реакция происходит в процессе цикла Кребса.
НООС-СН( ОН ) -СН2 –СООН <——фермент——> НООС-СН=СН-СООН + Н2О
фумаровая кислота
транс-бутендиовая
Обратимая реакция окисления сопровождается образованием кетокислоты : 2-оксобутандиовой( оксоянтарной, щавелевоуксусной )
НООС- СН-СН2-СООН + НАД+<——фермент——> НООС-С –СН2-СООН
| | |
ОН О
щавелевоуксусная кислота ( ЩУК)
Яблочную кислоту в медицине применяют в составе слабительных средств и препаратов от хрипоты.
