
4.История батареек
Первый химический источник электрического тока был изобретен случайно, в конце 17 века итальянским ученым Луиджи Гальвани. На самом деле целью изысканий Гальвани был совсем не поиск новых источников энергии, а исследование реакции подопытных животных на разные внешние воздействия. В частности, явление возникновения и протекания тока было обнаружено при присоединении полосок из двух разных металлов к мышце лягушачьей лапки. Теоретическое объяснение наблюдаемому процессу Гальвани разработал неверное, однако его опыты стали основой исследований другого итальянского ученого Алессандро Вольта, который собственно и сформулировал главную идею изобретения — причиной возникновения электрического тока является химическая реакция, в которой принимают участие пластинки металлов. Для подтверждения своей теории Вольт создал нехитрое устройство, состоявшее из цинковой и медной пластин погруженных в емкость с соляным раствором. Именно это устройство стало первым в мире автономным элементом питания и прародителем современных батарей, которые в честь Луиджи Гальвани именуют гальваническими элементами.
Современные автономные источники питания внешне имеют мало общего с устройством, созданным Алессандро Вольта, однако базовый принцип остался неизменным. Любая батарея состоит из трех основных элементов – двух электродов, называемых анодом и катодом, и электролита находящегося между ними. Возникновение электрического тока – это побочный результат окислительно-восстановительной реакции идущей между электродами. Выходной ток, напряжение и другие параметры батареи зависят от выбранных материалов анода, катода и электролита, а также конструкции самой батареи. Все батареи можно разделить на два больших класса – первичные и вторичные. В первичных элементах питания химические реакции являются необратимыми, а во вторичных – обратимыми. Соответственно – вторичные элементы, которые известным нам как аккумуляторы, можно восстановить (зарядить) и использовать заново.
Начало промышленного производства первичных химических источников тока было заложено в 1865 г. французом Ж. Л. Лекланше, предложившим марганцево-цинковый элемент с солевым электролитом. В 1880 г. Ф. Лаландом был создан марганцево-цинковый элемент с загущенным электролитом. Впоследствии этот элемент был значительно улучшен. Существенное улучшение характеристик было получено при применении электролитического диоксида марганца на катоде и хлорида цинка в электролите. До 1940 г. марганцево-цинковый солевой элемент был практически единственным используемым первичным химическим источником тока. Несмотря на появление в дальнейшем других первичных источников тока с более высокими характеристиками, марганцево-цинковый солевой элемент используется в очень широких масштабах, в значительной мере благодаря его относительно невысокой цене.
Одним из важнейших факторов при разработке батарей (а также любого устройства, питающегося от них) является достижение максимальной удельной емкости для элемента заданного (минимального) размера и веса. Химические реакции, протекающие внутри элемента, определяют и его емкость, и физические размеры. В принципе, вся история разработки батарей сводится к нахождению новых химических систем и упаковке их в корпуса как можно меньших размеров.
Сегодня производится множество разных типов элементов питания, некоторые из которых были разработаны еще в 19-ом веке, а другие едва отметили десятилетие. Такое разнообразие объясняется тем, что каждая технология имеет свои сильные стороны. Мы расскажем о самых распространенных из тех, что используются в мобильных устройствах.
Сухие батареи
Первыми серийно выпускаемыми элементами питания стали именно сухие. Наследники изобретения Лекланше, они являются самыми распространенными в мире. Одна лишь компания Energizer продает более 6 миллиардов таких батарей ежегодно. В общем, "говорим батарейка, подразумеваем – сухой элемент". И это, несмотря на то, что они имеют самую низкую удельную емкость из всех "массовых" типов. Объясняется такая популярность, во-первых, их дешевизной, а во-вторых, тем, что этим именем называют сразу три разных химических системы: хлорно-цинковые, щелочные и марганцево-цинковые батареи (элементы Лекланше). Их имена дают представление о химических системах, на базе которых они созданы.
В сухих элементах по оси батарейки расположен угольный стержень токосъемника катода. Сам катод это целая система, в которую входят диоксид марганца, уголь электрода и электролит. Цинковый "стаканчик" служит анодом и образует металлический корпус элемента. Электролит, в свою очередь, также представляет собой смесь, в которую входят нашатырь, диоксид марганца и хлорид цинка.
Марганцево-цинковые и хлорно-цинковые элементы отличаются, по сути, электролитом. Первые содержат в себе смесь нашатыря и хлорида цинка, разбавленную водой. В хлорно-цинковых электролит почти на 100% представляет собой хлорид цинка. Различие в номинальном напряжении у них минимально: 1,55В и 1,6В соответственно.
Несмотря на то, что хлорно-цинковые имеют большую емкость по сравнению с элементами Лекланше, это преимущество пропадает при малой нагрузке. Поэтому на них часто пишут "heavy-duty", то есть элементы с повышенной мощностью. Как бы то ни было, эффективность всех сухих элементов сильно падает при увеличении нагрузки. Именно поэтому в современные фотоаппараты их ставить не стоит, они просто для этого не предназначены.
Сколько бы не бегали розовые зайчики в рекламе, щелочные батарейки — это все те же угольно-цинковые ископаемые родом из 19го века. Единственное отличие заключается в специально подобранной смеси электролита, позволяющей добиться увеличения емкости и срока хранения таких батареек. В чем секрет? Эта смесь является несколько более щелочной, чем у двух других типов.
Если химический состав у щелочных батареек мало отличается от оного у элемента Лекланше, то в конструкции различия существенны. Можно сказать, что щелочная батарея это сухой элемент, вывернутый наизнанку. Внешний корпус у них не является анодом, это просто защитная оболочка. Анодом здесь является желеобразная смесь цинкового порошка вперемешку с электролитом (который в свою очередь является водным раствором гидроксида калия). Катод, смесь угля и диоксида марганца, окружает анод и электролит. Он отделяется слоем нетканого материала, таким как полиэстер.
В зависимости от области применения, щелочные батарейки могут прослужить в 4-5 раз дольше, чем обычные угольно-цинковые. Особенно заметна эта разница при таком режиме использования, когда короткие периоды высокой нагрузки перемежаются длительными периодами бездействия.
Важно помнить, что щелочные батарейки не являются перезаряжаемыми, потому что химические процессы, на которых они основаны, не являются обратимыми. Если ее поставить в зарядное устройство, то она будет вести себя не как аккумулятор, а скорее как резистор – начнет нагреваться. Если ее оттуда вовремя не вынуть, то она нагреется достаточно сильно, чтобы взорваться.
Никель-кадмиевые аккумуляторы
Название подсказывает нам, что батареи этого типа имеют никелевый анод и кадмиевый катод. Никель-кадмиевые аккумуляторы (обозначаются Ni-Cad) пользуются заслуженной популярностью у потребителей во всем мире. Не в последнюю очередь это объясняется тем, что они выдерживают большое количество циклов зарядки-разрядки — 500 и даже 1000 — без существенного ухудшения характеристик. Кроме того они относительно легкие и энергоемкие (хотя их удельная емкость приблизительно в два раза меньше, чем у щелочных батареек). С другой стороны, они содержат токсичный кадмий, так что с ними надо быть поаккуратнее, как во время использования, так и после, при утилизации.
Напряжение на выходе у большинства батарей падает по мере разрядки, потому что в результате химических реакций увеличивается их внутреннее сопротивление. Никель-кадмиевые батареи характеризуются очень низким внутренним сопротивлением, а потому могут подать на выход достаточно сильный ток, который, к тому же, практически не изменяется по мере разрядки. Соответственно, напряжение на выходе также остается практически неизменным до тех пор, пока заряд почти совсем не иссякнет. Тогда напряжение на выходе резко падает практически до нуля.
Постоянный уровень выходного напряжения является преимуществом при проектировании электрических схем, но это же делает определение текущего уровня заряда практически невозможным. Из-за такой особенности остаток энергии вычисляется на основе времени работы и известной емкости конкретного типа батарей, а потому является величиной приблизительной.
Гораздо более серьезным недостатком является "эффект памяти". Если такую батарею разрядить не полностью, а потом поставить заряжаться, то их емкость может уменьшиться. Дело в том, что при такой "неправильной" зарядке на аноде образуются кристаллы кадмия. Они и играют роль химической "памяти" батарейки, запоминая этот промежуточный уровень. Когда во время следующей разрядки заряд батареи упадет до этого уровня, выходное напряжение понизится так же, как если бы батарейка была полностью разряжена. Злопамятные кристаллы будут продолжать формироваться на аноде, усиливая влияние этого неприятного эффекта. Чтобы избавиться от него, нужно продолжить разрядку после достижения этого промежуточного уровня. Только таким образом можно "стереть" память и восстановить полную емкость батареи.
Этот прием обычно называют глубокой разрядкой. Но глубокая не значит полная, "до нуля". Это лишь навредит и укоротит срок службы элемента. Если в процессе использования напряжение на выходе упадет ниже отметки 1 Вольт (при номинальном напряжении 1,2 В), то это уже может привести к порче батарейки. Сложная техника, например КПК или ноутбуки, настроены таким образом, чтобы они отключались прежде, чем заряд аккумулятора упадет ниже предельного уровня. Для глубокой разрядки батарей нужно использовать специальные приборы, которые выпускают многие известные фирмы.
Некоторые компании-производители заявляют, что новые никель-кадмиевые аккумуляторы не подвержены влиянию эффекта памяти. Впрочем, на практике это не было доказано.
Что бы там не обещали производители, для достижения максимальной отдачи батареи следует каждый раз полностью заряжать, а потом дожидаться нормальной разрядки, чтобы они не испортились и прослужили весь срок.
Частично устранить недостатки никель-кадмиевых аккумуляторов были призваны никель-металлогидридные (Ni-MH) аккумуляторы, в которых отсутствовал «опасный» кадмий. Так же, как и в никель-кадмиевых, в никель-металлогидридных аккумуляторах анод никелевый, но катоды были сделаны из гидридов, которые фактически представляют собой металлические сплавы, способные удерживать атомарный водород. У никель-металлогидридных аккумуляторов значительно слабее выражен эффект памяти, они имеют лучшее соотношение емкости и габаритных размеров. Однако никель-металлогидридные аккумуляторы выдерживают меньшее количество циклов заряд-разряд и дороже никель-кадмиевых. Также проблемой для никель-металлогидридных аккумуляторов стала большая величина саморазряда – за сутки, без нагрузки, аккумуляторы данного типа умудрялись терять до 5% от своей емкости.
Свинцовые элементы
Большинство аккумуляторов в мире — свинцовые. В основном их используют для пуска двигателей автомобилей. Прообразом этих элементов стали разработки Плантэ. В них также есть аноды, сделанные из ячеистого свинца, и катоды — из оксида свинца. Оба электрода погружены в электролит — серную кислоту.
Из-за свинца эти батареи очень тяжелы. А так как они залиты высококоррозийной кислотой (которая также утяжеляет аккумуляторы), они становятся ещё и опасными, требующими особого внимания. Кислота и испарения могут повредить соседствующие объекты (особенно металлические). А если переусердствовать с зарядкой, может начаться электролиз воды, находящейся в кислоте. При этом вырабатывается водород, взрывоопасный газ, который при определённых условиях может взорваться (как в случае взрывов Хинденбурга).
Разложение воды в батарее может привести и к другому эффекту: ведь общее количество воды в батарее уменьшается. При этом уменьшается площадь реакции внутри батареи, соответственно, уменьшается и емкость аккумулятора. Кроме того, уменьшение жидкости позволяет батарее разряжаться под воздействием атмосферы. Электроды могут шелушиться и вообще закоротить батарею.
Первые свинцовые аккумуляторы требовали регулярного ухода — было необходимо поддерживать нужный уровень воды/кислоты внутри каждого элемента. Так как в батарее подвергается электролизу только вода, заменять необходимо только её. Чтобы избежать загрязнения батареи, производители рекомендуют использовать для обслуживания только дистиллированную воду. Обычно батарею доливают до нормального уровня. Если на батарее нет метки, её необходимо доливать так, чтобы жидкость закрывала пластины электродов внутри.
В неподвижных устройствах, корпус у батарей выполнен из стекла. Оно не только хорошо держит кислоту, но и позволяет обслуживающему персоналу без особых трудностей определять состояние элементов. В автомобильной технике требуются более прочные корпуса. Инженеры для этих целей воспользовались эбонитом или пластиком.
После того, как элементы стали герметизировать, удобство использования таких свинцовых аккумуляторов стало бесценным. В результате появились так называемые необслуживаемые батареи. Так как испарения так и остаются внутри элементов, потери от электролиза сводятся к минимуму. Поэтому такие батареи и не требуют заправки водой (по крайней мере, не должны).
Но это не значит, что у таких батарей вовсе не возникает проблем с обслуживанием. Всё равно внутри плещется кислота. И эта кислота может вытечь через батарейные клапаны. При этом могут повредиться батарейные отсеки или даже оборудование, где она установлена. Инженеры избегают такой ситуации двумя способами. Можно содержать кислоту внутри пластикового сепаратора между электродами элемента (обычно, он сделан из микропористого полиолефина или полиэтилена). Либо можно смешать электролит с другим веществом, чтобы в результате получился гель — например, с коллоидальной массой наподобие желатина. В результате утечка не происходит.
Кроме опасной начинки, у свинцовых батарей есть и другие недостатки. Как было отмечено выше, они очень тяжелые. Количество энергии, которое содержится в единице массы у таких батарей меньше, чем в батареях практически любых других технологий. Это единственное, чем не удовлетворены создатели автомобилей, которые бы с большим удовольствием использовали эти недорогие свинцовые батареи в электрокарах.
С другой стороны, хотя эти батареи и дешевые, они насчитывают 150 летнюю историю. Технология позволяет модернизировать аккумуляторы для специальных нужд, например для использования в устройствах с большими циклами разряда (где батареи используются в качестве единственного источника питания) или в устройствах обеспечения бесперебойного питания, например, в больших центрах обработки информации. Свинцовые батареи также обладают низким внутренним сопротивлением и поэтому могут вырабатывать очень большие токи. В отличие от более экзотичных элементов, к примеру, никель-кадмиевых, они не подвержены эффекту памяти. (Этот эффект, применительно к никель-кадмиевым элементам, сокращает емкость батареи, если перезаряжать её ещё до того, как она полностью разрядится.) Кроме того, такие батареи достаточно долго живут и они предсказуемы. И, конечно же, они дешевы.
Источники бесперебойного питания
В большинстве таких источников используются свинцовые аккумуляторы с желеобразным электролитом. Обычно, такие устройства неприхотливы в обслуживании. Это значит, вы не задумываетесь об их обслуживании. Источники питания, тем не менее, довольно громоздки — ведь внутри находятся аккумуляторы. Будучи полностью заряженными, элементы с желеобразным электролитом постепенно портятся под воздействием постоянного слаботочного заряда. (Большинство свинцовых аккумуляторов содержатся в полностью заряженном состоянии). Поэтому такие элементы требуют специальных зарядных устройств, которые бы автоматически отключались, как только элемент полностью зарядится. Зарядное устройство должно снова включаться, как только аккумулятор разрядится до предопределённого уровня (не важно, под воздействием ли нагрузки, или в результате саморазряда). Обычно источники бесперебойного питания регулярно проверяют заряд аккумулятора.
Предотвращение электролиза
Как и в свинцовых аккумуляторах, в никель-кадмиевых батарейках возможен электролиз — распад воды в электролите на потенциально взрывоопасные водород и кислород. Производители батареек предпринимают различные меры для предотвращения этого эффекта. Обычно элементы для предотвращения утечки герметично упаковывают. Кроме того, батарейки устроены так, чтобы сначала вырабатывался не водород, а кислород, который предотвращает реакцию электролиза.
Для того чтобы герметичные аккумуляторы не взрывались, и чтобы в них не скапливался газ, обычно в батарейках предусматривают клапаны. Если закрыть эти вентиляционные отверстия, то возникнет опасность взрыва. Обычно эти отверстия настолько малы, что остаются незамеченными. Работают они автоматически. Это предостережение (не закрывать вентиляционные отверстия) относятся в основном к производителям устройств. Стандартные отсеки для батареек предполагают возможность вентиляции, но вот если залить батарейку в эпоксидной смоле, то вентиляции не будет.
Литий-ионные аккумуляторы
Литий является самым химически активным металлом и используется именно в самых компактных системах, обеспечивающих энергией самую современную мобильную технику. Литиевые катоды используются практически во всех батареях с большой емкостью. Но благодаря активности этого металла батареи получаются не только очень емкие, они также имеют самое высокое номинальное напряжение. В зависимости от анода, литий-содержащие элементы имеют выходное напряжение от 1,5 В до 3,6 В!
Основной проблемой при использовании лития опять-таки является его высокая активность. Он даже может вспыхнуть – что уж говорить, не самая приятная особенность, когда речь идет о батареях. Из-за этих проблем элементы на базе металлического лития, которые начали появляться еще в 70ых-80ых годах 20го века, "прославились" своей низкой надежностью.
Чтобы избавиться от этих трудностей, производители батарей постарались использовать литий в виде ионов. Таким образом, им удалось получить все полезные электрохимические качества, не связываясь с капризной металлической формой.
В литий-ионных элементах ионы лития связаны молекулами других материалов. Типичный Li-Ion-аккумулятор имеет угольный анод и катод из литийкобальтдиоксида. Электролит в своей основе имеет раствор солей лития.
Литиевые батареи имеют большую плотность, нежели никель-металл гидридные. Скажем, в ноутбуках такие аккумуляторы могут работать в полтора раза дольше никель-металл гидридных. Кроме того, литий-ионные элементы избавлены от эффектов памяти, которыми страдали ранние никель-кадмиевые батареи.
С другой стороны, внутреннее сопротивление у современных литиевых элементов выше, чем у никель-кадмиевых. Соответственно, они не могут обеспечить такие сильные токи. Если никель-кадмиевые элементы способны расплавить монету, то литиевые на это не способны. Но все равно, мощности таких батареек вполне хватит для работы ноутбука, если это не связано со скачкообразными нагрузками(это значит, что некоторые устройства, например, винчестер или CD-ROM, не должны вызывать высоких скачков на предельных режимах — например, при начальной раскрутке или выходе из спящего режима). Более того, даже не смотря на то, что литий-ионные батарейки выдержат не одну сотню подзарядок, они живут меньше, чем те, в которых используется никель.
Из-за того, что в литий-ионных элементах используется жидкий электролит (пусть даже отделенный слоем ткани), по форме они почти всегда являются цилиндром. Хотя такая форма ничуть не хуже форм других элементов, с появлением полимеризованных электролитов литий-ионные батареи становятся компактнее.
Литий-полимерные аккумуляторы
Наиболее продвинутой технологией, используемой сегодня при создании аккумуляторов, является литий-полимерная. Уже сейчас среди производителей, как батарей, так и компьютерных устройств наметилась тенденция по постепенному переходу к этому типу элементов. Главным преимуществом литий-полимерных батарей является отсутствие жидкого электролита. Нет, это не значит, что ученые нашли способ обходиться совсем без электролита. Анод отделен от катода полимерной перегородкой, композитным материалом, таким как полиакрилонитрит, который содержит литиевую соль.
Благодаря отсутствию жидких компонентов, литий-полимерные элементы могут принимать практически любую форму, в отличие от цилиндрических батарей других типов. Обычными формами упаковки для них являются плоские пластины или бруски. В таком виде они лучше заполняют пространство батарейного отсека. В результате, при одинаковой удельной плотности, литий-полимерные батареи оптимальной формы могут хранить на 22% больше энергии, чем аналогичные литий-ионные. Это достигается за счет заполнения "мертвых" объемов в углах отсека, которые остались бы неиспользованными в случае применения цилиндрической батареи.
Кроме этих очевидных преимуществ, литий-полимерные элементы являются экологически безопасными и более легкими, за счет отсутствия внешнего металлического корпуса.
Литий-железодисульфидные батареи
В отличие от других литий-содержащих батарей, которые имеют выходное напряжение более 3В, у литий-железодисульфидных оно в два раза меньше. Кроме того, их нельзя перезаряжать. Эта технология представляет собой некий компромисс, на который разработчики пошли, чтобы обеспечить совместимость литиевых источников питания с техникой, разработанной для использования щелочных батареек.
Химический состав батарей был специальным образом изменен. В них литиевый анод отделен от железодисульфидного катода прослойкой электролита. Этот сэндвич упаковывается в герметичный корпус с микроклапанами для вентиляции, как и никель-кадмиевые батареи.
Этот тип элементов был задуман как конкурент щелочным батарейкам. По сравнению с ними литий-железодисульфидные весят на треть меньше, имеют большую емкость, а, кроме того, еще и хранятся дольше. Даже после десяти лет хранения они сохраняют почти весь свой заряд.
Превосходство над конкурентами проявляется наилучшим образом при большой нагрузке. В случае высоких токов нагрузки литий-железодисульфидные элементы могут работать в 2,5 раза дольше, чем алкалиновые батареи того же размера. Если же на выходе не требуется высокая сила тока, то эта разница заметна гораздо меньше. К примеру, один из производителей элементов питания заявил следующие характеристики двух типов своих батарей размера AA: при нагрузке 20 мА щелочная батарейка проработает 122 часа против 135 часов у литий-железодисульфидной. Если же нагрузку увеличить до 1А, то продолжительность работы составит 0,8 и 2,1 часа соответственно. Как говорится, результат налицо.
Такие мощные батареи нет смысла ставить в устройства, потребляющие относительно немного энергии в течение длительного времени. Они были специально созданы для использования в фотоаппаратах, мощных фонарях, а в будильник или радиоприемник лучше поставить щелочные батарейки.
Технологии подзарядки
Современные устройства для подзарядки — это довольно сложные электронные приборы с различными степенями защиты — как вашей, так и ваших батареек. В большинстве случаев для каждого типа элементов существует своё собственное зарядное устройство. При неправильном использовании зарядного устройства можно испортить не только батарейки, но и само устройство, или даже системы, питаемые батарейками.
Существует два режима работы зарядных устройств — с постоянным напряжением и с постоянным током.
Самыми простыми являются устройства с постоянным напряжением. Они всегда производят одно и то же напряжение, и подают ток, зависящий от уровня заряда батарейки (и от других окружающих факторов). По мере зарядки батареи, ее напряжение увеличивается, поэтому уменьшается разница между потенциалами зарядного устройства и батареи. В результате по цепи протекает меньший ток.
Всё что нужно для такого устройства — трансформатор (для уменьшения напряжения зарядки до уровня, требуемого батарейкой) и выпрямитель (для выпрямления переменного тока в постоянный, используемый для заряда батареи). Такими простыми устройствами подзарядки пользуются для заряда автомобильных и корабельных аккумуляторов.
Как правило, подобными же устройствами заряжаются свинцовые батареи для источников бесперебойного питания. Кроме того, устройства с постоянным напряжением используются и для подзарядки литий-ионных элементов. Только там добавлены схемы для защиты батареек и их хозяев.
Второй вид зарядных устройств обеспечивает постоянную силу тока и изменяет напряжение для обеспечения требуемой величины тока. Как только напряжение достигает уровня полного заряда, зарядка прекращается. (Помните, напряжение, создаваемое элементом, падает по мере разряда). Обычно такими устройствами заряжают никель-кадмиевые и никель-металлгидридные элементы.
Кроме нужного уровня напряжения, зарядные устройства должны знать, сколько времени нужно подзаряжать элемент. Батарейку можно испортить, если слишком долго подзаряжать её. В зависимости от вида батареи и от "интеллекта" зарядного устройства для определения времени подзарядки используется несколько технологий.
В самых простых случаях для этого используется напряжение, вырабатываемое батарейкой. Зарядное устройство следит за напряжением батарейки и выключается в тот момент, когда напряжение в батарейке достигает порогового уровня. Но такая технология подходит далеко не для всех элементов. Например, для никель-кадмиевых она не приемлема. В этих элементах кривая разряда близка к прямой, и определить уровень порогового напряжения бывает очень сложно.
Более "изощренные" зарядные устройства определяет время подзарядки по температуре. То есть устройство следит за температурой элемента, и выключается, или уменьшает ток заряда, когда батарея начинает нагреваться (что означает избыточность заряда). Обычно в такие элементы питания встраиваются термометры, которые следят за температурой элемента и передают зарядному устройству соответствующий сигнал.
"Интеллектуальные" устройства используют оба этих метода. Они могут перейти с большого тока заряда на малый, или же могут поддерживать постоянный ток с помощью специальных датчиков напряжения и температуры.
Стандартные зарядные устройства дают меньший ток заряда, чем ток разряда элемента. А зарядные устройства с большим значением тока дают больший ток, чем номинальный ток разряда батарейки. Устройство для непрерывной подзарядки малым током используют настолько небольшой ток, что он разве что не даёт батарейке саморазрядиться (по определению такие устройства и используются для компенсации саморазрядки). Обычно ток заряда в таких устройствах составляет одну двадцатую, или одну тридцатую номинального тока разряда батарейки. Современные устройства зарядки часто могут работать на нескольких значениях токов заряда. Сначала они используют более высокие значения тока и постепенно переключаются на низкие, по мере приближения к полному заряду. Если используется батарейка, выдерживающая подзарядку малым током (никель-кадмиевые, например, не выдерживают), то в конце цикла подзарядки устройство переключится в этот режим. Большинство зарядных устройств для ноутбуков и сотовых телефонов разработаны так, что могут быть постоянно подключены к элементам и не причинять им вреда.
ИСТОЧНИКИ ЭЛЕКТРИЧЕСКОГО ТОКА
Источник тока - это устройство, в котором происходит преобразование какого-либо вида энергии в электрическую энергию.
В любом источнике тока совершается работа по разделению положительно и отрицательно заряженных частиц, которые накапливаются на полюсах источника.
Существуют различные виды источников тока:
Механический источник тока
- механическая энергия преобразуется в электрическую энергию.

К ним относятся : электрофорная машина (диски машины приводятся во вращение в противоположных направлениях. В результате трения щеток о диски на кондукторах машины накапливаются заряды противоположного знака), динамо-машина, генераторы.
Тепловой источник тока
- внутренняя энергия преобразуется в электрическую энергию.

Например, термоэлемент - две проволоки из разных металлов необходимо спаять с одного края, затем нагреть место спая, тогда между другими концами этих проволок появится напряжение.
Применяются в термодатчиках и на геотермальных электростанциях.
Световой источник тока
- энергия света преобразуется в электрическую энергию.

Например, фотоэлемент - при освещении некоторых полупроводников световая энергия превращается в электрическую. Из фотоэлементов составлены солнечные батареи.
Применяются в солнечных батареях, световых датчиках, калькуляторах, видеокамерах.
Химический источник тока
- в результате химических реакций внутренняя энергия преобразуется в электрическую.

Например, гальванический элемент - в цинковый сосуд вставлен угольный стержень. Стержень помещен в полотняный мешочек, наполнен-ный смесью оксида марганца с углем. В элементе используют клейстер из муки на растворе нашатыря. При взаимодействии нашатыря с цинком, цинк приобретает отрицательный заряд, а угольный стержень - положительный заряд. Между заряженным стержнем и цинковым сосудом возникает электрическое поле. В таком источнике тока уголь является положительным электродом, а цинковый сосуд - отрицательным электродом.
Из нескольких гальванических элементов можно составить батарею.

Источники тока на основе гальванических элементов применяются в бытовых автономных электроприборах, источниках бесперебойного питания.
Аккумуляторы - в автомобилях, электромобилях, сотовых телефонах.
УСЛОВНЫЕ ОБОЗНАЧЕНИЯ
Условное обозначение источника тока на электрической схеме

или батареи, состоящей из нескольких источников

КНИЖНАЯ ПОЛКА
Страшный опыт Мушенбрека.
Гальвани - "воскреситель мертвых".
Вольта держит монеты во рту.
ИЗ ИСТОРИИ ИЗОБРЕТЕНИЙ

Луиджи Гальвани ( 1737-1798 ) -
- один из основоположников учения об электричестве, его опыты с «животным» электричеством положили начало новому научному направлению — электрофизиологии. В результате опытов с лягушками Гальвани предположил существование электричества внутри живых организмов.
Курьёзы в науке.
Простудившаяся жена профессора анатомии Болонского университета Луиджи Гальвани требовала заботы и внимания. Врачи прописали ей "укрепительный бульон" из лягушечьих лапок. Приготовляя лягушек для бульона , Гальвани и открыл знаменитое "живое электричество" - электрический ток.
Лейденская банка - первый источник тока.
К середине XVIIIв. в Голландии, в Лейденском университете, ученые под руководством Питера ван Мушенбрука нашли способ накопления электрических зарядов. Таким накопителем электричества была лейденская банка - стеклянный сосуд, стенки которого снаружи и изнутри оклеены свинцовой фольгой. Лейденская банка, подключенная обкладками к электрической машине, могла накапливать и долго сохранять значительное количество электричества.Разряд лейденской банки имел достаточную мощность. Если ее обкладки соединяли отрезком толстой проволоки, то в месте замыкания проскакивала сильная искра, и накопленный электрический заряд мгновенно исчезал. Так стало возможным получить кратковременный электрический ток. Затем банку надо было снова заряжать. Сейчас подобные приборы мы называем электрическими конденсаторами.

Это открытие произвело огромное впечатление на всех людей, даже совершенно далеких от науки. Каждый хотел испытать электрический разряд на себе и увидеть его действие на других. Изобретатели лейденской банки Клейст и Мушенбрек первыми испытали удары зарядов: первый из них после испытания не захотел повторить ощущение даже за персидский престол, второй согласился страдать ради науки.
За лейденские банки взялись и медики. В 1744 году Кратценштейн из Галле разрядом излечил паралич пальца, потом Жильбер вдохнул жизнь в руку столяра, онемевшую от удара молотка. Публика стонала от ожиданий, все хотели бессмертия.
Изобретение гальванического элемента.
Первая электрическая батарея появилась в 1799 году.
Её изобрел итальянский физик Алессандро Вольта (1745 - 1827) — итальянский физик, химик и физиолог, изобретатель источника постоянного электрического тока.

Как-то раз он взял в руки трактат физиолога Луиджи Гальвани «Об электрических силах в мускуле» и понял, что лапка лягушки начинала дергаться только тогда, когда к ней прикасались двумя разными металлами. Гальвани не заметил этого! Вольта решает поставить опыт Гальвани на себе: он взял две монеты из разных металлов и положил их в рот - сверху, на язык, и под его. Потом соединил монеты тонкой проволокой и ощутил вкус подсоленной воды.
Вольта отлично знал – это вкус электричества, и рожден он был металлами.
Его первый источник тока – «вольтов столб» был построен в точном соответствии с его теорией «металлического» электричества. Вольта положил друг на друга попеременно несколько десятков небольших цинковых и серебряных кружочков, проложив меж ними бумагу, смоченную подсоленной водой.
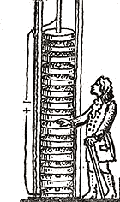
Вольта был и первым испытателем своего прибора. Ученый опускал руку в чашу с водой, к которой подсоединял один из контактов «столба», а к другому контакту прикреплял проволоку, свободным концом которой он прикасался ко лбу, к носу, к веку. Он чувствовал или укол, или резкий удар - и все это аккуратно записывал. Иногда боль становилась невыносимой - и тогда Вольта размыкал свою цепь. Он понял, что его «столб» - это источник постоянного тока.
В 1800 году в журнале Лондонского королевского общества появилось письмо Вольты с описанием «вольтова столб». Так была изобретена первая в мире электрическая батарея. Хотя силы Вольтова столба хватило бы только на то, чтоб зажечь всего лишь одну слабую лампу.
___
А известный русский ученый Петров в 1802 г. изготовил огромную батарею. Она состояла из 4200 медных и цинковых кружков, между каждой парой которых прокладывали картонные кружочки, пропитанные раствором нашатыря. Эта батарея представляла собой 2100 медно-цинковых гальванических элементов, соединенных последовательно. Напряжение на ее зажимах составлялоколо 1650-1700 В.
Это был первый в истории источник постоянного тока сравнительно высокого напряжения.
СДЕЛАЙ САМ !!!!!!!!!!!!!!!!!!!!!!!!
Термоэлемент из электролампы.

Если взять электрическую лампу без стеклянного баллона, ввернуть ее в патрон, укрепленный на подставке и соединить с гальванометром, то при нагревании горящей спичкой места соединения спирали с проволочкой гальванометр покажет наличие тока.
Лейденская банка.

Лейденскую банку (или конденсатор) легко сделать самому. Для этого нужна стеклянная банка.
Стенки банки с внешней стороны и внутренней стороны надо на 2/3 оклеить фольгой (без складок!). Затем взять полиэтиленовую крышку и вставить в середину ее металлический стержень. На верхний конец стержня насадить металлический (или из любого другого материала, но оклеенный фольгой) шарик. Из фольги сделать кисточку и укрепить ее на нижнем конце стержня так, чтобы она при закрытой крышке касалась дна. Закрыть банку крышкой — и прибор готов!
Чтобы зарядить банку, прикоснитесь к шарику, например, наэлектризованной пластмассовой расческой. Чтобы увеличить заряд, проделайте это несколько раз, заново наэлектризовывая расческу.
ИНТЕРЕСНО!
Культуры некоторых организмов способны вырабатывать электрический ток. Если опустить в жидкую культуру кишечной палочки или обычных дрожжей платиновый электрод, а другой — в такую же питательную среду, но без микробов, то возникает разность потенциалов
"ОЖИВЛЯЕМ" БАТАРЕЙКУ!
Не спешите выбрасывать старую батарейку, а попробуйте ее "оживить".
В марганцево-цинковых элементах со временем из диоксида марганца образуется гидроксид марганца, который постепенно покрывает оксид и мешает протеканию химической реакции. Проще всего постучать по батарейке , например, камнем (при сотрясении разрушается образовавшийся поверхностный слой гидроксида).

Или же можно пробить в цинковом стаканчике батарейки отверстие, например, гвоздем и опустить батарейку в воду. Электролит разжижается, и ему легче проникнуть к диоксиду марганца. Таким способом можно увеличить срок службы батарейки почти на треть.
САМОДЕЛЬНЫЕ БАТАРЕЙКИ
Вкусная батарейка.
Фрукты содержат в себе слабые растворы кислот. Если взять лимон или яблоко и воткнуть в него медную проволоку, а на расстоянии от неё кусочек оцинкованного железа, то получится гальванический элемент. Измерьте вольтметром напряжение на своей батарейке, он покажет около 1 В.

А можно убедиться в этом и без вольтметра: прикоснитесь языком одновременно до меди и цинка – язык защиплет!

А можно составить большую батарею, включив элементы последовательно.
Вкусненько, не правда ли ?!
Содовая батарейка.
Надо развести питьевую соду до густоты сметаны, и выложить чайной ложкой на блюдце. На один край содового комка положить медную монету, а на другой конец – кусочек оцинкованного железа. Вы получили гальванический элемент, который дает напряжение около 1В. Его можно измерить с помощью вольтметра, дотронувшись проводами, идущими от вольтметра , одновременно до меди и цинка. Можно составить последовательную цепь из нескольких подобных элементов, напряжение на выходе батареи увеличится!
Солёная батарейка.
Возьми по пять «желтых» и «белых» монет. Разложи их, чередуя между собой. Проложи между ними прокладки из промокашки или газеты, смоченной в крепком растворе поваренной соли. Поставь все это столбиком и сожми. Батарейка готова! Подсоедини вольтметр к первой «желтой» и последней «белой монете. Есть напряжение! А если взять этот столбик из монет большим и указательным пальцами, то можно ощутить легкий удар током!

!!! Не забудь сначала очистить все металлические детали от жира, очень хорошо это получается с помощью порошка «Пемоксоль» (для чистки посуды)!
"СУХОЙ" или "МОКРЫЙ" ?
Действительно ли, так называемый, «сухой элемент» является сухим?
Отнюдь, полость элемента между электродами заполнена веществом в пастообразном состоянии,
и чтобы оно не вытекало, и электроды не смещались, элемент сверху заливают смолой.
Угольно-цинковые гальванические являются самыми распространенными сухими элементами питания. В них электролит находится в пастообразном состоянии.
Угольно-цинковые элементы могут "восстанавливаются" в течение перерыва в работе,
и в результате периодического "отдыха" срок службы элемента продлевается.
НУ и НУ !!!
В далеких деревнях, на хуторах, где нет электричества, можно встретить интересную керосиновую лампу - "электростанцию": она не только светит, но и вырабатывает электрическую энергию. Устройство ее довольно простое. Брусочки из двух различных полупроводниковых материалов смонтированы в виде трубки, которую надевают на укороченное ламповое стекло. Каждая пара различных брусочков спаяна металлической пластинкой, образуя букву П. Когда лампа зажжена, . места спаек нагреваются, стороны брусочков, обращенные внутрь трубки, разогреваются воздухом, поднимающимся от пламени. Противоположные грани остаются холодными. В результате на холодном конце одного брусочка накапливается положительный заряд, а на холодной грани другого брусочка – отрицательный. Соединив грани соответствующих пар проволокой, получим термоэлектрогенератор.
Пока в наше время такие устройства не находят промышленного использования, т.к. коэффициент полезного действия такой термопары низкий - всего 6-8%. Это в несколько раз меньше, чем к. п. д. современных тепловых электростанций.

Ветряная ферма в Альтамонт Пэсс (Калифорния) состоит из 300 ветряных турбин. Чтобы производить столько же электричества, сколько производит атомная электростанция, ветряная ферма должна занимать площадь примерно в 140 квадратных миль.
ПОПРОБУЙ РАСКУСИ !
( или задачки "на 5" )
1. Как изменится действие элемента Вольта, если его медный электрод заменить цинковым или цинковый заменить вторым медным?
2. Если алюминиевый чайник, в который налит раствор поваренной соли, присоединен
медным проводом к одной клемме гальванометра, а ко второй клемме присоединен железный стакан,
то что произойдет при переливании жидкости из чайника в стакан?
Как сделать батарейку ?
Находясь, длительное время на отдаленном садовом участке, может возникнуть проблема отсутствия элементов питания, как- то гальванических батареек или аккумуляторов. Выходом из этого положения может стать изготовление из подручных материалов гальванических элементов.
Соединение сделанных элементов в группы позволяет получить батарею необходимой мощности. Известны различные конструкции самодельных гальванических элементов. Остановимся на изготовлении некоторых конструкций гальванических элементов разной степени сложности.
Простые конструкции гальванических элементов.
Наиболее простая конструкция гальванического элемента представляет собой стеклянную или пластмассовую банку емкостью 0,5 л, с электролитом, в который опущены два электрода: один цинковый, а другой угольный (рис. 1.).

Рис. 2 Самодельная батарейка.
Вначале в банке, предназначенной для гальванического элемента, готовится электролит водный раствор нашатыря. С этой целью в банку наливают воду и постепенно в нее подсыпают нашатырь в виде порошка и тщательно перемешивают раствор. Это делается до полного насыщения раствора нашатырем. Затем берут полиэтиленовую крышку от банки и закрепляют в ней угольный стержень, взятый из негодного гальванического элемента.
На некотором расстоянии от угольного стержня закрепляют полоску цинка размером 2Ох120 мм. Потом берут два одинаковых куска определенной длины многожильного медного провода в изоляции и припаивают: один к угольному электроду, а другой к цинковому электроду элементов.
Провод, идущий от угольногого электрода, это «+», а идущий от цинкового «-». Проверку гальванического элемента проверяют присоединением электрической лампочки для карманного фонаря на 1,5...2,5 В.
При правильно собранном элементе, лампочка должна загореться. У гальванических элементов с раствором нашатыря после длительной работы детали, составляющие элемент, покрываются мелким слоем цинковой соли, которую трудно удалить. Это приводит к уменьшению силы тока такого элемента и, в конце концов, к прекращению eroработы. Для недопущения такой ситуации в раствор нашатыря добавляют сахар рафинад 1...3 части сахара на 10... 15 весовых частей нашатыря в порошке. В результате на цинковом электроде и банке появляются легко удаляемые кристаллы цинкового сахарата.
При отсутствии нашатыря для раствора можно использовать обычную поваренную соль.
Для такого гальванического элемента берут стакан воды и растворяют в нем 2...3 ложки поваренной соли. Из листов оцинкованной кровельной жести и фольгированного текстолита вырезают две полоски площадью 10...20 см 2 .
Далее вырезают кружок из фанеры или пластмассы диаметром несколько больше диаметра стакана и закрепляют на нем вырезанные два электрода на расстоянии примерно 50 мм. Припаивают к каждому электроду по куску медного изолированного провода и опускают электроды в раствор электролита. У элемента медный электрод «+», а цинковый <->.
Один такой элемент дает примерно 0,7...0,8. В при токе 2...3 А. для увеличения напряжения элементы следует соеденить последовательно. Такой гальванический элемент можно подзаряжать, получая от него 1...1,5. В,
Вечный двигатель»... Казалось бы, давно ясно, что сделать его нельзя, но находятся энтузиасты, готовые поспорить с законами физики.

Вот и эта забавная игрушка родилась на свет благодаря неосуществимой мечте школьника далеких 30-х годов (к сожалению, имя и фамилию его мы не знаем). Может, кому-то она покажется примитивной — обыкновенная банка. Но подождем с выводами.
Давайте лучше попробуем игрушку сделать и проведем эксперимент. Возьмите пустую банку из-под кофе или монпансье, шилом проткните в крышке и дне по две дырочки. Пропустите в них гонкую резиновую нить, например авиамодельную. Концы завяжите на крышке, как показано на рисунке. Оттяните и привяжите к резинке ниточку с грузиком — гайку.
Хотим предупредить, длина ниточки должна быть такой, чтобы гайка не касалась стенки.
Теперь плотно закройте крышку и пускайте банку по столу.как думаете? Вы увидите самое интересное. Банка придет в движение. Покатится вперед, остановится, откатится назад.
Потом снова остановится, снова изменит направление движения. Чем не «вечный двигатель»?! Катается и катается себе по столу, и никакой энергетической подпитки не требует. Вот и юный изобретатель 30-х годов так же подумал. А через некоторое время пришло разочарование: банка все же остановилась. Как вы думаете — что ее приводило в движение?


ГЕНЕРАТОР НА КОЛЕНЕ
Специалисты из Питсбургского и Мичиганского университетов разработали устройство, способное вырабатывать электричество во время движения человека.

Получаемой таким образом энергии достаточно для питания портативного GPS-навигатора, сотового телефона или роботизированной конечности. Генератор, крепящийся на колене, работает по той же технологии, что и регенеративное торможение, использующееся
в гибридных автомобилях. Регенеративный тормоз собирает кинетическую энергию, которая обычно расходуется в виде тепла при торможении машины. Созданное устройство работает по этому же принципу - накапливает энергию, когда человек, делая шаг, замедляет движение колена.
ЭЛЕКТРОЭНЕРГИЯ ИЗ ДОЖДЯ
Необычную систему испытывают специалисты французской компании. Сбор энергии дождевых капель позволит получать ток для маломощных устройств в отсутствие солнца (в ненастную погоду фотоэлектрические батареи беспомощны).

Для того, чтобы выяснить, сколько электричества может дать дождь, была построена опытная установка, в которой капли воды падали с высоты на тонкую пластину из поливинилиденфторида. Когда капли ударяли в пластинку PVDF толщиной 25 микрометров, в ней возникали механические колебания, кратковременно генерирующие ток. Выяснилось, что для пьезогенератора наибольшую выгоду представляют крупные капли, падающие сравнительно медленно. Скоростные капли гораздо больше теряют энергию при разбрызгивании от удара, нежели передают её пластине.

Поставляемая установкой средняя мощность зависит от размера капель, частоты их падения и площади собирающего дождь пьезоэлектрика, выяснили исследователи. Они высчитали, что энергия, которую несёт одна капля дождя, колеблется от 2 микроджоулей до 1 миллиджоуля
в зависимости от диаметра капли. Собранная же установка выдавала минимум 1 микроватт постоянной мощности во время искусственного дождя. При этом самые крупные капли давали кратковременную "вспышку" в 12 милливатт. Учёные посчитали запасы энергии в падающих каплях, в дождях, идущих над Францией. Получилось, что один квадратный метр земли может выдать "от дождей" 1 ватт-час электричества в год. На таком "урожае" промышленных станций не построишь. Но капли могут поставлять небольшие порции даровой энергии там, где трудно и дорого менять батарейки: в различных электронных устройствах, работающих во внешнем мире.
ЭЛЕКТРИЧЕСТВО ИЗ ТЕПЛА
Исследователи из Калифорнийского университета в Беркли предложили получать электрический
ток с помощью использования давно известного эффекта, однако совершенно новым способом. В настоящее время существуют различные технологии получения тока из тепла.

Например, с помощью паровых турбин – считается малоэффективным. Можно использовать эффект Зеебека, который реализуется в термопарах. Он заключается в том, что электричество возникает в месте контакта двух металлов, находящихся при разных температурах. Однако термопары не приобретают широкого распространения из-за высокой стоимости требующихся для них металлов и низкой эффективности.
В новых экспериментах используются золотые наноэлектроды, контактирующие с тремя различными видами органических молекул. При изменении температуры в этой системе — как и в обыкновенных термопарах — происходит возникновение тока. Т.е. наблюдается эффект Зеебека в органических молекулах. Учёные утверждают, что могут сделать большое количество таких миниатюрных источников энергии. Материала идёт на них немного, а органические молекулы недороги, и их несложно получить. Устройства на основе нового метода генерирования электричества должны получиться сравнительно недорогими.
БАТАРЕЙКА ИЗ ПЛАСТИКА
Ученые из университета Браун решили отказаться от использования металла в батарейках.
Вместо него они использовали пластик для проведения электрического тока. Группа ученых
начала экспериментировать с веществом под названием полипиррол и другими полимерами.

В своих экспериментах исследователи взяли небольшую полоску пластиковой пленки, покрытой золотом и нанесли на нее слой полипиррола. Потом они взяли другую полоску и покрыли ее другим составом. После чего две части соединили и поместили между ними бумажную мембрану во избежание замыкания.
В результате получилась гибридная батарея, способная хранить энергию в течение долгого времени. Полученная мощность была в 100 раз выше, чем у стандартной алкалайновой батарейки.
http://zhelezyaka.com/
ЭЛЕКТРОЭНЕРГИЯ ИЗ ВОДОРОСЛЕЙ
Японцы готовы запустить в работу первые промышленные электростанции, питаемые морскими водорослями). Японцы расходуют немало сил и средств на очистку побережья от этих зелёных гор и вот теперь решили: хорошо было бы, чтобы добро это зря не пропадало. TokyoGasиNEDOсоздали систему брожения биомассы ("каши" из морских водорослей) с применением микроорганизмов, в результате которого выделяется метан.

Топливо направляется в газовый двигатель, вращающий электрический генератор. На опытной станции TokyoGasтакая установка переваривает тонну водорослей в день, создавая 20 тысяч литров метана. Для повышения мощности генератора к этому газу, полученному от водорослей, примешивают природный газ. Так что генератор установки выдаёт мощность в 10 киловатт — достаточно для питания 20 домов. Пока это электричество используется в офисахTokyoGas, однако, уже в следующем году эта компания намерена расширить эксперимент и начать понемногу промышленную выработку такой энергии на продажу. Для природы новые электростанции будут полезны ещё и тем, что при росте водорослей они поглощают углекислый газ, так что сжигание затем метана не повлияет на баланс парниковых газов.
«Радиоконструктор» на... кухонном столе.
«Радиоконструктор» на... кухонном столе. Вы, наверное, подумали, что это ошибка. Ведь кухня не самое удобное место для занятий техническим творчеством. Этим лучше заниматься н за рабочим столом в своей комнате.
Однако сейчас речь пойдет о забавных самоделках, для изготовления которых понадобятся «детали» из холодильника или с грядки — яблоки, помидоры, лимоны и др.
Основная часть любого радиоприбора, дающая ему «жизнь»,— источник питания. Большинство фруктов содержит в своем составе слабые растворы кислот. Именно поэтому их можно легко превратить в простейший гальванический элемент. Достаточно вставить в помидор, лимон или яблоко два электрода — медный и цинковый с заранее подпаянными проводками, чтобы получить «батарейку».
Медным электродом послужит отрезок провода ПЭЛ диаметром 1,0—2,0 мм, длиной 30—40 мм, который нужно очистить шкуркой от эмалевой изоляции. А для изготовления цинкового электрода подойдет отрезок жести из стаканчика использованной батарейки. Оригинальный источник питания готов.

В его работоспособности вы сможете убедиться, подсоединив к подпаянным проводкам гальванометр (см. рис. 1). При напряжении 0,1 В ток должен быть не менее 10 мкА.
Поэкспериментируйте с различными овощами и фруктами (огурцами, апельсинами) и выберите из них наиболее энергоемкий. Окончив эксперименты, «детали» используйте по их прямому назначению.
Энергии изготовленного вами точника питания достаточно для боты простейшего генератора звукой частоты. Его схема показана рисунке 2.
В качестве трансформатора можно использовать любой согласующий трансформатор от транзиторных приемников с соотношени количества витков между вторичь и первичной обмотками 1:3—1 Транзистор Т — любой маломощт низкочастотный, например МП Громкоговоритель — высокоомный, капсюль ДЭМШ, либо телефон «ТОН» с сопротивлением 2—4 кОм.
Теперь взгляните на рисунок 3. Обыкновенный картофель можно очень просто превратить в простейший детекторный приемник.
Картофелину длиной 8—10 см надо разрезать пополам, вставить между половинками полиэтиленовую пленку скрепить их бечевкой. Медные электроды вставьте согласно рисунку.
Диод Д — любой из серии Д2, телефоны высокоомные — 2—4 кОм. В качестве заземления используй батарею центрального отопления, с хорошей наружной антенной вы сможете принимать мощные мести радиостанции, работающие в диапазоне длинных волн.
ЭЛЕКТРИЧЕСКИЙ МОТОР ЗА 10 СЕКУНД

Приготовь : шуруп, батарейку, кусок провода и магнитик.
Магнит для эксперимента можно вынуть из старых маленьких наушников
или извлечь компактный вариант от магнита для холодильника.
Шуруп нужен с плоской шляпкой. Кусок провода (хватит и 15 см.) зачищаем с обоих концов.

1. Слегка сгибаем провод, а на магнит кладем шуруп (он прилипает к магниту плоскостью шляпки).
2. Шуруп с магнитом подвешиваем к батарейке.
Шуруп намагничивается и прилипает к батарейке острием.

3. Пальцем одной руки прижимаем один конец провода к противоположному торцу батарейки,
второй конец приближаем к головке шурупа с магнитом.

4. Как только контакт касается магнита шуруп начинает быстро вращаться.
Как это работает?
На проводник с током в магнитном поле действует сила, которая приводит его во вращение.
Ротором здесь является шуруп, через него мы пропускаем ток, а магнитное поле обеспечивает магнит.
Все просто. Учитывая малую силу трения (шуруп касается батарейки в одной точке)
ротор-шуруп может раскручиваться до 10 тыс. оборотов в минуту.
Работающее устройство необходимо держать подальше от глаз,
т.к. шуруп с большой скоростью может легко отлететь и попасть в тебя.
ОПЫТ № 1
ЧЕРНИЛА ПОД ДЕЙСТВИЕМ ТОКА
Начнем с очень простого, но тем не менее поучительного опыта. Для него понадобится один-единственный реактив: чернила любого цвета. Правда, придется немного потрудиться над прибором.
Возьмите две металлические полоски длиной 8—10 см и шириной 1—2 см. Они могут быть из железа, меди, алюминия — безразлично, лишь бы свободно проходили в прозрачный сосуд — высокую мензурку или большую пробирку. Перед опытом просверлите в пластинах с одной стороны отверстия для прикрепления проводников. Приготовьте две одинаковые, толщиной буквально в несколько миллиметров, пластмассовые или деревянные прокладки и склейте их с металлическими полосками так, чтобы те, расположившись параллельно, не касались друг друга. Клей годится практически любой — БФ, «Момент» и др.
В мензурку или пробирку налейте воду и капните в нее столько чернил, чтобы раствор не был очень насыщенного цвета (однако он не должен быть и прозрачным). Опустите в него конструкцию из двух полосок, соедините их проводками с двумя батарейками, подключенными последовательно, «плюс» к «минусу». Несколько минут спустя, чернильный раствор между пластинками станет светлеть, а на дне и вверху будут собираться темные частицы.
Почему так происходит?
В состав чернила входят очень мелкие окрашенные частицы, взвешенные в воде. Под действием тока они слипаются и не могут уже плавать в воде, а опускаются на дно под действием силы тяжести. Понятно, что раствор при этом становится все более и более бледным.
Но как же частицы попали наверх? При действии тока на растворы нередко образуются газы. В нашем случае газовые пузырьки подхватывают твердые частицы и уносят их наверх.
ОПЫТ № 2
ПОЛУЧЕНИЕ ГАЗОВ - ВОДОРОДА, КИСЛОРОДА И ХЛОРА - В ДОМАШНИХ УСЛОВИЯХ

В следующем опыте толстостенный чайный стакан, расширяющийся кверху, будет служить электролитической ванной. Приготовьте фанерный кружок такого диаметра, чтобы он прижался к стенке стакана в трех-четырех сантиметрах выше дна. В кружке заранее просверлите два отверстия (или вырежьте в нем по диаметру прорезь), неподалеку шилом проколите два отверстия: через них будут проходить проводки. В большие отверстия или в прорезь вставьте два карандаша длиной 5—6 см, очиненные с одного конца. Карандаши, точнее, их грифели, будут служить электродами. На неочиненных концах карандашей сделайте зарубки, чтобы обнажились грифели, и примотайте к ним оголенные концы проводков. Проводки скрутите и тщательно обмотайте изоляционной лентой, а чтобы изоляция была совсем надежной, лучше всего спрятать проводки в резиновых трубках. Все детали прибора готовы, остается только собрать его, т. е. вставить кружок с электродами внутрь стакана.
Поставьте стакан на тарелку и налейте в него до краев раствор стиральной кальцинированной соды Na2CO3 из расчета 2—3 чайные ложки на стакан воды. Таким же раствором заполните две пробирки. Одну из них закройте большим пальцем, переверните вверх дном и погрузите в стакан так, чтобы в нее не попал ни один пузырек воздуха. Под водой наденьте пробирку на электрод-карандаш. Точно так же поступите со второй пробиркой.
Батарейки — числом не менее трех — нужно соединить последовательно, «плюс» одной к «минусу» другой, а к крайним батарейкам подсоединить проводки от карандашей. Сразу начнется электролиз раствора. Положительно заряженные ионы водорода Н+ направятся к отрицательно заряженному электроду — катоду, присоединят там электрон и превратятся в газ водород. Когда у карандаша, подсоединенного к «минусу», соберется полная пробирка водорода, ее можно вынуть и, не переворачивая, поджечь газ. Он загорится с характерным звуком. У другого электрода, положительного (анода), выделяется кислород. Наполненную им пробирку закройте пальцем под водой, выньте из стакана, переверните и внесите тлеющую лучинку — она загорится.
Итак, из воды Н2О получился и водород Н2, и кислород О2; а для чего же сода? Для ускорения опыта. Чистая вода очень плохо проводит электрический ток, электрохимическая реакция идет в ней слишком медленно.
С тем же прибором можно поставить еще один опыт — электролиз насыщенного раствора поваренной соли NaCl. В этом случае одна пробирка наполнится бесцветным водородом, а другая — желто-зеленым газом. Это хлор, который образуется из поваренной соли. Хлор легко отдает свой заряд и первым выделяется на аноде.
Пробирку с хлором, в которой находится также немного раствора соли, закройте пальцем под водой, переверните и встряхните, не отнимая пальца. В пробирке образуется раствор хлора — хлорная вода. У нее сильные отбеливающие свойства. Например, если добавить хлорную воду к бледно-синему раствору чернил, то он обесцветится.
При электролизе поваренной соли образуется еще одно вещество — едкий натр. Эта щелочь остается в растворе, в чем можно убедиться, капнув в стакан возле отрицательного электрода немного раствора фенолфталеина или самодельного индикатора.
Итак, мы получили в опыте сразу три ценных вещества — водород, хлор и едкий натр. Именно поэтому электролиз поваренной соли так широко используют в промышленности.
ОПЫТ № 3
СВЕРЛИМ МЕТАЛЛЫ... КАРАНДАШОМ
С помощью тока и насыщенного раствора поваренной соли можно проделать еще один занимательный опыт. Займемся сейчас тем, что будем сверлить металл обыкновенным карандашом.
Приготовьте в чайном блюдце насыщенный раствор поваренной соли. Соедините проводком лезвие безопасной бритвы с положительным полюсом батарейки для карманного фонаря (лезвие будет анодом). На заточенном конце карандаша обломайте грифель и примерно на полмиллиметра выковыряйте его иголкой. На 2—3 см выше сделайте ножом зарубку до грифеля и намотайте на нее конец оголенного провода; это место оберните изоляционной лентой, а другой конец провода присоедините к отрицательному полюсу батарейки (карандаш будет катодом).
Положите лезвие в блюдце с раствором и коснитесь карандашом-катодом лезвия. Тотчас вокруг карандаша начнут бурно выделяться пузырьки водорода. А лезвие-анод будет растворяться: атомы железа приобретут заряд, превратятся в ионы и перейдут в раствор. Так минут через 10-15 в лезвии получится сквозное отверстие. Особенно быстро оно образуется, если батарейка новая, а лезвие тонкое (0,08 мм). В алюминиевой же фольге отверстие просверливается буквально за секунды.
Если вы захотите просверлить карандашом отверстие в определенном месте тонкой металлической пластинки, то лучше заранее покрыть обрабатываемую деталь лаком, а там, где вы будете сверлить, лак снять.
Углубление в грифеле понадобилось затем, чтобы грифель не касался металла. Иначе цепь сразу замкнется, ток не пойдет через раствор и никакого электролиза не будет.
Сверлить карандашом можно и без электролитической ванны (в нашем случае, без чайного блюдца). Пластинку-анод положите на доску или на тарелку, капните воды, обмакните карандаш, присоединенный к батарейке, в соль и погрузите заточенный его конец в каплю. Время от времени удаляйте тряпочкой продукты электролиза и наносите новую каплю. Повторяя эту операцию, можно, не прикладывая усилий, просверлить металлическую фольгу или жесть от консервной банки. Так же, между прочим, можно сделать отверстие в сломанном стальном ноже, чтобы приделать к нему новую ручку.
Конечно, для сверления металла толщиной более миллиметра одной батарейки мало — надо включить параллельно несколько батареек или воспользоваться понижающим трансформатором с выпрямителем — например, от детской железной дороги или от прибора для выжигания по дереву. И независимо от источника тока и способа электролиза придется несколько раз менять раствор электролита и хорошо очищать лунку— гвоздем или шилом.


