
Osn-him_term
.pdf- 11 -
Основные понятия химической термодинамики
Изучение предмета химической термодинамики требует определения самых важных еѐ понятий. При этом известные формулировки и выражения,
используемые и в других дисциплинах, в химической термодинамике приобретают изменѐнное или совершенно иное значение.
Объект изучения термодинамики - термодинамическая система.
Термодинамическая система - это объект или сумма объектов,
отделенных от окружающей среды. При этом в термодинамике системы делят на открытые, закрытые и изолированные.
Открытые системы обмениваются со средой и веществом (массой) и
энергией. Например, открытый реакционный сосуд или любой объект живой природы.
Закрытые системы обмениваются со средой только тепловой энергией.
Например, герметизированный сосуд (ампулы с лекарственным препаратом)
или (в быту) пароварка.
Изолированные системы (это отвлечѐнное понятие) не обмениваются со средой ни веществом, ни энергией. Допущение о существовании изолированных систем вводится для облегчения модельных расчетов и на практике не реализуется. Приблизительное понятие об изолированных системах даѐт многослойный термос.
По фазовому состоянию термодинамические системы делят на
гомогенные и гетерогенные. Гомогенные системы по составу и свойствам одинаковы в любой их части (смеси газов, истинные растворы), гетерогенные -
состоят минимум из двух фаз, отделенных поверхностью раздела фаз.
Следует отметить, что системы, состоящие из одного вещества, могут быть как гомогенными однофазными (жидкая вода или водяной пар), так и гетерогенными и многофазными (закрытый сосуд, содержащий лѐд, жидкую воду и водяной пар – трѐхфазная гетерогенная система).
11
- 12 -
Пример с системой из пара, воды и льда показателен ещѐ тем, что фазность этой системы не зависит от числа отдельных кусочков льда – система остаѐтся трѐхфазной при любом их количестве.
Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать или обратимо, или необратимо.
Вынужденный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы.
Изобарный, изохорный и изотермический процессы
Изобарный процесс — термодинамический процесс, происходящий в системе при постоянном давлении. Согласно закону Гей-Люссака, при изобарном процессе в идеальном газе (V/T)=const. Работа, совершаемая газом при расширении или сжатии газа, равна W = P V. Количество теплоты,
получаемое или отдаваемое газом, характеризуется изменением энтальпии: δQ = ΔU + PΔV.
Изохорный процесс — термодинамический процесс, который происходит при постоянном объѐме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде,
который не изменяет своего объѐма. При изохорическом процессе давление идеального газа прямо пропорционально его температуре (закон Шарля).
Изотермический процесс — термодинамический процесс,
происходящий при постоянной температуре. Для осуществления изотермического процесса систему обычно помещают в термостат. Можно осуществить изотермический процесс иначе — с применением источников или
12
- 13 -
стоков тепла, контролируя постоянство температуры с помощью термометров.
К изотермическим процессам относятся, например, кипение жидкости или плавление твѐрдого тела при постоянном давлении. Графиком изотермического процесса является изотерма.
В идеальном газе при изотермическом процессе произведение давления на объѐм постоянно (закон Бойля-Мариотта). Изотермы идеального газа в координатах p,V — гиперболы, расположенные на графике тем выше, чем выше температура, при которой происходит процесс.
Для научного или прикладного описания любой системы необходимы числовые данные («в каждой науке столько истины, сколько в ней математики» написал Эммануил Кант). С этой целью в термодинамике вводится понятие
термодинамических параметров. Дело в том, что система состоит из некоторого (обычно большого) числа молекул или более крупных частиц. Их индивидуальное описание для термодинамики лишено смысла, так как не отражает свойств целой системы. Ситуация осложняется ещѐ тем, что молекулы (частицы) находятся в непрерывном движении, зависящем от
температуры системы.
Большое количество молекул (частиц) в реальных системах (1020-10200)
ограничивает применение классической (ньютоновой) механики, ибо составление, а, главное, решение, такого количества уравнений движения невозможно. Поэтому на практике прибегают к приближенным вычислениям или используют усредненные (статистические) величины, иначе называемые термодинамическими параметрами.
Термодинамические параметры
это физические величины, характеризующие состояние термодинамической системы: температура, давление, объѐм. Различают э к с т е н с и в н ы е параметры, пропорциональные массе системы, и и н т е н с и в н ы е параметры, не зависящие от массы системы. К экстенсивным относятся объѐм,
13
- 14 -
внутренняя энергия, энтропия, энтальпия, энергия Гиббса, энергия Гельмгольца
(свободная энергия), к интенсивным — давление, температура, концентрация.
Не все параметры независимы, так что равновесное состояние системы можно однозначно определить, установив значения ограниченного числа параметров.
Основные параметры:
-масса (от латинского massa ком, кусок)- определяет вес тела. В системе СИ измеряется в кг;
-температура (Т). (от лат. temperatura - соразмерность, нормальное состояние) - один из основных параметров состояния, характеризующий тепловое состояние системы. Иначе – мера нагретости тела или интенсивность хаотического движения частиц, составляющих систему.
ВМеждународной системе единиц (СИ) термодинамическая температура выражается в кельвинах (К). В состав производных величин СИ, имеющих специальное название, входит температура по Цельсию, измеряемая в градусах Цельсия (t °C). На практике часто применяют градусы Цельсия из-за исторической привязки к важным характеристикам воды — температуре таяния льда (0°C) и температуре кипения (100° C). Это удобно, так как большинство климатических процессов, процессов в живой природе и т. д. связаны с этим диапазоном. После введения в 1967 г. нового определения Кельвина,
температура кипения воды перестала играть роль неизменной реперной
(опорной) точки и, как показывают точные измерения, она уже не равна 100°С,
а близка к 99,975 °С.
|
|
|
|
|
|
|
По Кельвину |
|
По Цельсию |
|
|
|
|
|
Абсолютный ноль |
|
0 |
|
−273.15 |
|
|
|
||
Температура замерзания воды |
|
273.15 |
|
0 |
|
|
|
||
Температура человеческого тела |
|
310.0 |
|
36.6 |
|
|
|
||
Температура кипения воды |
|
373.15 |
|
100 |
|
|
|
|
|
Переход от шкалы Цельсия в шкалу Кельвина осуществляется по уравнению Т=t0C+273,15. Например, для температуры тела:
36,6+273,15=309,75К.
14
- 15 -
Понятие температуры вводит и определяет нулевое (общее) начало термодинамики — физический принцип, утверждающий, что вне зависимости от начального состояния изолированной системы, в конце концов в ней установится термодинамическое равновесие, а также, что все части системы при достижении термодинамического равновесия будут иметь одинаковую температуру. Нулевому началу можно придать строгую форму: если система A
находится в термодинамическом равновесии с системой B, а та, в свою очередь, с системой C, то система A находится в равновесии с C. При этом
их температуры равны.
- давление (P) равно силе, действующей на единицу площади поверхности перпендикулярно этой поверхности. Давление является интенсивной физической величиной. Давление в системе СИ измеряется в паскалях (Па); применяются также следующие единицы:
|
|
|
|
|
|
|
|
|
|
|
|
|
Физическая |
|
Миллиметр |
|
|
|
Паскаль |
|
|
ртутного |
|
|
|
|
|
атмосфера |
|
||
|
|
|
(Па) |
|
|
столба |
|
|
|
|
|
(атм) |
|
||
|
|
|
|
|
|
(мм рт.ст.) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
Па |
|
1 Н/м2 |
|
9,86×10−6 |
|
7,5×10−3 |
|
|
|
|
|
|||
1 |
бар |
|
105 |
|
0,98 |
|
750,06 |
|
|
|
|
|
|
||
1 |
атм |
|
101325 |
|
1 атм |
|
760 |
|
|
|
|
|
|
|
|
1 |
мм рт.ст. |
|
133,3 |
|
1,3×10−3 |
|
1 мм рт.ст. |
|
|
|
|
|
|
|
|
- объем (V) — количественная характеристика пространства,
занимаемого телом или веществом. Объѐм тела или вместимость сосуда определяется его формой и линейными размерами. С понятием объѐма тесно связано понятие вместимость, то есть объѐм внутреннего пространства сосуда.
Принятые единицы измерения — в СИ кубический метр (м3). 1 м3 равен 1000
литров.
-количество вещества (N, ν) (характеризует количество
однотипных структурных единиц, содержащихся в веществе,. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы). Единица измерения количества вещества в
15

- 16 -
СИ — моль. Соответствует количеству вещества, в котором содержится NA
частиц. NA это постоянная Авогадро, равная количеству атомов в 12 граммах нуклида углерода 12C. Таким образом, количество частиц в одном моле любого вещества постоянно и равно числу Авогадро NA = 6,022×1023. Иначе говоря,
моль — это количество вещества, масса которого, выраженная в граммах,
численно равняется его молекулярной массе.
- концентрация вещества (С) концентрацией растворѐнного вещества (не раствора!) называют отношение количества растворѐнного вещества или его массы к объѐму раствора (моль/л), то есть это соотношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворѐнного вещества к массе раствора, отношение объѐма растворѐнного вещества к объѐму раствора)
правильно называть долями.
- теплоѐмкость тела (обычно обозначается латинской буквой C, не путать, в зависимости от контекста, с концентрацией) - физическая величина,
определяющая отношение бесконечно малого количества теплоты δQ,
полученного телом, к соответствующему приращению его температуры δT:
Единица измерения теплоѐмкости в системе СИ - [Дж/К].
- удельной теплоѐмкостью называется количество теплоты, которое необходимо для нагревания единичного количества вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В
зависимости от того, к какой количественной единице относится теплоѐмкость,
различают массовую, объѐмную и мольную теплоѐмкость.
- массовая теплоѐмкость (С) — это количество теплоты, которую необходимо подвести к единице массы тела (обычно 1 кг), чтобы нагреть его на
1°С, измеряется в джоулях на килограмм на кельвин (Дж/кг К).
16
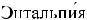
-17 -
-объѐмная теплоѐмкость (С′) — это количество теплоты, которую необходимо подвести к 1 м³ вещества, чтобы нагреть его на 1 °C, измеряется в джоулях на кубический метр на кельвин (Дж/м³·К).
-молярная теплоѐмкость (Сμ) — это количество теплоты, которую необходимо подвести к 1 молю вещества, чтобы нагреть его на 1 °C, измеряется
вджоулях на моль на кельвин (Дж/моль·К).
Функции состояния
Можно сказать, что функция состояния в термодинамике — функция независимых параметров, определяющих равновесное состояние термодинамической системы. Она не зависит от пути (характера процесса),
следуя которому система пришла в рассматриваемое равновесное состояние
(т.е. не зависит от предыстории системы); к функциям состояния, помимо полной энергии системы, относят: энтальпию (H), энтропию (S) и температуру
(T). Термодинамическая работа (W) и количество теплоты (Q) не являются функциями состояния, так как их значение определяется видом процесса, в
результате которого система изменила своѐ состояние.
Энтальпия Н (тепловая функция, теплосодержание) —
термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии (см. Третье начало термодинамики) и числа частиц. Энтальпия равна сумме внутренней и потенциальной энергии:
H = U + pV
Энтальпия системы H — аналогично внутренней энергии и другим термодинамическим потенциалам — имеет вполне определенное значение для каждого состояния, т. е. является функцией состояния. Следовательно, в
процессе изменения состояния
17
- 18 -
H = H2 − H1
Изменение энтальпии не зависит от пути процесса, определяясь только начальным и конечным состоянием системы. Если система каким-либо путѐм возвращается в исходное состояние (круговой процесс), то изменение любого еѐ параметра, являющегося функцией состояния, равно нулю, отсюда ΔH = 0.
Теплота и работа
Количество теплоты (Q) (теплота, Дж) - это энергия, которую получает или теряет тело при теплопередаче. Другими словами это энергия,
передаваемая от одного тела к другому за счет разницы температур этих тел (в
направлении градиента температуры). Понятие количества теплоты определяется первым началом термодинамики, как сумма внутренней энергии тела и произведенной этим телом работы (Q = U + W).
Работа W (Дж) является произведением силы на перемещение, т.е.
мерой энергии, передаваемой от одного тела к другому за счет согласованного
перемещения частиц или тел.
Джоуль (Дж) - единица измерения работы и энергии в системе СИ.
Джоуль равен работе, совершаемой при перемещении точки приложения силы,
равной одному ньютону, на расстояние одного метра в направлении действия силы.
Ни теплота, ни работа не являются функциями состояния, так как
зависят от способа передачи энергии (пути перехода системы из одного состояния в другое).
Уравнение состояния идеального газа
Если известные для идеального газа термодинамические параметры объединить в одно уравнение, то оно будет называться уравнением состояния,
18

- 19 -
устанавливающим зависимость между давлением, молярным объѐмом и абсолютной температурой идеального газа (уравнение Клапейрона):
pVm RT
Так как молярный объем Vm = V/N, где N - количество вещества m/M, то уравнение состояния можно записать иначе (уравнение Менделеева— Клапейрона):
pV Mm RT
Так как для реальных систем такое уравнение составить невозможно,
вводят понятие функций состояния - функций, зависящих от нескольких термодинамических параметров, которые однозначно определяют состояние термодинамической системы. Значение термодинамической функции состояния зависит только от состояния термодинамической системы и не зависит от того, как система пришла в это состояние. Подробнее о функциях состояния см. выше.
Полная энергия системы, внутренняя энергия
В аппарат термодинамики введено большое количество величин,
обладающих значением функций состояния, главная из которых полная энергия системы Е (Дж) (сумма кинетической энергии Екин движущейся системы, потенциальной энергии Епот,, связанной с воздействием на систему внешних сил (гравитационных, электростатических или иных) и внутренней энергии системы U, т.е.
E = Eкин.+ Eпот+ U
Если система находится в состоянии покоя и действие внешних сил мало
- полная энергия системы равна ее внутренней энергии (E=U).
19

- 20 -
Точно определить или вычислить величину U трудно, потому что она складывается из большого числа взаимодействий.
Внутреннюю энергию определяют кинетическая и потенциальная энергия молекул, энергия взаимодействия атомов в молекулах, энергия взаимодействия электронов и протонов в атомах, из которых состоят молекулы, энергия взаимодействия частиц, составляющих атомное ядро и т.д.
Поскольку в термодинамике абсолютное значение внутренней энергии определить нельзя, определяют только изменение внутренней энергии U,
происходящее при переходе системы из одного состояния в другое.
Первое начало термодинамики1
Первое начало термодинамики было сформулировано в середине XIX
века в результате работ немецкого учѐного Ю.Р. Майера, английского физика Дж.П. Джоуля и немецкого физика Г. Гельмгольца. Согласно первому началу термодинамики, термодинамическая система может совершать работу только за счѐт своей внутренней энергии или каких-либо внешних источников энергии.
Эти изменения происходят в соответствии с законом сохранения энергии2, который для термодинамических систем формулируется, как первое начало термодинамики:
Переданное системе количество теплоты (Q) изменяет внутреннюю энергию ( U) и приводит к совершению системой работы (W) против внешних сил.
Q = U + W
Т.о. общий запас внутренней энергии изолированной системы остаѐтся
постоянным (для изолированной системы).
1нулевое начало термодинамики - см. определение температуры на стр.10.
2В изолированной системе энергия может только превращаться из одной формы в
другую, но еѐ количество остаѐтся постоянным.
20
