
химия
.docx1) Оксиды представляют собой соединения элементов с кислородом. Оксиды подразделяют на солеобразующие и несолеобразующие. Солеобразующие оксиды делят на основные (образуют соли с кислотами), кислотные (образуют соли с основаниями) и амфотерные (образуют соли как с кислотами, так и с основаниями
Основания (осно́вные идрокси́ды) — сложные вещества, которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH). В водном растворе диссоциируют с образованием катионов и анионов ОН−. Название основания обычно состоит из двух слов: «гидроксид металла/аммония». Хорошо растворимые в воде основания называются щелочами.
Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
Со́ли — класс химических соединений, к которому относятся вещества, состоящие из катионов металла (или катионов аммония ; известны соли фосфония или гидроксония ) и анионов кислотного остатка.
.Химические свойства кислот: Диссоциация, Взаимодействие с индикаторами, Разложение, Взаимодействие с основными и амфотерными оксидами, Взаимодействие с металлами, Взаимодействие с солями.
Химические свойства основных оксидов: основные оксиды взаимодействуют с кислотами, получаются соль и вода, оксиды активных металлов взаимодействуют с водой с образованием щелочи. Кислотных: Кислотные оксиды взаимодействуют с растворимыми основаниями, получаются соль и вода,Большинство кислотных оксидов взаимодействуют с водой с образованием кислоты,
сновные и кислотные оксиды взаимодействуют между собой с образованием соли.
Хмические свойства основаий: Диссоциация, Взаимодействие с индикаторами, Разложение с образованием оксида и воды, Взаимодействие щелочей с некоторыми металлами, Взаимодействие щелочей с неметаллами, Взаимодействие щелочей с кислотными и амфотерными оксидами, Взаимодействие оснований с кислотами, Взаимодействие щелочей с амфотерными гидроксидами, Взаимодействие щелочей с солями.
Свойства солей: Диссоциация, Взаимодействие с индикаторами, Разложение при нагревании, Взаимодействие с кислотами, Взаимодействие со щелочами, Взаимодействие с металлами.
Относительная атомная масса элемента - это величина равная отношению средней массы изотопного состава элемена к 1/12 массы атома углерода(с12)
Амфотерность (от греч. amphoteros — оба) — способность некоторых соединений проявлять, в зависимости от условий, как кислотные, так и основные свойства. Напр., вода образует при диссоциации ионы H+ и ОН— (Н2О ↔ H+ + ОH—). Амфотерны гидроокиси Al(OH)3, Cr(ОН)3, Zn(ОН)2 и др.
Закона Авогадро-в равных объёмах различных газов при одиаковых условиях(температура и давление)
содержится одинаковое число молекул.
Закон понятия об эквиваленте,эквивалентом вещества называется такое весовое количество его,которое соединяется с 1,008 весовыми частями водорода или 1,008 весовыми частями кислорода.
Математическая
запись закона эквивалента:
Химические элементы взаимодействуют между собой в кол-во пропорциоальных их эквиваленту.
2) Закон сохранения материи- общее количество материи во Вселенной никогда не изменяется: материя не исчезает бесследно и не появляется из "ниоткуда", а лишь переходит из одного состояния в другое.
Математическая
запись закона эквивалента: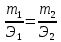
Химические элементы взаимодействуют между собой в кол-во пропорциоальных их эквиваленту.
Закон кратных отношений гласит — Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Закон Бойля-Мариота-при постоянной температуре и массе идеального газа произведение его давления и объёма постоянно. pV = const.
Закон Гей-Люссака-при постоянном давлении изменение объема газа прямопропорционально температуре. V/Т=const
Закон
менделеева-клапейрона-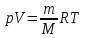
3)Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
Правило
Вант-Гоффа-при повышении температуры
реагирующей смеси на каждые 10 градусов
,скорость реакции увеличивается в 2-4
раза.

 -степеь
-степеь
 ,
, -скорость
при тмепературе
-скорость
при тмепературе
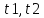
 -температурный
коэфициент
-температурный
коэфициент
Гомогенные реакции протекают в пределах одной фазы, например, в смеси газов или в растворе.
Гетерогенные реакции протекают на границе раздела фаз, например, твердой и жидкой, твердой и газообразной
Принцип Ле-Шателье: если на физико-химическую систему оказать какое либо воздействие из вне, то система будет стремиться в том направлении, в котором ослабляется определнное взаимодействие.
Катализа́тор — химическое вещество, ускоряющее или замедляющая реакцию, но не входящее в состав продуктов реакции. Количество катализатора, в отличие от других реагентов, после реакции не изменяется. Важно понимать, что катализатор участвует в реакции. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Ингибитор)— вещество, замедляющее или предотвращающее течение какой-либо химической реакции: коррозии металла, старения полимеров, окисления топлива и смазочных масел, пищевых жиров и др.
4)термодинамические функции — характеристическая функция в термодинамике, убыль которых в равновесных процессах, протекающих при постоянстве значений соответствующих независимых параметров, равна полезной внешней работе. Выделяют следующие термодинамические потенциалы: Внутренняя энергия-Определяется в соответствии с первым началом термодинамики, как разность между количеством теплоты, сообщенным системе, и работой, совершенной системой над внешними телами. U=Q-W
Энтальпия определяется следующим образом-
H=U+PV , где P — давление, а V — объем.
Энтальпия системы– это однозначная функция H состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением
Основные законы термодинамики:
1-й закон - один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Формулировка: Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
Второе начало (закон) термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Второе начало термодинамики гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не должна равняться 0.
Существуют несколько эквивалентных формулировок второго(закон) термодинамики:
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему» (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Третьий закон термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю. Является одним из постулатов термодинамики, принимаемым на основе обобщения значительного количества экспериментальных данных.
5)Двойстыенность поведения микрочастиц заключается в следующем, при одних физических условиях микрочастицы ведут себя ,как вещество, то есть имеют массу, чоткую территорию, импульс.при других условиях они проявляют волновые свойства .
Уравнение
Планка и Эйнштейна: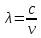 ,
,

Ква́нтовая меха́ника — раздел теоретической физики, описывающий квантовые системы и законы их движения. Основными понятиями квантовой кинематики являются понятия наблюдаемой и состояния. Основные уравнения квантовой динамики — уравнение Шрёдингера, уравнение фон Неймана, уравнение Линдблада, уравнение Гейзенберга и уравнение Паули
уравнения
де Бройля-
![]()
Уравне́ние Шрёдингера — уравнение, описывающее изменение в пространстве и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах.
![]()
Принцип Гейзенберга (в квантовой механике — фундаментальное неравенство (соотношение неопределённостей), устанавливающее предел точности одновременного определения пары характеризующих квантовую систему физических наблюдаемых (см. физическая величина), описываемых некоммутирующими операторами (например, координаты и импульса, тока и напряжения, электрического и магнитного поля)
Волнова́я фу́нкция— комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы. Является коэффициентом разложения вектора состояния по базису (обычно координатному):
6) квантовые числа и их физический смысл:1)n-главое квантовое число определяет какой энергией обладает главный электрон на данном энергитическом уровне.Наимеьшей энергией обладает электрон при n=1.с увеличением n энергия возрастает.
2)орбитальное квантовое число или побочное определяем какой энергией обладает электрон, на данном энергитическом подуровне.
3)магнитное квантовое число определяет момент количества электрона и влияние внешнего магнитного поля на данный электрон.
Тип орбитали -- это, скорее всего, орбитальное квантовое число L. Типов орбиталей бесконечно-много. Но на каждом уровне N (главное квантовое число) могут быть использованы только типы 0, 1, ..N-1 (то есть, столько типов, каков номер уровня). Количество орбиталей данного типа -- это, скорее всего, количество возможных чисел M. М меняется от -L до +L. То есть, орбиталей L=0 на данном уровне может быть только одна, орбиталей L=1 три (M=-1,0,+1) и так далее. На каждой орбитали помещается только 2 электрона (различающихся спиновым квантовым числом) (если считать, что орбитали с одним L и с разными M -- это разные орбитали).
В природе действительно нет в нормальном состоянии атомов с орбиталями больше L=3 (f), но квантовая механика их не запрещает
Принципы заполнения орбиталей
1. Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы, т.е. на каждой орбитали может находиться не более двух электронов (c противоположными спинами)
2.Правило Клечковского (принцип наименьшей энергии). В основном состоянии каждый электрон располагается так, чтобы его энергия была минимальной. Чем меньше сумма (n + l), тем меньше энергия орбитали. При заданном значении (n + l) наименьшую энергию имеет орбиталь с меньшим n. Энергия орбиталей возрастает в ряду:
1S < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d » 4f < 6p < 7s.
3. Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня.
Выраженый орбитлей электроны заполняют таким образом,чтобы сохранялось максимальное число электронов с паралельными спинами т.е сначала заполняются свободные энергитические ячейки и после его полного заполнения возможо спаривание электрона т.е появление электронов с антипаралельными спинами.
7) Периодический закон — фундаментальный закон природы, открытый Д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс. Определение: свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.Структура таблицы:переодическая таблица состоит из 8 групп, подразделение происходит по расположению валентных электроов.Каждая группа делится а подгруппы а и в.У элементов подгруппы а валентые электроны расположены на внешнем энергитическом уровне.У элементов подгруппы в валентость электрона располлагается на внешнем и предвнешнем уровне.
Энергитические характеристики атомов
1) Энергия ионизации —это та минимальная энергия,которую необходимо затратить для отрыва электрона от невозбужденного атома.Чем больше энергия ионизации тем меньше востановительной способностью обладает элемент.
2) Эне́ргией сродства́ –это та энергия которая выделяется при присоединеии электрона к электронейтральному атому для превращения его в электроотрицательный ион
Под радиусом атома понимается расстояние между ядром данного атома и его самой дальней электронной орбитой. На сегодняшний день общепринятой единицей измерения атомного радиуса является пикометр(пм). Определить радиус атома очень легко.
Ио́нный ра́диус — характерный размер шарообразных ионов, применяемый для вычисления межатомных расстояний в ионных соединениях. Понятие ионный радиус основано на предположении, что размеры ионов не зависят от состава молекул, в которые они входят. На него влияет количество электронных оболочек и плотность упаковки атомов и ионов в кристаллической решётке.
8)Химическая свзяь образуется за счёт валентных электронов но осуществляется по разному.Различают 3 основных типа химических связей:ковалентную,ионую,металическую
Строение молекулы:молекула представляет собой электрический диполь с зарядом – q и атома и cCl +q у атома Н.Заряд q в молекуле называется эффективным зарядом .
Спиновая теория: Согласно спиновой теории, валентность элемента определяется числом неспаренных электронов как в нормальном, так и возбужденном состоянии. Способ образования ковалентной связи, когда каждый из взаимодействующих атомов отдает по одному электрону для образования общей электронной пары, называется обменным. Однако нередко валентность элемента превосходит число неспаренных электронов у его атомов в основном состоянии. Происходит это потому, что помимо обменного механизма образования ковалентной связи существует и другой, заключающийся в том, что один атом отдает в общее пользование неподеленную пару электронов.
Основные положения теории..:Ковалентная связь образуют два электрона с антипараллельными спинами,принадлежащие 2-м различным взаимодействующим атомов.Связь ковалентная тем прочнее чем большей степени перекрываются электронные облака.
Характеристики связи:длина связи-это растояние между ядрами атомов образующих связь чем больше длинна связи тем прочнее возникающая связь.Энергия связи-это прочность химической связи т.е энергия необходимая для разрыва связи.
Донорно-акцентная связь-этопредставлянт собой свободную орбиталь и называется акцектором.
Водородная связь-связь осуществляемая атомами водорода,ковалентно соединеная в молекуле атомами электроотрицательного элемента
9)Гибридизация-существуют атомы в образовании которых участвуют s и р электроны не в чистом состояии а в некотором смещанном или гибридном состоянии q.
Типы гибридизации.
1)SP гибридизация- характерна когда образование связи у элемента участвует 1s и 1p электрон.
2)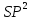 гибридные
облака располагаются под углом 120.
гибридные
облака располагаются под углом 120.
3) -осуществляется
за счёт смещения одного и 3р электронных
облаков.
-осуществляется
за счёт смещения одного и 3р электронных
облаков.
Донорно-акцентная связь-этопредставлянт собой свободную орбиталь и называется акцектором.
Водородная связь-связь осуществляемая атомами водорода,ковалентно соединеная в молекуле атомами электроотрицательного элемента
Ионная связь-это предельный случай ковалентной связи, когда электронная пара полностью принадлежит одному электрону.
10)Степеью окислеия называтся условный заряд смещанный от данного атома электрона к другим атомам.
Потенциал возникающий на границе энертного электрона,содержащий окисленную и восстановительную формулу соединеия называется окислительно-восстановительным потенциалом.Если активно окисленый и востановленый в соединение равны единице ,то возникающую разность потенциалов на границе электрон-раствор называют стандартным окислительно-восстановительным потенциалом-чем больше стандартный окис-вост потециал,тем меньшеокислитель.
Математический метод на основе материального баланса -Положение атомно-молекулярного учения о том, что атомы при химических реакциях не изменяются, не совсем верное. Атомы вследствие химических реакций изменяют свое строение: превращаются в ионы или видоизменяют электронное строение в процессе образования новых молекул: количество вещества каждого элемента до реакции равняется количеству вещества каждого элемента после реакции;общее количество вещества всех элементов до реакции равняется общему количеству вещества всех элементов после реакции.
Метод электронного баланса уравнивания окислительно-восстановительных реакций заключается в выполнении следующего правила: число электронов, отданных всеми частицами восстановителей, всегда равно числу электронов, присоединенных всеми частицами окислителей в данной реакции.
Магнитные материалы— материалы, вступающие во взаимодействие с магнитным полем, выражающееся в его изменении, а также в других физических явлениях — изменение физических размеров, температуры, проводимости, возникновению электрического потенциала и т. д
Легкоплавкие материалы - материалы, размягчающиеся или разрушающиеся при температуре ниже 1350 град.C: керамический кирпич и др.
Тугоплавкие материалы- материалы размягчаются при температуре выше 1350 С. Большинство тугоплавких материалов являются хрупкими.
11) Механизм возникновения скачка потенциала на границе раздела металл - раствор до настоящего времени является еще недостаточно вы-ясненным. Второй принцип правильно отражает механизм возникновения равновесного скачка потенциала на границе металл - раствор, хотя обмен ионами не исчерпывает всех возможных причин, ответственных за образование скачка потенциала на этой границе. Если между электродом и раствором существует равновесие, то величина электродного потенциала будет мерой изменения свободной энергии F ( или термодинамического потенциала G), которая отвечает электродной реакции. При заданной электродной реакции электродный потенциал должен быть определенной и постоянной величиной.
Гальвани́ческий элеме́нт — химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Сейчас широко распространены следующие гальванические элементы:
Поляризация электродов, как правило, не прекращает коррозионный процесс, а только его замедляет. Это объясняется процессами деполяризации электродов. Если деполяризация катода осуществляется растворенным в электролите кислородом по реакции
Поляризация электродов — это результат отставания электродных процессов от процесса перетекания электронов от анода к катоду. Анодная поляризация, т. е. замедленность анодного
Виды поляризации:
* Электронная — смещение электронных оболочек атомов под действием внешнего электрического поля. Самая быстрая поляризация (до 10−15 с). Не связана с потерями.
* Ионная — смещение узлов кристаллической структуры под действием внешнего электрического поля, причем смещение на величину, меньшую, чем величина постоянной решетки. Время протекания 10−13 с, без потерь.
* Дипольная (Ориентационная) — протекает с потерями на преодоление сил связи и внутреннего трения. Связана с ориентацией диполей во внешнем электрическом поле.
* Электронно-релаксационная — ориентация дефектных электронов во внешнем электрическом поле.
* Ионно-релаксационная — смещение ионов, слабо закрепленных в узлах кристаллической структуры, либо находящихся в междуузлие.
* Структурная — ориентация примесей и неоднородных макроскопических включений в диэлектрике. Самый медленный тип.
* Самопроизвольная (спонтанная) — благодаря наличию этого типа поляризации в диэлектрике проявляются нелинейность свойств, то есть явление гистерезиса. Отличается очень высокими значениями диэлектрической проницаемости (от 900 до 7500 у некоторых видов конденсаторной керамики). Введение спонтанной поляризации, как правило, увеличивет тангенс угла потерь материала (до 10−2)
* Резонансная — ориентация частиц, собственные частоты которых совпадают с частотами внешнего электрического поля.
* Миграционная поляризация обусловлена наличием в материале слоев с различной проводимостью, образованию объемных зарядов, особенно при высоких градиентах напряжения, имеет большие потери и является поляризацией замедленного действия
Процессы на электродах при зарядке и разрядке вщелочных...см тетрадь (черный почерк)
Поляризация света — совокупность явлений, в которых проявляются свойства поперечных электромагнитных волн, волн видимой части света. Волна называется поляризованной, если в ней существует выделенное направление колебаний. Различают линейную (плоскую), круглую (циркулярную, электрическую).
Материалы высокой проводимости: Серебро, Медь, Бронзы, Алюминий, Сталь.
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
12)При электролизе водных растворов электрический ток на электроде подаётся из внешней цепи на электродах анод положительный ,при электролизе катод восстаовитель отдаёт электроы, а анод окислитель принимает электроны у атомов, восстановительное и окислительное действие электрического тока ,действия химических восстановителей и окислителей.Нахарактер и течение электронных процессов большое влияние оказывает состав электролита, растворитель материал электрода или же электролиз.
Законы Фарадея:1)Масса вещества выделяющегося на электроде при электролизе прямопропорционально количеству электричества прощедщего через раствор электролитп. M=K+Q.
2)Одинаковое количество электричества выделяет при электролизе на электродах эквивалентные массы различных веществ.Для выделения на электроде одного грамма эквивалента любого вещества необходимо затратить одно и тоже количество электричества,называемое постоянным Фарадея.
