
- •Министерство сельского хозяйства российской федерации
- •Введение
- •Лабораторная работа № 1 Изучение электростатического поля методом моделирования
- •1 Общие сведения
- •2 Описание лабораторной установки
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •Лабораторная работа № 2
- •2 Описание лабораторной установки
- •3 Порядок выполнения работы и требования к оформлению результатов
- •3.1 Задание 1 Фокусировка электронного луча и регулирование его положения на экране
- •3.2 Задание 2 Определение чувствительности осциллографа и чувствительности электроннолучевой трубки
- •3.3 Задание 3 Наблюдение формы различных сигналов и измерение входного напряжения
- •3.4 Задание 4 Получение фигур Лиссажу и определение частоты исследуемого сигнала
- •4 Контрольные вопросы
- •2 Описание лабораторной установки
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •2 Описание лабораторной установки и вывод расчетной формулы
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •2 Описание лабораторной установки
- •3 Порядок выполнения работы
- •4 Контрольные вопросы
- •Лабораторная работа № 6 Изучение принципа работы электронных ламп и определение характеристик вакуумного триода
- •1 Общие сведения
- •2 Описание лабораторной установки и вывод расчетной формулы
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •Лабораторная работа № 7 Изучение электропроводности жидкостей и определение электрохимического эквивалента меди
- •1 Общие сведения
- •2 Описание лабораторной установки
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •Библиографический список
2 Описание лабораторной установки
В комплект лабораторной установки входят: ванна с водным раствором медного купороса, два электрода, амперметр и источник постоянного тока, проводники, весы, сушильный шкаф, секундомер.
Требуется соблюдать технику безопасности – ставить и вынимать электроды только при выключенном питании, не прикасаться руками к раствору электролита во время прохождения тока. Стол должен быть сухим.
На рисунке 3 изображена электрическая схема лабораторной установки. В ванну 1 с водным раствором медного купороса (CuSO4 ) опущены электроды: катод – 2 и анод – 3, с помощью проводников подсоединен амперметр – PA и источник постоянного тока – БП.

Рисунок 3 Схема электрической цепи: 1 – электролитическая ванна
с раствором медного купороса; 2 – катод; 3 – анод; PA – амперметр;
БП – источник постоянного тока
3 Порядок выполнения работы и требования к оформлению результатов
3.1 При подготовке к лабораторной работе необходимо составить конспект по одному из учебников, указанных в библиографическом списке:
- для инженерных специальностей: С. 257-258 /2/, С. 252-255 /3/;
- для неинженерных специальностей: С. 331-335 /5/.
3.2 На весах определить
массу электрода
![]() с точностью до 0,01г.
Записать значение измеренной массы в
таблицу 2.
с точностью до 0,01г.
Записать значение измеренной массы в
таблицу 2.
3.3 Собрать электрическую цепь согласно схеме на рисунке 3 и предъявить цепь преподавателю на проверку.
3.4 Включить источник питания.
3.5 Установить регулятором силу тока 2 А.
3.6 В течение 10 минут пропускать ток через электролит.
3.7 Выключить источник питания.
3.8 Осторожно достать электрод со слоем меди и положить в сушильный шкаф для просушки.
3.9 На весах определить
массу
![]() с точностью до 0,01г.
Записать полученную массу в таблицу 2.
с точностью до 0,01г.
Записать полученную массу в таблицу 2.
3.10 Найти массу
выделившейся меди
![]() .
.
3.11 После взвешивания установить электрод на место и повторить задание пунктов 3.2, 3.4-3.7 еще 2 раза. Заполнить таблицы 2 и 3.
3.12 Вычислить по полученным массам значение электрохимического эквивалента формула (8):
![]() .
(9)
.
(9)
3.13 Найти среднее
арифметическое значение
![]() .
.
3.14 Определить
отдельные погрешности
![]() по формуле
по формуле
![]() .
(10)
.
(10)
3.15 Определить
среднюю квадратическую погрешность
![]() по формуле:
по формуле:
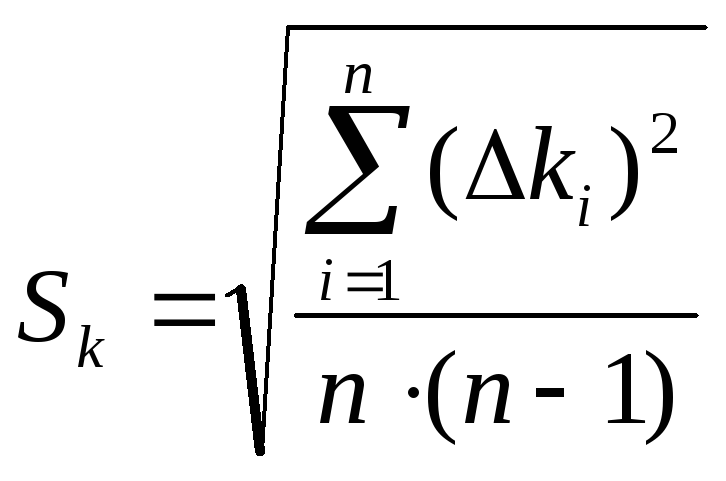 ,
(11)
,
(11)
где n число измерений.
3.16 Определить
экспериментальную случайную погрешность
![]() по формуле:
по формуле:
![]() ,
(12)
,
(12)
где
![]() - коэффициент Стьюдента обеспечивающий
для 3 измерений 95%-ную доверительную
вероятность.
- коэффициент Стьюдента обеспечивающий
для 3 измерений 95%-ную доверительную
вероятность.
3.17 Рассчитать
инструментальную погрешность
![]() ,
учитывая погрешности приборов
,
учитывая погрешности приборов![]() г,
г,
![]() ,
,![]() с:
с:
![]() ,
(13)
,
(13)
где
![]() -
рассчитывается через класс точности
амперметра
-
рассчитывается через класс точности
амперметра![]() :
:
![]() .
(14)
.
(14)
3.18 Из двух
погрешностей
![]() и
и![]() выбрать наибольшую для конечной записи
выбрать наибольшую для конечной записи
![]() .
(15)
.
(15)
3.19 Сравнить полученное значение k со справочным для меди (таблица 1).
3.20 Сделать выводы.
Таблица 2 Определение
электрохимического эквивалента меди![]()
|
№ опыта |
Обозначения физических величин | ||||||
|
i |
|
|
|
I, A |
t, с |
|
кг/Кл |
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
Таблица 3 Определение экспериментальной погрешности
|
№ опыта |
Обозначения физических величин | |||
|
i |
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
| ||
|
3 |
|
| ||
