
- •Основные понятия химии. Классы неорганических соединений
- •Cодержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные положения атомно-молекулярной теории
- •Количественно масса 1 моль вещества – масса вещества в граммах, численно равная его атомной или молекулярной массе.
- •1.2 Химический эквивалент
- •1Моль Са(он)2 2 эквивалента
- •1/2 Са(он)2 1 эквивалент
- •1). Определить степень окисления элемента образующего оксид.
- •2). По формуле оксида определить число атомов элемента образующего оксид и число атомов кислорода.
- •3). Определить молярную массу оксида:
- •5). Для других сложных веществ:
- •1.3 Степень окисления
- •Номер группы, в которой находится элемент, минус 8.
- •Примеры: а) Вычислить степень окисления хрома в хромовой кислоте h2CrO4 .
- •1.4 Химические реакции. Уравнения химических реакций
- •Классификация химических реакций
- •Вопросы и задачи для самоконтроля
- •1.5 Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
- •2 Классы неорганических соединений
- •Простые вещества;
- •2.1 Оксиды
- •2.1.1 Основные оксиды
- •Химические свойства основных оксидов
- •2.1.2 Кислотные оксиды
- •Химические свойства кислотных оксидов
- •2.1.3 Амфотерные оксиды
- •Химические свойства амфотерных оксидов
- •2.2 Гидроксиды
- •2.2.1 Основания
- •Номенклатура (название) оснований:
- •Получение оснований
- •Получение труднорастворимых оснований
- •Химические свойства оснований
- •2.2.2 Кислородные кислоты
- •Номенклатура (название) кислот
- •Получение кислот
- •Химические свойства кислот
- •2.2.3 Амфотерные гидроксиды
- •Получение амфотерных гидроксидов
- •Химические свойства амфотерных гидроксидов
- •2.3 Соли
- •2.3.1 Средние (или нормальные) соли
- •Номенклатура (название) средних солей
- •Способы получения средних солей
- •Химические свойства средних солей
- •2.3.2 Кислые соли
- •Номенклатура (название) кислых солей
- •Способы получения кислых солей
- •Химические свойства кислых солей
- •2.3.3 Основные соли
- •Номенклатура (название) основных солей
- •Способы получения основных солей
- •Химические свойства основных солей
- •2.3.4 Двойные соли
- •2.3.5 Смешанные соли
- •2.3.6 Комплексные соли
- •Рассмотрим состав комплексных солей:
- •Названия электронейтральных комплексов:
- •2.4 Бинарные соединения
- •2.5 Генетическая связь между классами неорганических соединений
- •2.6 Лабораторные работы
- •2.6.1 Техника безопасности и основные требования при работе в химической лаборатории
- •При возникновении несчастных случаев сразу же поставить в известность преподавателя или лаборанта обслуживающего лабораторную работу.
- •2.6.2 Вопросы для рассмотрения основных понятий и определений
- •2.6.3 Получение оксидов и определение их свойств
- •2.6.4 Получение амфотерных гидроксидов и определение их свойств
- •2.6.5 Получение солей и их свойства
- •2.6.6 Вопросы и задачи для практического занятия
- •2.7 Вопросы и задачи для самостоятельной работы
- •2.8 Входной тестовый контроль Вариант № 1
- •Выберите правильный ответ:
- •1) Основным оксидам; 3) амфотерным оксидам;
- •2) Кислотным оксидам; 4) безразличным оксидам.
- •Вариант № 2
- •Выберите правильный ответ:
- •Вариант № 3
- •Выберите правильный ответ:
- •2) Кислотные свойства; 4) свойства сильных электролитов.
- •Вариант № 4
- •Выберите правильный ответ:
- •2) Кислотные свойства; 4) свойства безразличного оксида.
- •2.9 Задания для контрольной работы
- •1. Назовите перечисленные ниже соединения Вариант:
- •2. Составьте молекулярные и ионные уравнения, характеризующие способы получения и свойства соединений Вариант:
- •Вариант:
- •4. Составьте уравнения всех возможных реакций, протекающих между веществами Вариант:
- •5. Осуществите следующие превращения Вариант:
- •Темы реферативных работ
- •Рекомендуемая литература Основная литература:
- •Дополнительная литература:
- •Список использованных источников
- •Периодическая система химических элементов д.И. Менделеева
- •Ряд стандартных электродных потенциалов (ряд активности металлов)
- •Меры первой помощи при возможных несчастных случаях при выполнении лабораторной работы
- •Термины и определения в химии (номенклатура неорганических соединений июпак) (глоссарий)
- •Основные понятия химии. Классы неорганических соединений
- •426069, Г. Ижевск, ул. Студенческая, 11
Периодическая система химических элементов д.И. Менделеева

ПРИЛОЖЕНИЕ Б
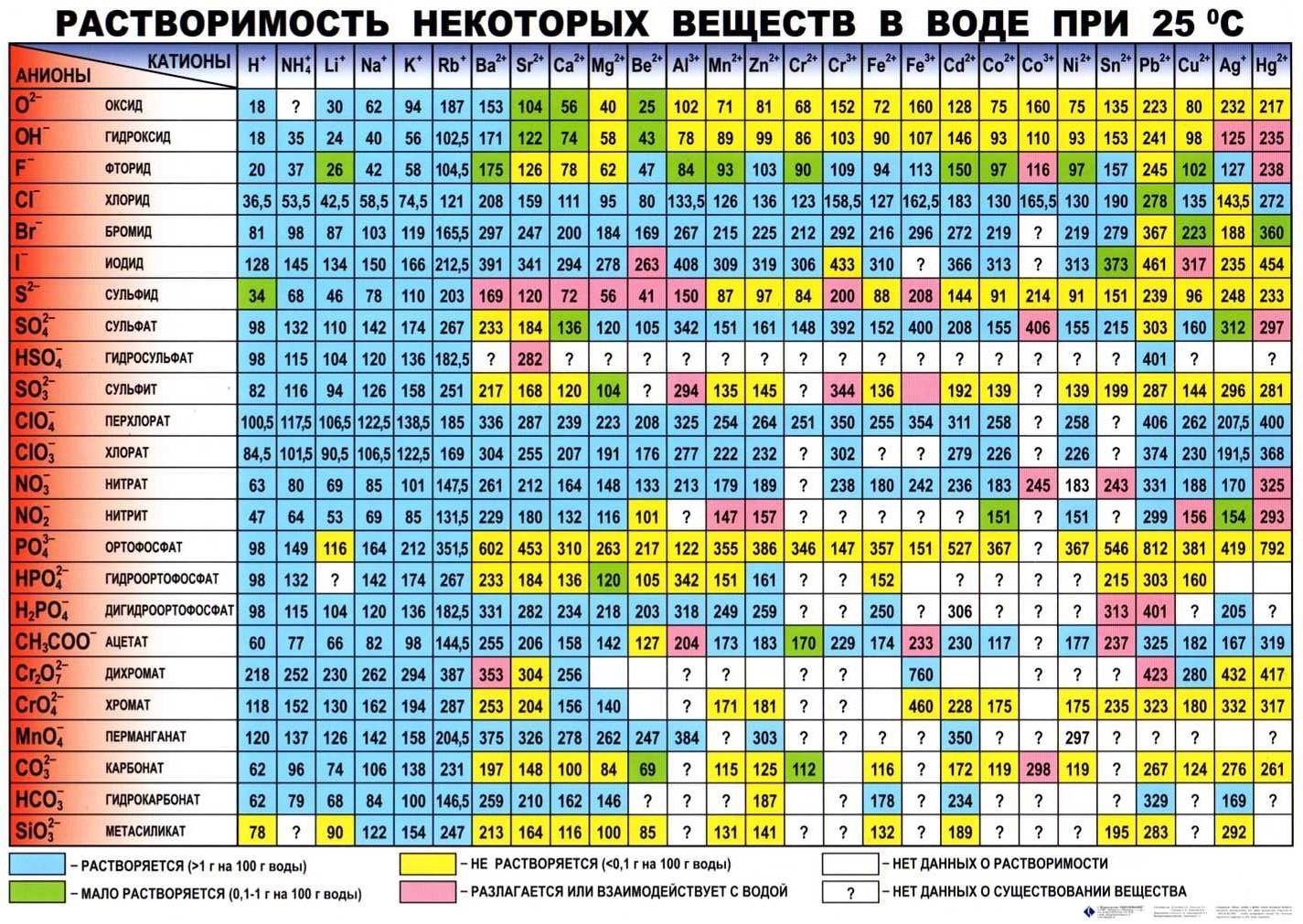
ПРИЛОЖЕНИЕ В
Ряд стандартных электродных потенциалов (ряд активности металлов)
|
Li |
Rh |
K |
Ba |
Sr |
Ca |
Na |
Mg |
Al |
Mn |
Zn |
Cr |
Fe |
Cd |
Co |
|
−3,04 |
−2,93 |
−2,92 |
−2,90 |
−2,89 |
−2,87 |
−2,71 |
−2,36 |
−1,66 |
−1,18 |
−0,76 |
−0,74 |
−0,44 |
−0,40 |
−0,28 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ni |
Sn |
Pb |
H2 |
Sb |
Bi |
Cu+/Cu |
Cu2+/Cu |
Hg |
Hg |
Ag |
Pd2+/Pd |
Pt2+/Pt |
Au3+/Au |
Au+/Au |
|
−0,25 |
−0,11 |
−0,13 |
0,00 |
+0,21 |
+0,28 |
+0,52 |
+0,31 |
+0,79 |
+0,85 |
+0,80 |
+0,99 |
+1,19 |
+1,50 |
+1,69 |
ПРИЛОЖЕНИЕ Г
Меры первой помощи при возможных несчастных случаях при выполнении лабораторной работы
|
Возможные несчастные случаи |
Первая помощь |
|
Порезы стеклом |
удалить осколки стекла, вытереть рану чистой марлей или ватой, присыпать порошком белого стрептоцида и завязать |
|
Ранения с сильным кровотечением |
остановить кровь перевязкой выше места ранения (толстостенной каучуковой трубкой или резиновым ремнем), забинтовать пострадавшего и отправить в медицинский пункт |
|
Ожог раскаленными предметами |
смазать обожженное место насыщенным раствором КМnO4или 5%-ным линиментом синтомицина |
|
Ожог водяным паром или кипящей водой |
помощь та же, что и при ожоге раскаленными предметами |
|
Ожоги концентрированными кислотами |
тщательно смыть кислоту водой, после чего смазать обожженное место раствором (5 - 10%) гидрокарбоната натрия NaHCO3или присыпать порошком этой соли (можно применить порошокCaCO3) |
|
Ожег плавиковой (фтористоводородной) кислотой |
погрузить обожженное место на 10-15 мин в 3%-ный раствор NH4OHили же промыть обильным количеством воды и наложить компресс с пастой, приготовленной из суспензииMgO |
|
Ожег глаз концентрированными кислотами |
тщательно промыть глаза 20%-ным раствором NaHCO3или буры |
|
Ожег глаз крепкими щелочами |
после тщательного промывания глаз водой промыть их раствором слабой кислоты (2%-ным раствором борной или уксусной кислоты) |
|
Ожег жидким бромом |
промыть пораженное место водой и слабым раствором аммиака; поставить компресс из 1%-ного раствора карболовой кислоты |
|
Отравление лабораторными газами (светильным газом, окислами азота, бромом, аммиаком и др.) |
немедленно вывести отравленного на чистый воздух; если нужно сделать искусственное дыхание и дать кислород; при отравлении бромом и хлором, а также йодом, осторожно вдыхать пары аммиака из 10%-ного раствора NH4OH; хорошо проветрить помещение |
|
Отравление кислотами (HCl, H2SO4, CH3COOH) |
принимать внутрь суспензию магнезии, молоко, муку с водой |
|
Отравление щелочами |
принимать внутрь 5%-ную уксусную кислоту, лимонную кислоту или сок лимона |
ПРИЛОЖЕНИЕ Д
