
- •Основные понятия химии. Классы неорганических соединений
- •Cодержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные положения атомно-молекулярной теории
- •Количественно масса 1 моль вещества – масса вещества в граммах, численно равная его атомной или молекулярной массе.
- •1.2 Химический эквивалент
- •1Моль Са(он)2 2 эквивалента
- •1/2 Са(он)2 1 эквивалент
- •1). Определить степень окисления элемента образующего оксид.
- •2). По формуле оксида определить число атомов элемента образующего оксид и число атомов кислорода.
- •3). Определить молярную массу оксида:
- •5). Для других сложных веществ:
- •1.3 Степень окисления
- •Номер группы, в которой находится элемент, минус 8.
- •Примеры: а) Вычислить степень окисления хрома в хромовой кислоте h2CrO4 .
- •1.4 Химические реакции. Уравнения химических реакций
- •Классификация химических реакций
- •Вопросы и задачи для самоконтроля
- •1.5 Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения
- •2 Классы неорганических соединений
- •Простые вещества;
- •2.1 Оксиды
- •2.1.1 Основные оксиды
- •Химические свойства основных оксидов
- •2.1.2 Кислотные оксиды
- •Химические свойства кислотных оксидов
- •2.1.3 Амфотерные оксиды
- •Химические свойства амфотерных оксидов
- •2.2 Гидроксиды
- •2.2.1 Основания
- •Номенклатура (название) оснований:
- •Получение оснований
- •Получение труднорастворимых оснований
- •Химические свойства оснований
- •2.2.2 Кислородные кислоты
- •Номенклатура (название) кислот
- •Получение кислот
- •Химические свойства кислот
- •2.2.3 Амфотерные гидроксиды
- •Получение амфотерных гидроксидов
- •Химические свойства амфотерных гидроксидов
- •2.3 Соли
- •2.3.1 Средние (или нормальные) соли
- •Номенклатура (название) средних солей
- •Способы получения средних солей
- •Химические свойства средних солей
- •2.3.2 Кислые соли
- •Номенклатура (название) кислых солей
- •Способы получения кислых солей
- •Химические свойства кислых солей
- •2.3.3 Основные соли
- •Номенклатура (название) основных солей
- •Способы получения основных солей
- •Химические свойства основных солей
- •2.3.4 Двойные соли
- •2.3.5 Смешанные соли
- •2.3.6 Комплексные соли
- •Рассмотрим состав комплексных солей:
- •Названия электронейтральных комплексов:
- •2.4 Бинарные соединения
- •2.5 Генетическая связь между классами неорганических соединений
- •2.6 Лабораторные работы
- •2.6.1 Техника безопасности и основные требования при работе в химической лаборатории
- •При возникновении несчастных случаев сразу же поставить в известность преподавателя или лаборанта обслуживающего лабораторную работу.
- •2.6.2 Вопросы для рассмотрения основных понятий и определений
- •2.6.3 Получение оксидов и определение их свойств
- •2.6.4 Получение амфотерных гидроксидов и определение их свойств
- •2.6.5 Получение солей и их свойства
- •2.6.6 Вопросы и задачи для практического занятия
- •2.7 Вопросы и задачи для самостоятельной работы
- •2.8 Входной тестовый контроль Вариант № 1
- •Выберите правильный ответ:
- •1) Основным оксидам; 3) амфотерным оксидам;
- •2) Кислотным оксидам; 4) безразличным оксидам.
- •Вариант № 2
- •Выберите правильный ответ:
- •Вариант № 3
- •Выберите правильный ответ:
- •2) Кислотные свойства; 4) свойства сильных электролитов.
- •Вариант № 4
- •Выберите правильный ответ:
- •2) Кислотные свойства; 4) свойства безразличного оксида.
- •2.9 Задания для контрольной работы
- •1. Назовите перечисленные ниже соединения Вариант:
- •2. Составьте молекулярные и ионные уравнения, характеризующие способы получения и свойства соединений Вариант:
- •Вариант:
- •4. Составьте уравнения всех возможных реакций, протекающих между веществами Вариант:
- •5. Осуществите следующие превращения Вариант:
- •Темы реферативных работ
- •Рекомендуемая литература Основная литература:
- •Дополнительная литература:
- •Список использованных источников
- •Периодическая система химических элементов д.И. Менделеева
- •Ряд стандартных электродных потенциалов (ряд активности металлов)
- •Меры первой помощи при возможных несчастных случаях при выполнении лабораторной работы
- •Термины и определения в химии (номенклатура неорганических соединений июпак) (глоссарий)
- •Основные понятия химии. Классы неорганических соединений
- •426069, Г. Ижевск, ул. Студенческая, 11
Способы получения основных солей
Основные соли образуются:
1) при добавлении недостатка раствора щелочи к растворам средних солей металлов, образованных труднорастворимыми основаниями или амфотерными гидроксидами, например:
AlCl3 + NaOH → AlOHCl2 +NaCl.
2) при действии растворов солей слабых кислородных кислот на средние соли, например:
2MgCl2 + 2K2CO3 + H2O → (MgOH)2CO3 + CO2 + 4KCl.
3) при действии недостатка кислоты на многокислотные основания или амфотерные гидроксиды, например:
Fе(OH)3 + 2HNO3 → FеOH(NO3)2 + 2H2O.
Химические свойства основных солей
1. Диссоциация основных солей.
Нужно помнить:
основные соли диссоциируют по ступеням:
по первой ступени необратимо (по типу
сильного электролита) с образованием
гидроксокатиона и кислотных остатков;
по всем остальным ступеням обратимо с
постепенным отщеплением ионов
![]() от гидроксокатиона. Примеры диссоциации
основных солей:
от гидроксокатиона. Примеры диссоциации
основных солей:
1ступень:
![]() ,
,
гидроксокатион
2 ступень:
![]() .
.
1 ступень:
![]() ,
,
гидроксокатион
2 ступень:
![]() .
.
1 ступень:
![]() ,
,
гидроксокатион
2 ступень:
![]() ,
,
гидроксокатион
3 ступень:
![]() .
.
2. Основные соли летучих кислородных кислот при нагревании легко разлагаются, например:
(CuOH)2CO3
![]() 2CuО
+ CO2↑
+ H2O.
2CuО
+ CO2↑
+ H2O.
3. Реагируют с кислотами, например:
(MgOH)2CO3 + 2H2SO4 → 2MgSO4 + CO2 + 3H2O,
CuOHCl + HCl → CuCl2 + H2O,
FeOH(NO3)2 + HNO3 → Fe(NO3)3 + H2O.
4. Реагируют со щелочами, например:
Fe(OH)NO3
+ КOH
→ Fe(OH)2
+ КNO3
.![]()
2.3.4 Двойные соли
Двойными солями называют такие соли, в состав которых входят катионы двух различных металлов (или катион аммония) и анионы одного кислотного остатка, например:
KAl(SO4)2 – сульфат алюминия калия;
(NH4)2Fe(SO4)2 – сульфат железа (ΙΙ) аммония;
KCuCl3 – хлорид меди (ΙΙ) калия.
Двойные соли образуются при соединении солей двух различных металлов одной и той же кислоты:
K2SO4 + Al2(SO4)3 → K2SO4 × Al2(SO4)3 → 2KAl(SO4)2,
сульфат алюминия калия
(NH4)2SO4 + Fe2(SO4)3 → (NH4)2SO4 × Fe2(SO4)3 → 2NH4Fe(SO4)2,
сульфат железа (ΙIΙ) аммония
Двойные соли диссоциируют в одну ступень необратимо (по типу сильного электролита) на ионы, из которых они состоят, например:
![]() ,
,
![]()
![]() ,
,
![]()
![]()
![]()
![]() .
.
2.3.5 Смешанные соли
Смешанными солями называют такие соли, в состав которых входят катионы одного металла и анионы двух различных кислотных остатков и могут быть образованы при взаимодействии солей двух различных кислот одного и того же металла. Такие соли встречаются довольно редко, например:
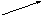
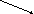 CaCl2
CaCl2
C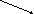
 a(OCl)Cl
+ 2Ca(OCl)Cl,
a(OCl)Cl
+ 2Ca(OCl)Cl,
хлоридгипохлорит кальция Ca(ClO)2 хлоридгипохлорит кальция
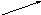
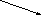 CuBr2
CuBr2
C
 uBrCl
+ 2CuBrCl.
uBrCl
+ 2CuBrCl.
хлоридбромид
меди (II)
хлоридбромид меди (II)
CuCl2
Смешанные соли
диссоциируют в одну ступень необратимо
(по типу сильного электролита) с
образованием всех ионов, входящих в
состав соли, например:
![]() ,
,
![]() .
.
