
- •Предмет физики
- •Роль физики в науке
- •Материальная точка
- •Совокупное измерение
- •Кинематическое описание движения
- •Прямолинейное движение
- •Угловое ускорение
- •Криволинейное движение
- •Динамика
- •Масса и импульс
- •Первый закон Ньютона
- •Система центра масс
- •Работа и мощность
- •Работа переменной силы в общем случае вычисляется посредством интегрирования:
- •Уравнение состояния идеального газа
- •Первое начало термодинамики
- •Второе начало термодинамики
- •Цикл Карно
- •Средняя кинетическая энергия молекул.
Уравнение состояния идеального газа
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
-
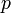 —
давление,
—
давление, -
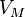 —
молярный
объём,
—
молярный
объём, -
 —
универсальная
газовая постоянная
—
универсальная
газовая постоянная -
 —
абсолютная
температура,К.
—
абсолютная
температура,К.
Так
как
![]() ,
где
,
где
![]() —
количество
вещества,
а
—
количество
вещества,
а
![]() ,
где
,
где
![]() —
масса,
—
масса,
![]() —
молярная
масса,
уравнение состояния можно записать:
—
молярная
масса,
уравнение состояния можно записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() —
закон
Бойля — Мариотта.
—
закон
Бойля — Мариотта.
![]() —
Закон
Гей-Люссака.
—
Закон
Гей-Люссака.
![]() —
закон
Шарля
(второй закон Гей-Люссака, 1808 г.)
—
закон
Шарля
(второй закон Гей-Люссака, 1808 г.)
Сравнивая (10.6) с (10.2), получим очень важное равенство
|
|
(10.7) |
Это выражение объясняет молекулярно-кинетический смысл понятия температуры.
Температура – это средняя кинетическая энергия движения молекул (выраженная в других единицах).
В этом определении очень важным является слово «средняя». Если изъять из газа наиболее медленные молекулы, полная кинетическая энергия всех молекул уменьшится, но температура повысится, так как увеличится средняя энергия.
Распределение Больцмана — распределение вероятностей различных энергетических состояний идеальной термодинамической системы (идеальный газ атомов или молекул) в условиях термодинамического равновесия; открыто Л. Больцманом в 1868—1871.
Согласно распределению Больцмана среднее число частиц с полной энергией Ei равно
![]()
где Ni — кратность состояния частицы с энергией Ei — число возможных состояний частицы с энергией Ei. Постоянная Z находится из условия, что сумма ni по всем возможным значениям i равна заданному полному числу частиц n в системе (условие нормировки):
|
∑ |
ni = n. |
|
i |
|
В случае, когда движение частиц подчиняется классической механике, энергию Ei можно считать состоящей из
-
кинетической энергии
 (кин)
частицы (молекулы или атома),
(кин)
частицы (молекулы или атома),
-
внутренней энергии
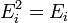 (вн)
(например, энергии возбуждения электронов)
и
(вн)
(например, энергии возбуждения электронов)
и
-
потенциальной энергии
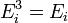 (пот)
во внешнем поле, зависящей от положения
частицы в пространстве:
(пот)
во внешнем поле, зависящей от положения
частицы в пространстве:
![]()
Теплоёмкость идеального газа
Теплоемкость идеального газа — это отношение количества теплоты, сообщенного газу, к изменению температуры δТ, которое при этом произошло.
![]()
Молярная теплоемкость
Молярная теплоемкость — теплоемкость 1 моля идеального газа.
![]()
![]()
Теплоемкость идеального газа в изопроцессах
Адиабатический
В
адиабатическом процессе теплообмена
с окружающей средой не происходит, то
есть
![]() .
При изменении объема температура и
давление меняются, то есть
.
При изменении объема температура и
давление меняются, то есть
![]() .
Следовательно, теплоемкость идеального
газа в адиабатическом процессе также
равна нулю: Садиаб=0.
.
Следовательно, теплоемкость идеального
газа в адиабатическом процессе также
равна нулю: Садиаб=0.
Изотермический
В
изотермическом процессе постоянна
температура, то есть
![]() .
При изменении объема газу передается
(или отбирается) некоторое количество
тепла. Следовательно, теплоемкость
идеального газа стремится к бесконечности:
.
При изменении объема газу передается
(или отбирается) некоторое количество
тепла. Следовательно, теплоемкость
идеального газа стремится к бесконечности:
![]()
Изохорный
В
изохорическом процессе постоянен объем,
то есть
![]() .
Элементарная работа газа равна
произведению изменения объема на
давление, при котором происходит
изменение (δA
= δVP).
Первое Начало Термодинамики для
изохорического процесса имеет вид:
.
Элементарная работа газа равна
произведению изменения объема на
давление, при котором происходит
изменение (δA
= δVP).
Первое Начало Термодинамики для
изохорического процесса имеет вид:
![]()
А для идеального газа
![]()
Таким образом,
![]()
где i — число степеней свободы частиц газа.
Изобарный
В
изобарном процессе (![]() ):
):
![]()
CP=δQ/νΔT=CV+R=((i+2)/2)*R
Основные понятия и определения
Определение: Термодинамика – наука о закономерностях превращения энергии. В термодинамике широко используется понятие термодинамической системы.
Определение: Термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой.
Все тела находящиеся за пределами границ рассматриваемой системы называются окружающей средой.
Поскольку одно и тоже тело, одно и тоже вещество при разных условиях может находится в разных состояниях, (пример: лед – вода – пар , одно вещество при разной температуре) вводятся, для удобства, характеристики состояния вещества – так называемые параметры состояния.
Перечислим основные параметры состояния вещества:
Температура тел - определяет направление возможного самопроизвольного перехода тепла между телами.
В Северной Америке используется шкала Фаренгейта. Для термодинамических расчетов очень удобна абсолютная шкала или шкала Кельвина. За ноль в этой шкале принята температура абсолютного нуля, при этой температуре прекращается всякое тепловое движение в веществе. Численно один градус шкалы Кельвина равен одному градусу шкалы Цельсия. В настоящее время в мире существует несколько температурных шкал и единиц измерения температуры. Наиболее распространенная в Европе шкала Цельсия где нулевая температура – температура замерзания воды при атмосферном давлении, а температура кипения воды при атмосферном давлении принята за 100 градусов Цельсия (° С).
Температура, выраженная по абсолютной шкале, называется абсолютной температурой.
Соотношение для перехода от градусов Цельсия к градусам Кельвина:
T [K] = t [°C] + 273.15
где: T - температура в Кельвинах, t – температура в градусах Цельсия.
Давление - представляет собой силу, действующею по нормали к поверхности тела и отнесенную к единице площади этой поверхности.
Для измерения давления применяются различные единицы измерения. В стандартной системе измерения СИ единицей служит Паскаль (Па).
Соотношение между единицами:
1 бар = 105 Па
1 кг/см2 (атмосфера) = 9.8067×104 Па
1мм рт. ст (миллиметр ртутного столба) = 133 Па
1 мм вод. ст. (миллиметр водного столба) = 9.8067 Па
Плотность – отношение массы вещества к объему занимаемому эти веществом.
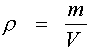
Удельный объем - величина обратная плотности т.е. отношения объема занятого веществом к его массе.
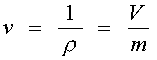
Обратимые и необратимые процессы, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Необратимые
процессы могут протекать самопроизвольно
только в одном направлении; таковы
диффузия,
теплопроводность,
вязкое течение и другое. Для химической
реакции применяют понятия термодинамической
и кинетической обратимости, которые
совпадают только в непосредственной
близости к состоянию равновесия. Р-ция
А + В
![]() С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотв.
С
+ D наз. кинетически обратимой или
двусторонней, если в данных условиях
продукты С и D могут реагировать друг с
другом с образованием исходных веществ
А и В. При этом скорости прямой и обратной
реакций, соотв.
![]()
![]() ,
где
,
где
![]() и
и
![]() -константы
скорости, [А], [В], [С], [D]- текущие концентрации
(активности), с течением времени становятся
равными и наступает химическое
равновесие,
в котором
-константы
скорости, [А], [В], [С], [D]- текущие концентрации
(активности), с течением времени становятся
равными и наступает химическое
равновесие,
в котором
![]() -константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
-константа
равновесия, зависящая
от температуры. Кинетически необратимыми
(односторонними) являются обычно такие
реакции, в ходе которых хотя бы один из
продуктов удаляется из зоны реакции
(выпадает в осадок, улетучивается или
выделяется в виде малодиссоциированного
соединения), а также реакции, сопровождающиеся
выделением большого кол-ва тепла.
На практике нередко встречаются системы, находящиеся в частичном равновесии, т.е. в равновесии по отношению к определенного рода процессам, тогда как в целом система неравновесна. Например, образец закаленной стали обладает пространственной неоднородностью и является системой, неравновесной по отношению к диффузионным процессам, однако в этом образце могут происходить равновесные циклы механической деформации, поскольку времена релаксации диффузии и деформации в твердых телах отличаются на десятки порядков. Следовательно, процессы с относительно большим временем релаксации являются кинетически заторможенными и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов.
