
- •Кинетика и термодинамика ферментативных реакций
- •Специальность 020208.65 - Биохимия
- •Составитель: н.М.Титова
- •ВвЕдение
- •Раздел 1. Уравнение Михаэлиса-Ментен
- •Характеристика кинетических констант
- •Методы определения Км и Vmax
- •Задачи к разделу 1
- •Раздел 2. Ингибиторы ферментов
- •2.1. Конкурентное ингибирование
- •2.2. Неконкурентное ингибирование
- •2.3. Бесконкурентное ингибирование
- •2.4. Смешанный тип ингибирования
- •2.5. Методы определения константы ингибирования
- •2.6. Субстратное ингибирование
- •2.7. Задачи к разделу 2.
- •Раздел 3. Ферменты, не подчиняющиеся кинетике Михаэлиса-Ментен
- •3.1 Методы определения коэффициента Хилла
- •3.2. Определение коэффициента крутизны Кошланда
- •3.3. Задачи к разделу 3.
- •Раздел 4. Задачи к коллоквиумам и тестам
- •Оглавление
- •660041, Г. Красноярск, пр. Свободный, 79
- •660041, Г. Красноярск, пр. Свободный, 82а
2.3. Бесконкурентное ингибирование
Этот тип ингибирования наблюдается в случае, когда ингибитор способен связываться исключительно с фермент-субстратным комплексом.
Схема бесконкурентного ингибирования:
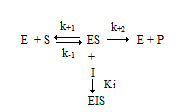
При данном типе ингибирования в равной степени изменяется как константа Михаэлиса, так и максимальная скорость реакции:
![]() .
(5)
.
(5)
Где
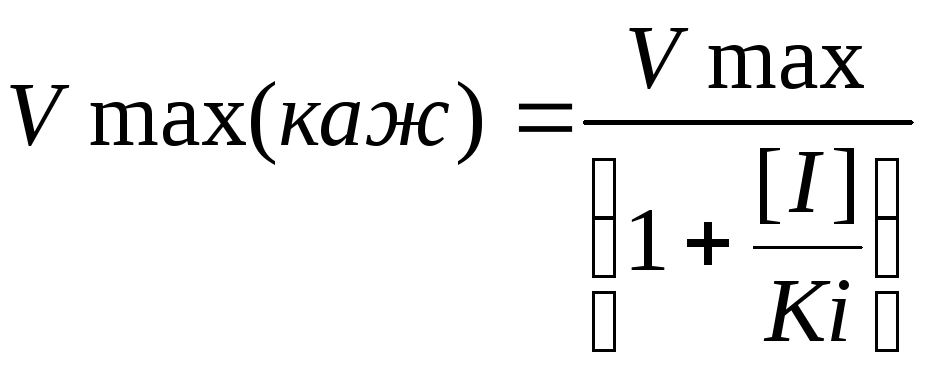 ,
а
,
а![]() .
(6)
.
(6)
Так как и константа Михаэлиса и максимальная скорость изменяются в равной степени, то в координатах Лайнуивера-Берка графики имеют вид параллельных прямых (рис.2.7).
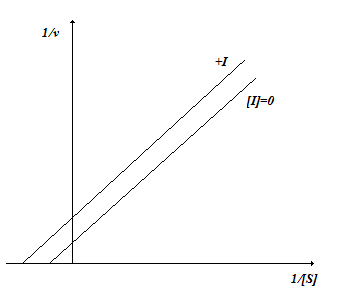
Рис. 2.7. Бесконкурентное ингибирование
Бесконкурентный тип ингибирования часто встречается в сложных полисубстратных реакциях.
2.4. Смешанный тип ингибирования
Типы ингибирования, рассмотренные выше, являются предельными случаями в широком спектре возможных эффектов. В случае двухсубстратных реакций при определенной концентрации ингибитора часто можно наблюдать ингибирование смешанного типа.
Общая схема ингибирования смешанного типа.
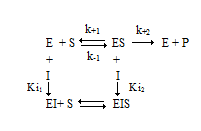
При этом Ki1 ≠ Ki2. Изменяются как константа Михаэлиса, так и максимальная скорость, но не в одинаковой степени:
![]() (7)
(7)
Смешанное конкурентное-неконкурентное ингибирование. В этом варианте ингибирования Ki2˃ Ki1. Сродство фермента к субстрату в присутствии ингибитора данного типа увеличивается, а максимальная скорость ферментативной реакции снижается (рис. 2.8).
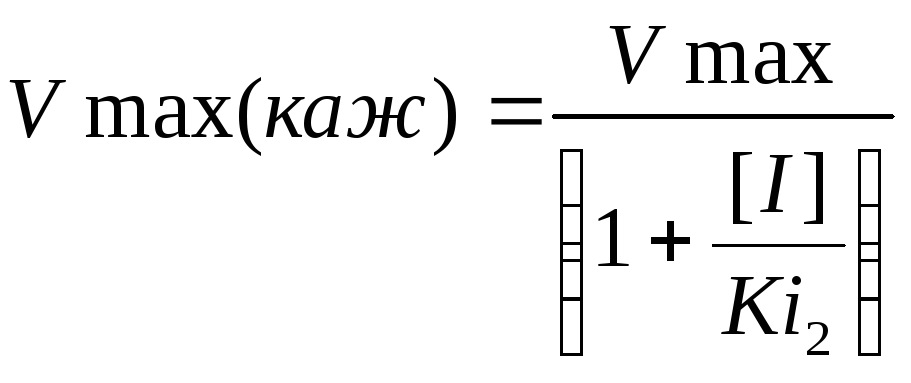 ,
,
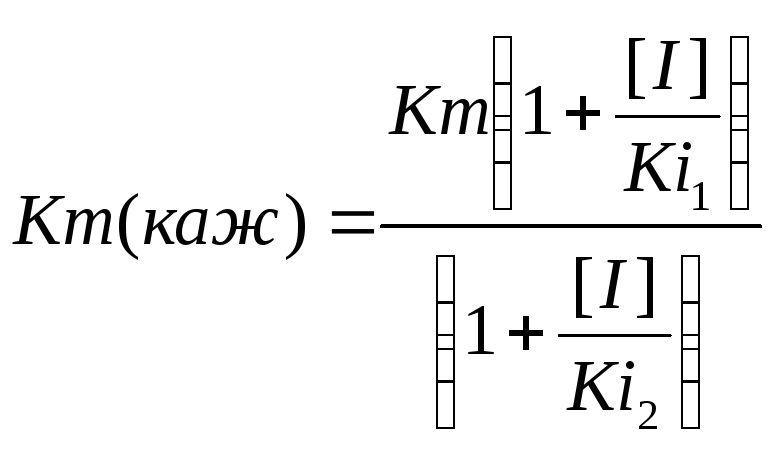 (8)
(8)
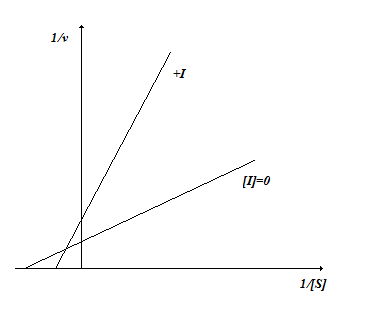
Рис. 2.8. Смешанное конкурентное-неконкурентное
Смешанное неконкурентное-бесконкурентное ингибирование. В этом случае Ki1 ˃ Ki2. Этот ингибитор снижает и константу Михаэлиса и максимальную скорость реакции (рис. 2.9).
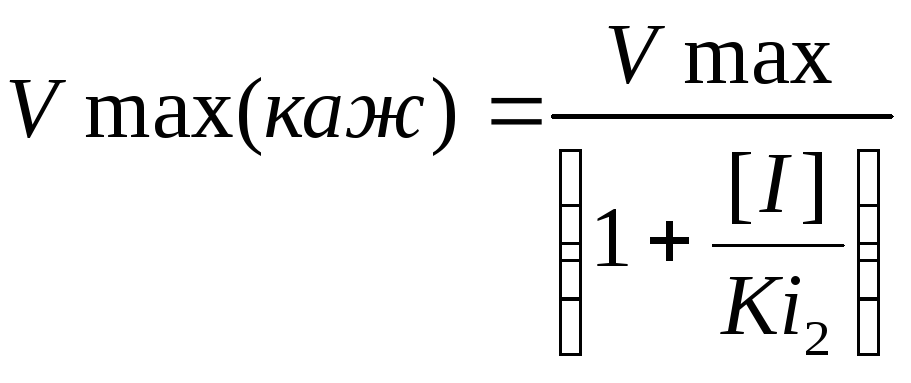 ,
,
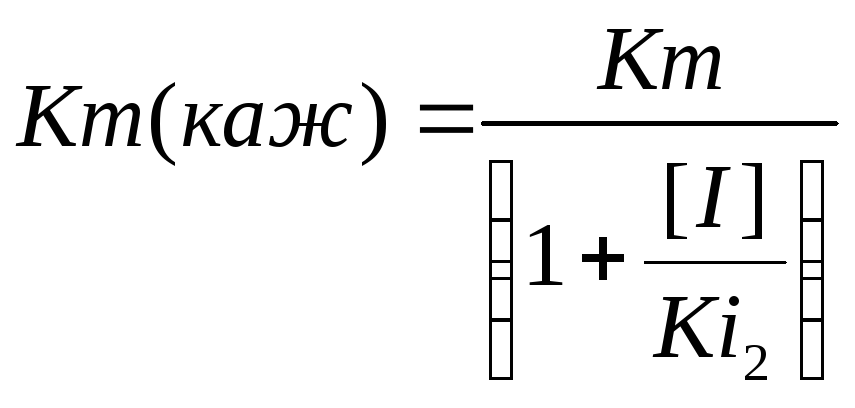 (9)
(9)
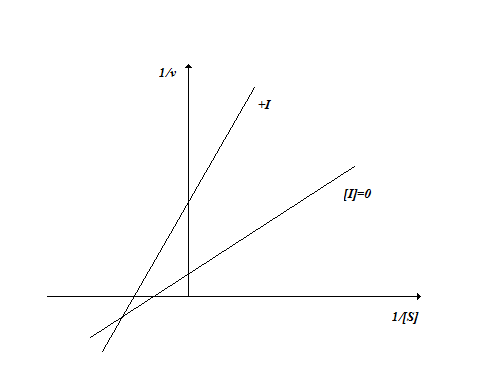
Рис. 2.9. Смешанное неконкурентное-бесконкуоентное
Примером смешанного ингибирования является воздействие ртутьорганического соединения мертиолата на сахаразу грибов. Это вещество широко используется в промышленности для подавления роста микромицетов.
2.5. Методы определения константы ингибирования
Величины Кi можно измерить различными методами, как экспериментально, так и при помощи расчетов.
Если известна только одна концентрация ингибитора, то константу ингибирования можно определить, используя графики в координатах Лайнуивера-Берка. Найдя кажущиеся и истинные значения константы Михаэлиса и максимальной скорости для двух графиков (в отсутствии и в присутствии ингибитора) и подставив эти значения в формулы (2), (4), (7), (9), (10), рассчитывают ингибиторную константу.
Наиболее удобен для определения константы ингибирования метод Диксона. Этот простой графический метод позволяет определять Кi непосредственно. Если определять скорость реакции в условиях постоянной концентрации субстрата и различных концентраций ингибитора, то график зависимости 1/v от [I] будет представлять собой прямую (рис. 2.10.). В этом случае для определения ингибиторной константы достаточно определить скорость реакции всего для двух концентраций субстрата.
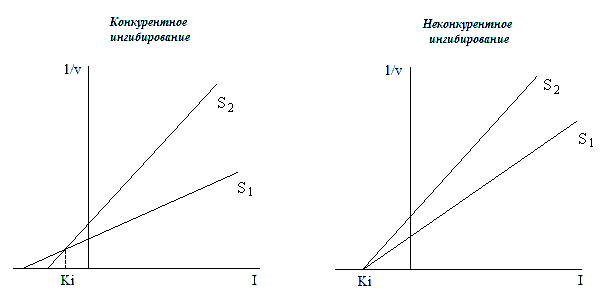
Рис. 2.10. Графическое определение ингибиторных констант (метод Диксона). Во всех случаях S1˃S2
2.6. Субстратное ингибирование
Для многих ферментативных реакций при увеличении концентрации субстрата начальная скорость ферментативной реакции проходит через максимум, а затем уменьшается. Подобного рода зависимость можно описать, исходя из предположения об образовании в процессе реакции непродуктивного тройного комплекса ЕS2. В этом случае кинетическая схема ферментативной реакции выглядит следующим образом:
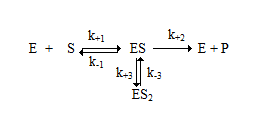
Зависимость скорости реакции от концентрации субстрата после математической обработки этой схемы имеет вид:
![]() (11)
(11)
Где К′s – субстратная константа, учитывающая сродство фермента ко второй молекуле субстрата. Анализ этого уравнения, как и уравнения Михаэлиса-Ментен, целесообразно проводить раздельно в области низких ([S] < Кs´) и высоких ([S] ˃ Кm ) концентрациях субстрата.
При низких значениях концентрации субстрата уравнение упрощается до классического уравнения Михаэлиса-Ментен (рис. 2.12а), при линеаризации которого можно определить Кm, Vmax, kcat (k+2 ).
![]()
В области высоких концентраций субстрата уравнение принимает вид:
![]() (12)
(12)
Линеаризация этого уравнения в координатах (1/v, [S]) позволяет определить Vmax и Кs´ (рис.2.12б).
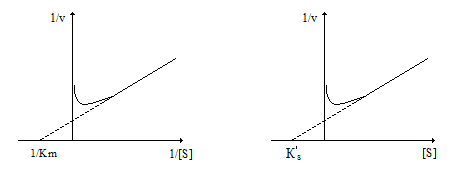
а) б)
Рис. 2.12. Линеаризация уравнения (12) в координатах (1/v 1/[S]) –а) и (1/v ; [S]) – б)
Зная величины Кm и Кs´, можно рассчитать оптимальную концентрацию субстрата по формуле:
![]() (13)
(13)
