
- •Кинетика и термодинамика ферментативных реакций
- •Специальность 020208.65 - Биохимия
- •Составитель: н.М.Титова
- •ВвЕдение
- •Раздел 1. Уравнение Михаэлиса-Ментен
- •Характеристика кинетических констант
- •Методы определения Км и Vmax
- •Задачи к разделу 1
- •Раздел 2. Ингибиторы ферментов
- •2.1. Конкурентное ингибирование
- •2.2. Неконкурентное ингибирование
- •2.3. Бесконкурентное ингибирование
- •2.4. Смешанный тип ингибирования
- •2.5. Методы определения константы ингибирования
- •2.6. Субстратное ингибирование
- •2.7. Задачи к разделу 2.
- •Раздел 3. Ферменты, не подчиняющиеся кинетике Михаэлиса-Ментен
- •3.1 Методы определения коэффициента Хилла
- •3.2. Определение коэффициента крутизны Кошланда
- •3.3. Задачи к разделу 3.
- •Раздел 4. Задачи к коллоквиумам и тестам
- •Оглавление
- •660041, Г. Красноярск, пр. Свободный, 79
- •660041, Г. Красноярск, пр. Свободный, 82а
Раздел 2. Ингибиторы ферментов
На активность ферментов оказывают влияние множество факторов, среди которых важную роль играют ингибиторы, воздействие которых снижает активность ферментов.
Различают обратимое и необратимое ингибирование. Необратимый ингибитор или каталитический яд, взаимодействуя с ферментом, снижает его активность до нуля.
Яркий пример необратимого ингибирования – ингибирование ацетилхолинэстеразы фторорганическими соединениями (рис. 2.1.). Ацетилхолинэстераза катализирует гидролиз ацетилхолина, избыток которого может полностью блокировать передачу нервного импульса через синапс. Поэтому фторорганические соединения являются сильными ядами.
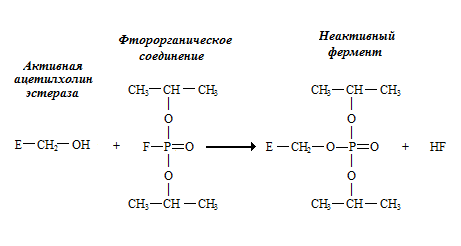
Рис. 2.1. Необратимое ингибирование ацетилхолинэстеразы
Другой пример – действие аспирина на циклооксигеназу. Ацетилсалициловая кислота ацилирует фермент в активном центре по остатку серина (рис. 2.2.).
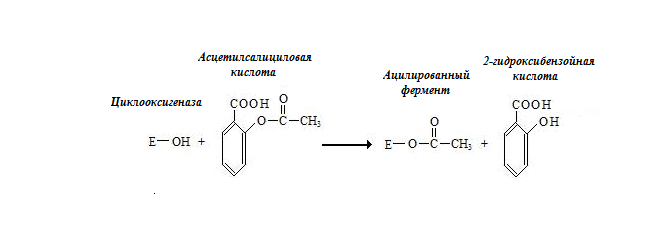
Рис. 2.2. Необратимое ингибирование циклооксигеназы
Необратимым ингибитором для ферментов, содержащих SH-группу цистеина в активном центре, является йодуксусная кислота и йодацетамид (рис. 2.3.).
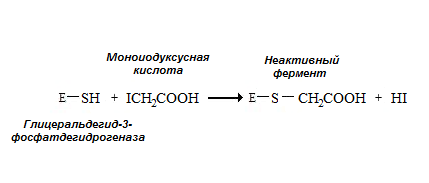
Рис. 2.3. Необратимое ингибирование глицеральдегид-3-фосфатдегидрогеназы
Обратимые ингибиторы, в отличие от необратимых образуют с ферментом динамический комплекс, отличающийся по своим кинетическим свойствам от свободного фермента.
Характерная черта обратимого ингибирования – наличие равновесия между ферментом и ингибитором. При этом константа равновесия или константа ингибирования (Кi) служит мерой сродства фермента и ингибитора и выражает эффективность действия ингибитора.
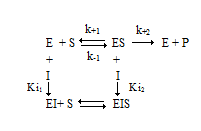
Можно выделить четыре типа обратимого ингибирования: конкурентное, неконкурентное, бесконкурентное и ингибирование смешанного типа.
Общая схема ингибирования:
2.1. Конкурентное ингибирование
Конкурентный ингибитор – это соединение, обладающее структурным сходством с субстратом. Поэтому такой ингибитор способен взаимодействовать с активным центром фермента, конкурируя с истинным субстратом.
Схема конкурентного ингибирования
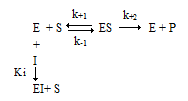
График ингибирования в координатах Лайнуивера-Берка выглядит следующим образом (рис. 2.4).
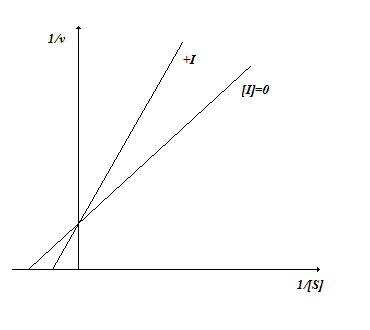
Рис. 2.4. Конкурентное ингибирование
При этом типе ингибирования увеличивается Km. Скорость реакции снижается, так как комплекс фермент-ингибитор является неактивным (не распадается с образованием продуктов). Однако максимальная скорость реакции (Vmax) не изменяется.
Уравнение Михаэлиса-Ментен в данном случае имеет вид:
![]() (1)
(1)
Где Km(каж) равна:
![]() (2)
(2)
Степень ингибирования зависит от концентраций субстрата и ингибитора, и при достаточно большой концентрации субстрата ингибирование может быть подавлено.
Пример конкурентного ингибирования – ингибирование сукцинатдегдрогеназы малоновой кислотой (рис 2.5).
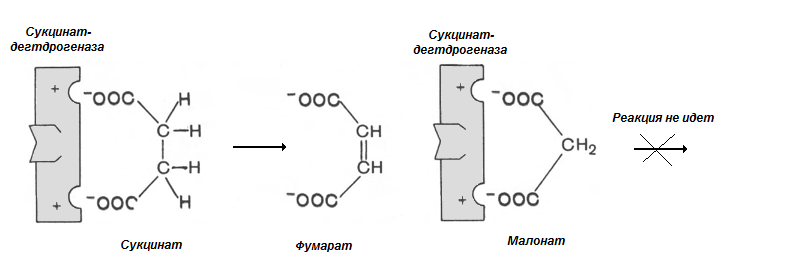
Рис. 2.5. Малонат – конкурентный ингибитор сукцинатдегидрогеназы
2.2. Неконкурентное ингибирование
В случае неконкурентного ингибирования ингибитор не оказывает влияния на взаимодействие фермента и субстрата (рис. 2.6), уменьшая скорость реакции (Vmax(каж)<Vmax).
Схема неконкурентного ингибирования
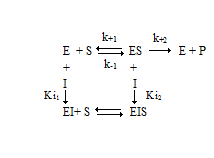
При этом Ki1=Ki2=Ki. Уравнение Михаэлиса-Ментен выглядит следующим образом:
![]() (3)
(3)
Где Vmax(каж) имеет значение:
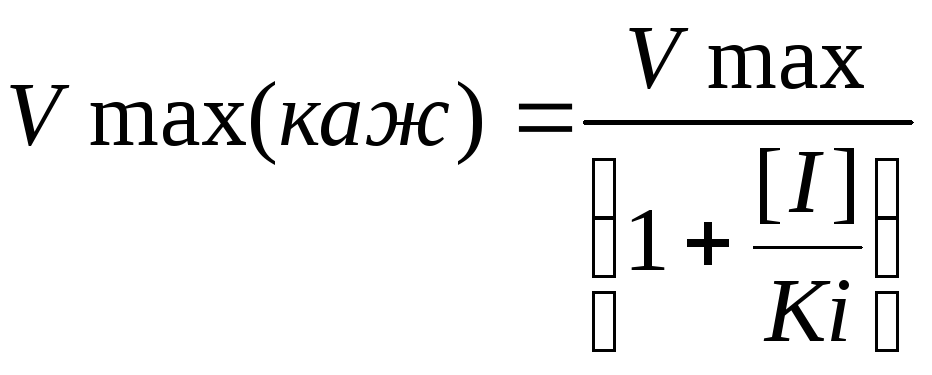 (4)
(4)
Линейный график в координатах двойных обратных величин имеет следующий вид (рис. 2.6.). Степень ингибирования зависит от концентрации ингибитора и не зависит от концентрации субстрата.
Примером неконкурентного ингибирования является ингибирование α-амилазы мальтозой (продуктом реакции). В промышленности применяется противогрибковый препарат этоний, который является неконкурентным ингибитором сахаразы грибов. В медицине его используют как антисептик.
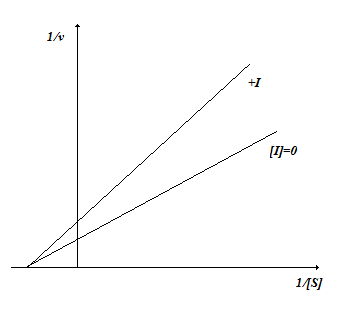
Рис. 2.6. Неконкурентное ингибирование
