
- •Содержание
- •Тема 6. Жесткость воды и реакции солей жесткости в водных растворах
- •Часть 2
- •Тема 7. Окислительно-восстановительные реакции и их использование
- •Тема 8. Электрохимические системы и процессы (базовый материал)……81
- •Часть 3
- •Введение
- •1. Темы лабораторных работ
- •Тема 1. Химическая термодинамика (базовый материал)
- •Тема 2. Скорость химических реакций и методы ее регулирования (базовый материал)
- •Тема 3. Химическое равновесие (базовый материал)
- •Тема 4. Гетерогенные химические системы и поверхностные явления в них (спецраздел с элементами уирс) (базовый материал)
- •5.1 Электролитическая диссоциация и водородный показатель среды (рН)
- •5.2 Реакции обмена в растворах электролитов, в том числе гидролиз
- •5.3 Представление о химическом анализе
- •Тема 6. Жесткость воды и реакции солей жесткости в водных растворах (базовый материал)
- •2 Список рекомендуемой литературы
- •Часть 2
- •1. Темы лабораторных работ
- •Тема 7. Окислительно-восстановительные реакции и их использование в химическом анализе (базовый материал)
- •Тема 8 Электрохимические системы и процессы (базовый материал)
- •Лабораторная работа № 8.3 Электролиз растворов электролитов
- •2. Список рекомендуемой литературы
- •Часть 3
- •1. Темы и методики лабораторных работ
- •Тема 9. Отличительные реакции углеводородов различных классов
- •Описание опытов
- •Лабораторная работа № 9. 1 Качественные реакции предельных и непредельных углеводородов
- •Тема 10. Химические свойства и качественная идентификация гидроксипроизводных углеводородов
- •10.1 Кислотные свойства спиртов и фенолов
- •10.2 Основные свойства спиртов и фенолов
- •10.3 Реакции спиртов в качестве нуклеофилов
- •10.4 Нуклеофильное замещение он-группы спиртов
- •10.5 Окисление спиртов
- •Лабораторная работа № 10. 1
- •Тема 11. Химические свойства и качественная идентификация карбонильных соединений
- •Лабораторная работа № 11.1
- •Тема 12. Химические свойства и качественная идентификация карбоновых кислот
- •12.1 Электролитическая диссоциация
- •12.2 Декарбоксилирование карбоновых кислот
- •12.3 Реакции нуклеофильного замещения групп он в карбоксильной группе
- •Лабораторная работа № 12.1
- •Вопросы для защиты лабораторных работ и подготовки к экзамену по разделу "Химические свойства и типичные реакции органических соединений"
- •Список рекомендуемой литературы
- •350072, Г. Краснодар, ул. Московская, 2, кор. А
Тема 8 Электрохимические системы и процессы (базовый материал)
Рекомендуемая литература по теме 1 приведена на с. 83.
Основные термины и понятия.
Электрохимические процессы – это гетерогенные ОВР, в которых происходит перенос заряда и вещества через поверхность раздела фаз. Они сопровождаются взаимным превращением химической и электрической энергии. В гальванических элементах энергия химической реакции преобразуется в электрическую. В процессах электролиза пропускание электрического тока через водный раствор вызывает химические реакции. Эти устройства состоят из двух электродов, замкнутых в единую цепь проводником 1-го рода и проводником 2-го рода.
Электрод – это гетерогенная система, представляющая собой проводник 1-го рода (чаще всего металл, обладающий электронной проводимостью), погруженный в раствор электролита.
В электрохимии электрод, на котором идут окислительные процессы, называют анодом. Электрод, на котором идут восстановительные процессы, называют катодом.
В металлической решетке существует подвижное равновесие:
![]()
где Ме0 – атом металла, Ме+n – катион металла, n – заряд катиона и число отданных электронов (см. рис. ниже).
Если поместить металл в воду, то под действием полярных молекул (диполей) воды часть катионов металла переходит с его поверхности в водную среду, в которой они существуют в гидратированном (сольватированном) состоянии (уравнение 8.1):
![]()
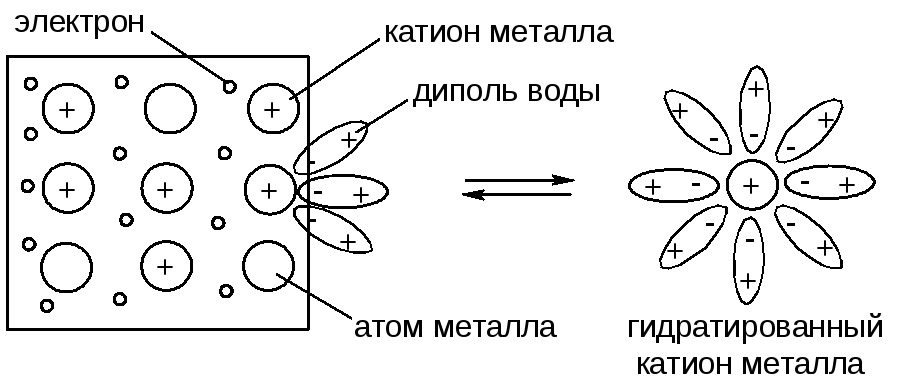
В результате этого процесса на поверхности металла возникает избыток электронов, поэтому она заряжается отрицательно.
Некоторая часть гидратированных катионов металла находится в объеме водной фазы за счет стабилизирующей гидратной оболочки. Однако их большая часть за счет электростатического притяжения находится у поверхности металла, формируя двойной электрический слой (ДЭС) в виде плоского конденсатора. В результате между металлом и раствором возникает разность потенциалов:
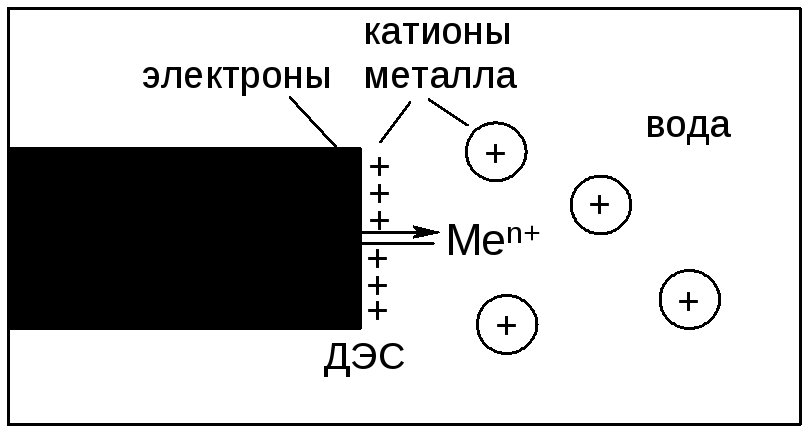
При установлении в данной системе равновесия, которое характеризуется определенным значением концентраций электронов на поверхности электрода и катионов металла в растворе, возникает разность потенциалов, которую называют электродным потенциалом металла и обозначают ЕMe0/Меn+, В.
По способности катионов металла переходить в раствор электролита все металлы делятся на активные, средней активности и неактивные.
Металлы, в соответствии с величинами их электрохимической активности, образуют электрохимический ряд напряжений металлов, в котором приведены значения их стандартных электродных потенциалов (с.э.п.). С.э.п. – это разность потенциалов, возникающая между нормальным водородным электродом (его потенциал условно принят равным нулю) и электродом из данного металла, находящегося в стандартных условиях: металл погружен в раствор собственной соли с концентрацией его катионов 1 моль на 1000 г воды при 298 К.
В ряду напряжений к активным относятся металлы от Li до Fe, к металлам средней активности – стоящие между Fe и H2, к неактивным – стоящие правее водорода.
Величина электродного потенциала металла зависит не только от его природы, но и от концентрации его катионов в растворе и температуры.
Зависимость электродного потенциала от концентрации катионов металла в растворе выражается уравнением Нернста:
Ес= Е0 + 0,059/n . lgСm
где Сm – моляльная концентрация катионов металла в растворе (моль/1000 г воды);
n – заряд катиона металла;
Ео – стандартный электродный потенциал данного металла, В;
Ес – потенциал металла при концентрации его катионов, не равной 1, В.
Таким образом, если увеличивать концентрацию катионов металла, то, согласно принципу Ле-Шателье, равновесие в уравнении 8.1 смешается влево. При этом отрицательный заряд металла уменьшается, поэтому его электродный потенциал становится менее отрицательным.
Рекомендуемая литература по теме 8: [1] гл. 9, §§ 9.3, 9.4, 38.5; [2], гл. 9, §§ 9.2, 9.3, гл. 10; [3], гл. 8, §§ 5, 6; [4], гл. 10, §§ 4-6, гл. 11, §§ 1-5.
Лабораторная работа № 8.1 Составление гальванического элемента с концентрационной поляризацией и определение его ЭДС (с элементами УИРС)
Теория электродных потенциалов позволила объяснить процессы, происходящие в химических источниках электрической энергии – гальванических элементах. Гальваническим элементом (ГЭ) называют электрохимическую систему, производящую электрическую энергию за счет протекания в ней окислительно- восстановительной реакции.
Наиболее распространенными являются ГЭ, составленные из электродов-полуэлементов – двух разных металлов, погруженных в растворы собственных солей. Простейшим ГЭ этого типа является элемент Якоби- Даниэля:
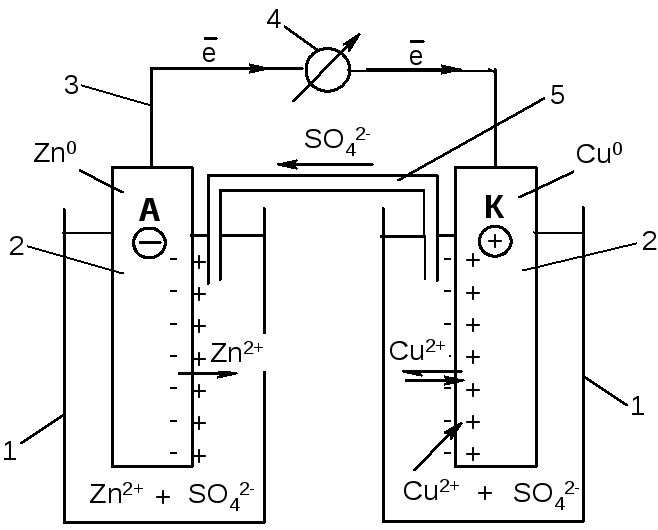
1 – химический стакан с раствором электролита;
2 – электроды цинковый и медный;
3 – соединительные провода;
4 – вольтметр;
5 – электролитический ключ (сифонная трубка).
Цель работы: практическое ознакомление с устройством и принципом работы гальванического элемента (ГЭ), методикой расчета и измерения его ЭДС.
Вследствие различия электрохимической активности металлов, входящих в состав электродов, или разной концентрации электролита в ГЭ возникает электродвижущая сила (ЭДС). ЭДС рассчитывается по формуле:
ЭДС = Е0 катода – Е0 анода, В
Если ГЭ не находится в стандартных условиях, то сначала находят значения потенциалов электродов в данных условиях по формуле Нернста (с. 17), а затем вычисляют ЭДС.
В процессе работы ГЭ его ЭДС постепенно уменьшается. Это явление называется поляризацией, оно связано с изменением значений электродных потенциалов элемента во времени. Поляризация бывает концентрационной и химической. Концентрационная поляризация делится на анодную и катодную. При анодной поляризации потенциал анода со временем становится более положительным, это объясняется следующим:
1) электроны движутся от анода к катоду быстрее, чем катионы металла выходят из анода в раствор;
2) концентрация катионов металла в прианодном пространстве постоянно увеличивается, что препятствует их выходу из анода.
При катодной поляризации потенциал катода становится все более отрицательным по следующим причинам:
1) электроны поступают от анода к катоду быстрее, чем катионы металла восстанавливаются на катоде;
2) концентрация катионов металла в прикатодном пространстве постоянно уменьшается.
Для борьбы с концентрационной поляризацией к растворам электролитов добавляют деполяризаторы, которые тормозят процесс изменения электродных потенциалов. Например, для устранения катодной поляризации добавляют различные окислители (О2, MnO2, K2Cr2O7 и др.).
Химическая поляризация возникает, когда в ходе работы г.э. изменяется природа поверхности электродов, что также приводит к изменению их потенциалов.
Реактивы: растворы сульфата цинка ZnSO4 и сульфата меди CuSO4 следующих концентраций: 1 моль /1000 г Н2О, 0,1 моль/1000 г Н2О, 0,01 моль/1000 г Н2О, 0,001 моль/1000 г Н2О.
Посуда и материалы: лабораторный гальванический элемент Якоби-Даниэля, состоящий из двух толстостенных стаканов на 200 см3, электроды цинковой и медной пластинок в качестве электродов, соединительных проводов, потенциометра и сифонной трубки – U-обра-
зной стеклянной трубки, заполненной проводящим электрический ток насыщенным раствором.
Опыт 1. Определение ЭДС гальванического элемента Якоби-Даниэля
Методика проведения опыта: В один из двух чистых сухих стаканов на 200 см3 налейте раствор сульфата цинка, во второй – раствор сульфата меди такой же концентрации. Металлические пластины тщательно зачистите наждачной бумагой, промойте водой, промокните фильтровальной бумагой и погрузите в растворы своих солей. Цинковую пластину соедините с отрицательной клеммой потенциометра, а медную – с положительной клеммой. Отметьте, отклоняется ли стрелка гальванометра.
Затем соедините оба стакана сифонной трубкой и сразу после этого отметьте значение, которое показывает стрелка потенциометра. Запишите показания потенциометра в лабораторный журнал. Отметьте, изменится ли значение показания потенциометра через 5 мин после начала работы ГЭ.
После завершения опыта извлеките пластины из растворов, а сифонную трубку поместите в стакан с насыщенным раствором KCl.
По результатам эксперимента выполните следующие задания, сделайте соответствующие записи в лабораторном журнале и напишите выводы:
1. Объясните причину отсутствия тока во внешней цепи в отсутствие сифонной трубки.
2. Определите анод и катод, запишите уравнения электродных полуреакций и суммарной токообразующей реакции.
3. Рассчитайте величину ЭДС для стандартных условий и сравните её с экспериментально полученной величиной.
4. Объясните причину расхождения между рассчитанным (теоретическим) и экспериментальным значениями ЭДС.
5. Объясните, почему через некоторое время после начала работы гальванического элемента его ЭДС уменьшается (для объяснения привлеките понятие о концентрационной поляризации).
Опыт 2. Установление влияния концентрации растворов электролитов на величину электродных потенциалов и ЭДС гальванического элемента (УИРС)
Методика проведения опыта: Соберите медно-цинковый элемент Якоби-Даниэля по методике, описанной в опыте 1.
Получите задание у преподавателя, в соответствии с вариантами, указанными в табл. 8.1 (с. 21).
Залейте в сосуды растворы ZnSO4 и CuSO4 заданной концентрации. Запишите показания потенциометра в рабочий журнал. Для установления влияния концентрации растворов на величину электродных потенциалов воспользуйтесь данными других студентов и наблюдайте, как изменяются показания потенциометра.
Таблица 8.1 – Варианты заданий для опыта 2
|
№ варианта |
Концентрация раствора, моль/л
| |
|
ZnSO4 |
CuSO4 | |
|
1 |
1 |
0,1 |
|
2 |
0,1 |
0,01 |
|
3 |
0,01 |
0,001 |
После завершения опыта:
1. Определите, какой из электродов будет анодом, а какой – катодом. Для этого по формуле Нернста рассчитайте величины электродных потенциалов.
2. Запишите уравнения электродных процессов и токообразующей реакции.
3. Рассчитайте ЭДС для двух вариантов по Вашему заданию с учетом приведенных ниже значений электродных потенциалов Ес (В) цинка и меди (табл. 8.2).
4. Результаты расчета и измерения запишите в таблицу 8.3.
Таблица 8.2 – Значения электродных потенциалов цинка и меди в зависимости от концентрации их катионов в растворе
|
Концентрация катионов металла в растворе |
Ес, В | ||
|
Zn |
Cu | ||
|
0,001 моль\л 0,01 моль\л 0,1 моль\л 1,0 моль\л |
-0,85 -0,82 -0,79 -0,76 (Ео) |
+0,25 +0,28 +0,31 +0,34 (Ео) | |
Таблица 8.3 – Результаты расчета и измерения ЭДС
|
Концентрация растворов, моль\л |
Равновесные потенциалы, В |
Показания потенциометра, В |
Расчетное значение ЭДС гальванического элемента, В | ||
|
ZnSO 4 |
CuSO4 |
Е Zn2+ \Zn |
Е Cu2+ \Cu |
|
|
|
1 |
0,1 |
-0,76 |
+0,31 |
|
|
|
0,1 |
0,01 |
|
|
|
|
|
0,01 |
0,001 |
|
|
|
|
По полученным данным постройте график зависимости ЭДС от концентрации ионов металла в растворе.
В выводе объясните влияние концентрации ионов металла в растворе электролита на величину ЭДС.
Лабораторная работа № 8.2 Коррозия металлов и защита от коррозии (с элементами УИРС)
Цель работы: изучение условий возникновения микрогальванических элементов при электрохимической коррозии металлов и влияния некоторых факторов на скорость коррозии; ознакомление с наиболее важными методами защиты металлов от коррозии.
Коррозия металлов – это процесс разрушения металлических материалов, протекающий в результате их взаимодействия с агрессивными компонентами окружающей среды.
Коррозия вследствие термодинамической неустойчивости металлов протекает самопроизвольно (ΔG<0) и сопровождается ростом энтропии (рассеиванием вещества в виде продуктов коррозии).
Коррозионные процессы относятся к гетерогенным ОВР, в их основе лежит реакция окисления металлов, которая проходит на поверхности раздела металла и окружающей среды:
Ме 0 – nе – Ме n+
По механизму и условиям, в которых металлы подвергаются разрушению, различают химическую и электрохимическую коррозию.
Процесс разрушения металлов и сплавов, проходящий в среде газа или неэлектролита (т.е. без участия электролитов) и не сопровождающийся возникновением электрического тока, называют химической коррозией. В процессе химической коррозии происходит прямое окислительное взаимодействие металла со средой с образованием на поверхности пленок оксидов, хлоридов, сульфидов, карбонатов и т.д.
Электрохимическая коррозия (ЭХК) протекает на поверхности металла (сплава) только при его контакте с раствором электролита. Разрушение металла при электрохимической коррозии происходит в результате возникновения и работы очень большого числа микрогальванических элементов (МГЭ). Анод и катод в МГЭ имеют очень малые размеры и, в отличие от искусственных ГЭ, напрямую контактируют друг с другом.
Для возникновения ЭХК необходимы три условия: 1) неоднородность состава металлического материала; 2) его контакт с электролитом; 3) наличие в электролите деполяризатора (активного окислителя).
В процессах ЭХК на участках металлических изделий и конструкций, имеющих более отрицательное значение потенциала, возникает процесс окисления металла, а на участках с более положительным (или менее отрицательным) потенциалом возможен процесс восстановления. Поэтому общее взаимодействие металла с раствором электролита делят на два процесса:
а) Анодный процесс, который заключается в переходе металлов в раствор в виде гидратированных ионов с оставлением эквивалентного числа электронов на металле: Ме0 – nе – Меn+ (процесс окисления).
Роль анода всегда выполняет более электрохимически активный металл, который разрушается.
б) Катодный процесс, который заключается в принятии пришедших из анода на катод избыточных электронов каким-либо деполяризатором, способным восстанавливаться на катоде. Роль катода всегда выполняет менее электрохимически активный металл. Сам катод в процессах ЭХК химическим превращениям не подвергается.
В кислой среде роль деполяризатора выполняют катионы водорода:
2Н+ + 2е → Н20
В нейтральной и щелочной средах в качестве деполяризатора преимущественно выступает растворенный кислород из воздуха:
О2 + 2 Н2О + 4е → 4 ОН-.
Опыт 1. Образование микрогальванического элемента при контакте разных металлов
Реагенты: 2 Н раствор соляной кислоты HCl, цинковая или алюминиевая пластина, медная проволока.
Посуда: согнутая под углом стеклянная трубка (или стакан на 50 – 100 см3).
Методика проведения опыта:
а) В согнутую под углом стеклянную трубку налейте 2 Н раствор соляной кислоты (можно использовать стакан). В одно колено трубки поместите узкую полоску цинка (или алюминия), а в другую – медную проволоку, так, чтобы металлы не соприкасались.
В процессе опыта наблюдайте, на каком металле выделяются пузырьки газа; отразите это в лабораторном журнале и напишите уравнение реакции взаимодействия металла с раствором кислоты. Какой газ выделяется? Почему медь не реагирует с раствором соляной кислоты?
б) Введите медную проволоку в раствор соляной кислоты до соприкосновения ее с цинком (или алюминиевой) пластиной.
Наблюдайте появление пузырьков водорода на поверхности меди, отразите это в лабораторном журнале.
Объясните процессы, проходящие в образующейся накоротко-замкнутой гальванопаре; зарисуйте схему образовавшегося микрогаль-ванического элемента, определите анод и катод; запишите уравнения электродных процессов и токообразующей реакции; в выводе объясните роль среды в катодном процессе и укажите, какой тип коррозии возникает при контакте разных металлов.
Опыт 2. Электрохимическая коррозия железа в условиях неодинаковой аэрации
Разная концентрация деполяризатора О2 в объеме капли (неодинаковая аэрация) приводит к тому, что в приповерхностной области капли (там, где концентрация О2 максимальная) наиболее быстро протекает процесс химической коррозии металла, приводящий к образованию оксида железа (II):
Fe + O2→ FeO
Оксид FeO в последующем процессе ЭХК выполняет роль катода на участке, контактирующем с электролитом.
Под центром капли, в области наименьшей концентрации О2, образование защитной пленки FeO наиболее затруднено. Эта область поверхности чистого железа выполняет роль анода, т. к. имеет более отрицательное значение электродного потенциала, чем FeO (рис. 8.1).
Р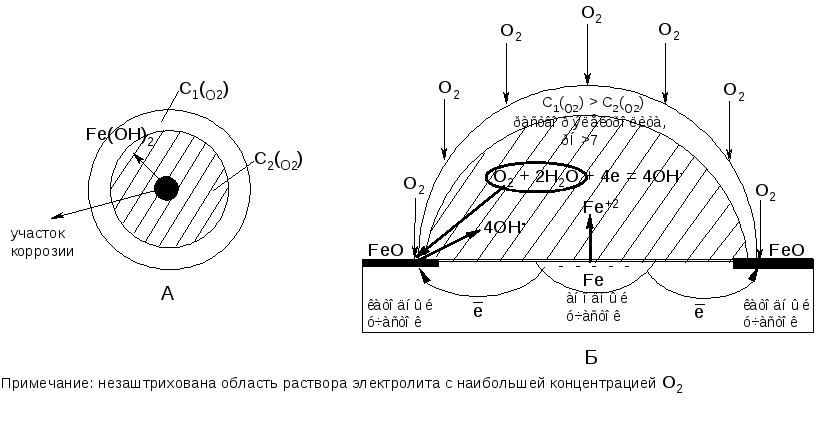 исунок
8.1 – Коррозия железа под неподвижной
каплей воды: А – вид сверху, Б – вид в
разрезе капли.
исунок
8.1 – Коррозия железа под неподвижной
каплей воды: А – вид сверху, Б – вид в
разрезе капли.
Реагенты: 3 %-ный раствор хлорида натрия NaCl, к которому предварительно добавлены раствор красной кровяной соли К3[Fe(CN)6] (2 % по массе) и раствор фенолфталеина; железная плоская пластинка.
Принадлежности: наждачная бумага, фильтровальная бумага.
Методика проведения опыта: Зачистите железную пластинку наждачной бумагой, промойте водой и высушите фильтровальной бумагой. На пластинку, находящуюся в горизонтальном положении, нанесите каплю раствора NaCl (диаметром 1-1,5 см), к которому предварительно были добавлены раствор красной кровяной соли и фенолфталеин. Оставьте пластину с каплей в неподвижном состоянии на 3-5 мин. В процессе опыта наблюдайте, в каких областях капли и какие окрашивания появляются.
Отразите наблюдения в лабораторном журнале, составьте и изобразите схему коррозии железа в условиях неодинаковой аэрации (см. рис. 8.1). Напишите реакции, проходящие на анодном и катодном участках железной пластины.
В выводах объясните:
– почему капля воды по периметру окрасилась в розовый цвет, а в центре капли появилось синее окрашивание;
– какую роль в проведенном опыте выполняют раствор NaCl, раствор красной кровяной соли и фенолфталеин.
– каким образом неодинаковая аэрация может влиять на процесс коррозии технологического оборудования.
Опыт 3. Коррозия луженого и оцинкованного железа с нарушенным покрытием
Наиболее распространенным способом защиты металлических изделий и сооружений от электрохимической коррозии являются металлические покрытия. Их роль сводится к изоляции поверхности металла от коррозионной среды. В зависимости от характера процессов, протекающих в коррозийной зоне при их повреждении, металлические покрытия делят на анодные и катодные. Анодными называют металлические покрытия, у которых электродный потенциал более отрицателен, чем электродный потенциал защищаемого металла (например оцинкованное железо, рис. 8.2А). К катодным относят покрытия с более положительным значением электродного потенциала, чем потенциал защищаемого металла (например луженое железо, рис. 8.2Б).
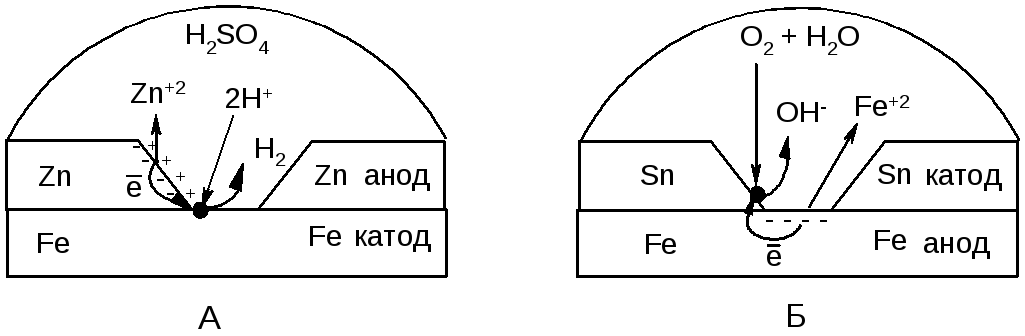
Рисунок 8.2 – Схема коррозии с нарушенным металлическим покрытием: А – оцинкованное железо (покрытие из цинка) в кислой среде; Б – луженое железо (покрытие из олова) в нейтральной среде.
Реактивы: 2 Н раствор серной кислоты, 3 %-ный раствор красной кровяной соли К3[Fe(CN)6], кусочки оцинкованного и луженого железа с нарушенным покрытием.
Посуда: две широкие пробирки.
Методика проведения опыта: Налейте в две пробирки по 2-3 см3 серной кислоты и добавьте в них по 2-3 капли раствора красной кровяной соли. В одну пробирку опустите два кусочка оцинкованного железа, а в другую – луженого железа. Наблюдайте, в какой из пробирок через некоторое время появляется синее окрашивание и объясните почему. Отразите это в лабораторном журнале и напишите уравнение реакции получения турнбулевой сини (с. 13, лаб. раб. 7.2, опыт 1).
Составьте схемы коррозии оцинкованного и луженого железа в кислой среде, схему образовавшегося микрогальванического элемента; напишите электронные уравнения анодного и катодного процессов.
В выводах отразите:
– в каком из проведенных опытов коррозия протекала при нарушении анодного покрытия, а в каком случае – при нарушении катодного; объясните, как определяется тип покрытия (анодный или катодный);
– где и с какой целью используют эти покрытия.
Опыт 5 Изучение влияния природы ингибитора на скорость коррозии (УИРС)
Ингибиторами коррозии называют вещества, которые при введении их в окружающую среду или при нанесении на поверхность металла значительно снижают скорость коррозии. Ингибиторы применяют главным образом в системах с постоянным объемом раствора. По механизму своего действия на процесс электрохимической коррозии ингибиторы подразделяют на катодные и анодные.
Катодные ингибиторы, адсорбируясь на поверхности катода, уменьшают площадь его контакта с деполяризаторами, тем самым снижают интенсивность катодного процесса. Катодными ингибиторами чаще всего бывают органические вещества: альдегиды, аминокислоты, мочевина, тиомочевина и др. Анодные ингибиторы (нитриты, дихроматы, фосфаты, силикаты и др.), иначе называемые пассиваторами, образуют защитную пленку на анодных поверхностях металла и, как правило, обладают окислительными свойствами. Защитным действием обладают также оксидные, солевые и др. пленки, образующиеся на поверхности металла при его взаимодействии с окислителями из окружающей среды, которые при определенных условиях пассивируют металл и уменьшают скорость его коррозионного разрушения.
Реактивы: дистиллированная вода, 0,1 М раствор серной кислоты H2SO4; кристаллические вещества: хлорид натрия NaCl, силикат натрия Na2SiO3, мочевина NH2CONH2, сукцинат натрия NaOOC-CH2-CH2-COONa (динатриевая соль янтарной кислоты); 3 %-ный раствор красной кровяной соли К3[Fe(CN)6]; железные пластины (скрепки, гвозди).
Посуда и принадлежности: четыре глазные пипетки, стеклянные лопаточки.
Методика проведения опыта: Налейте в четыре пробирки по 2 см3 воды. В первую пробирку добавьте одну лопаточку хлорида или силиката натрия, во вторую – 2 см3 серной кислоты, в третью – одну лопаточку мочевины, в четвертую – одну лопаточку сукцината натрия. В каждую пробирку прибавьте по 2 капли реактива на ионы железа (II) – раствор красной кровяной соли К3(Fe(CN)6). Содержимое пробирок взболтайте и в каждую опустите по железной скрепке (гвоздю). Наблюдайте за интенсивностью посинения (через какой период времени оно появится) у поверхности скрепки (гвоздя) и выделением пузырьков газа в пробирках.
Результаты опыта занесите в таблицу 8.4.
Таблица 8.4 – Результаты влияния различных ингибиторов на коррозию железа
|
Номер пробирки |
Добавленное изучаемое вещество |
Интенсивность посинения |
Интенсивность выделения пузырьков газа |
Время появления посинения и пузырьков газа, мин |
|
1 2 3 4 |
Хлорид натрия Серная кислота Мочевина Сукцинат натрия |
|
|
|
Приведите уравнение катодного и анодного процессов в системах с каждым из исследованных ингибиторов.
Сделайте вывод: какие из изученных веществ выполняют роль катодного, а какие – анодного ингибитора, и как влияет природа веществ на скорость коррозии.
