
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf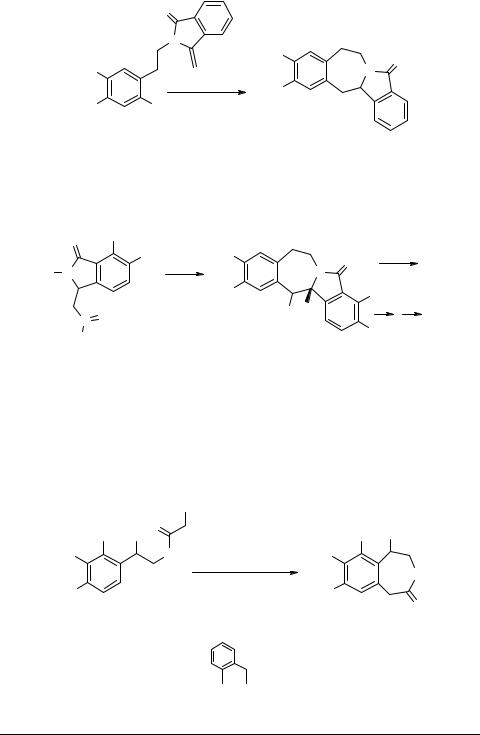
|
O |
|
|
|
N |
MeO |
|
MeO |
|
O |
|
|
|
||
Bu3SnH, AlBN |
|
N |
|
|
MeO |
|
|
MeO |
Br бензол, t° |
|
|
|
|
||
|
|
|
7 |
Другой подход к ленноксамину 7 и к чиленину 6 (схема 13) основан на перегруппировке Пуммерера [51–54]:
Схема 13
O |
OMe |
|
|
|
ii |
OMe |
|
MeO |
|
||
|
i |
O |
|||
R N |
7 |
||||
|
|
|
N |
|
|
|
|
|
MeO |
|
OMe |
|
S O |
|
PhS H |
|
6 |
Ph |
OMe |
|
R = 2-(3,4-метилендиоксифенил)-этил
i- TFAA, CH2Cl2, 0°, затем комн. температура, 80%
ii- Bu3SnH, AlBN, толуол, кипячение, 94%
Фотохимическое алкилирование хлорацетамидов 32 (схема 14) служит удобным путем в случае 3-бензазепинонов-2 типа 33 [35, 55, 56]:
Схема 14
|
Cl |
|
|
R1 |
R2O |
|
R1 R2 |
R3 |
NH hν, Hg-лампа 200 W R3 |
||
|
|
Ar, 27 ч |
NH |
MeO |
|
MeO |
|
|
|
||
|
|
|
O |
32 |
|
|
33 |
R1 = Ar, R2 = H; R1+R2 = |
; R3 = NMe2, OMe |
||
Избранные методы синтеза и модификации гетероциклов, том 1 |
51 |
Реакция амидов 34 с оксалилхлоридом (60°C, SnCl4 или TiCl4) дает гомопротоберберины 35 с умеренными выходами [57]. Введение в кольцо А метокси-групп благоприятствует циклизации (схема 15):
Схема 15
H |
O |
R1 |
|
|
|
|
N |
A |
B |
|
O |
||
|
|
N |
||||
R1 |
(COCl)2 |
R1 |
||||
|
C |
O |
||||
|
к-та Люиса |
|
|
|||
|
|
|
|
|||
R1 |
|
|
|
|
||
R2 |
|
|
D |
|
||
|
R2 |
|
|
|
||
|
|
|
|
|
||
34 |
|
35 |
R2 |
|
R2 |
|
R1, R2 = H, OMe |
|
|
|
|||
|
|
|
|
|
2. Формирование C1–C2 связи
В ранних работах стратегия раскрытия кольца N-бензилизохинолиниевых солей с последующей циклизацией в бензазепины была успешно применена к синтезу реадиновых алкалоидов [58], и с тех пор не потеряла значения. Химики из Таиланда [59] модифицировали синтез изоиндоло[2,3-b]-3-бензазепиновых алкалоидовпоДанишефскому[60], применив этиловый эфир 6-хлорметил-2,3-диметокси- бензойной кислоты вместо хлорангидрида этилового эфира 3,4-диметокси- фталевой кислоты (схема 16). Соль иминия 36 без выделения обрабатывали KOH или NaOH и получали дегидроленноксамин 37 с выходами соответственно 73 и 58%. Реакция проходит через интермедиаты 38 и 39 типа котарнина (схема 16).
Схема 16
N |
O |
|
|
|
|
|
|
|
|
|
|
|
O |
MeCN |
O |
|
HO− |
|
+ |
|
|
+ |
|
|
Cl O |
|
O |
N |
O |
|
|
|
|||
|
|
Cl |
|
OEt |
|
|
OEt |
|
|
||
|
|
|
|
OMe |
|
|
OMe |
|
|
|
|
|
|
|
|
OMe |
|
|
OMe |
|
|
36 |
|
|
|
|
|
52 |
Серия монографий InterBioScreen |
O |
|
MeO |
OMe |
|
|
O |
|
O |
N |
|
|
O |
|
||
|
N |
||
|
OH |
OEt |
|
|
|
||
|
|
|
|
|
|
O |
|
|
|
OMe |
|
|
OMe |
O |
CHO |
|
38 |
|
39 |
O |
|
N |
O |
|
|
||
O |
|
|
|
|
|
OMe |
|
|
|
|
|
|
37 |
|
OMe |
|
|
|
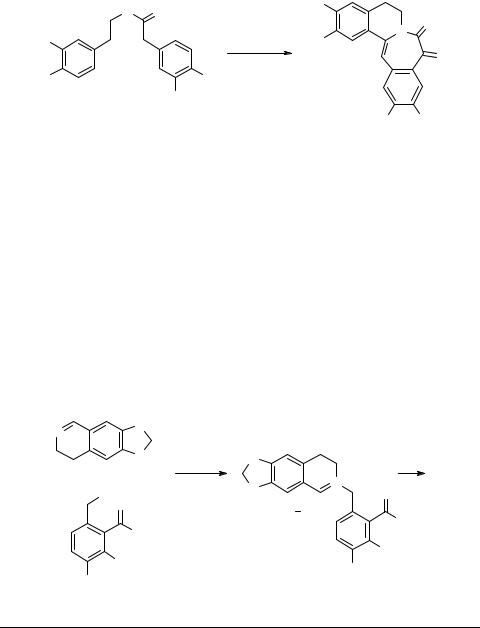
Падва синтезировал 3-бенздиазепины путем [1,2]-перегруппировки Стивенса аммонийного илида 40 (схема 17) [61, 62]. Фактически это пример расширения изохинолинового цикла до бенздиазепинового (другие примеры изменения цикла
C6–C7 см. ниже).
Схема 17
|
Cu(acac) |
+ |
|
N |
|
|
N O OEt |
|
|||
|
N |
|
|
||
|
|
− |
|
|
|
R |
N2 |
R |
R |
O |
|
EtO O O |
|||||
|
|
||||
|
O |
40 |
|
|
|
R = Me, CH=CHMe |
|
|
|||
|
|
|
|||
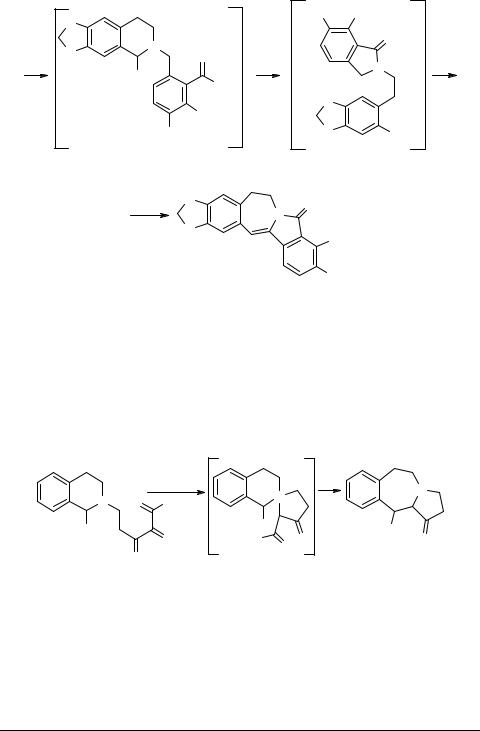
3. Формирование C2–N3 связи
В раннем обзоре Орито по синтезу 3-бензазепинов [2] есть несколько примеров такого рода. Образование связи C2–N3 (схема 18) может происходить, например, в результате дегидратации [63, 64].
Избранные методы синтеза и модификации гетероциклов, том 1 |
53 |
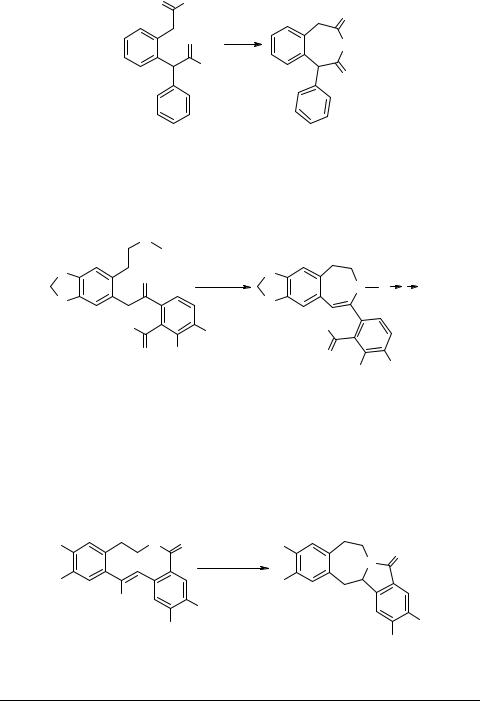
Схема 18
O NH2 |
O |
|
|
||
O |
ПФК |
|
NH |
||
|
||
OH |
O |
|
|
Циклизация амида 41 (схема 19) была использована в синтезе ленноксами-
на 7 [2]:
Схема 19
H
N
O |
O |
1N NaOH |
O |
7 |
|
N |
|||
O |
|
∆ |
||
|
O |
|
||
|
HO |
OMe |
HO |
|
|
|
|
|
|
|
O |
OMe |
O |
OMe |
|
41 |
|
MeO |
|
|
|
|
|
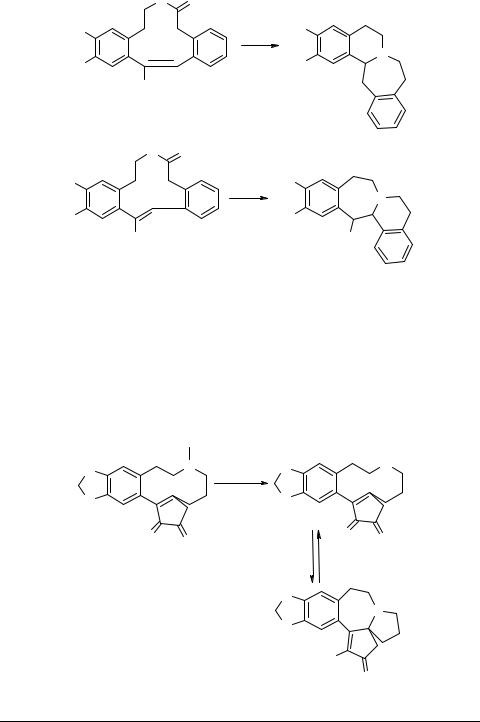
Неожиданная трансаннулярная циклизация 10-членного лактама под действием фторид-иона приводит к изоиндоло[1,2-b][3]бензазепину 42 [65, 66]. Восстановление 11- и 12-членных гомологов ведет также к [6,7]-трансаннулярной циклизации, давая в итоге два изомерных гомопротоберберина 43 и 44, в зависимости от конфигурации (Z или E) исходного соединения (схема 20) [67]:
Схема 20
|
H |
O |
Bu4NF/AcOH R1 |
|
|
R1 |
N |
|
O |
||
|
|
|
|
|
N |
R1 |
|
|
R1 |
|
|
|
SiMe3 |
|
R2 |
|
|
|
|
|
|
R2 |
|
|
|
R2 |
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
42 |
|
|
|
|
|
|
54 |
Серия монографий InterBioScreen |
H |
O |
|
|
|
N |
|
|
|
|
MeO |
i, ii |
MeO |
|
|
|
|
|
|
|
MeO |
|
MeO |
N |
43 |
|
|
|
SiMe3
H |
O |
|
|
N |
|
|
|
MeO |
i, ii |
MeO |
|
|
|
N |
44 |
MeO |
|
MeO |
|
|
|
||
SiMe3 |
|
Me3Si |
|
i- BH3, SMe, ТГФ, кипячение
ii- TMEDA, CH2Cl2 /Et2O, 20°C
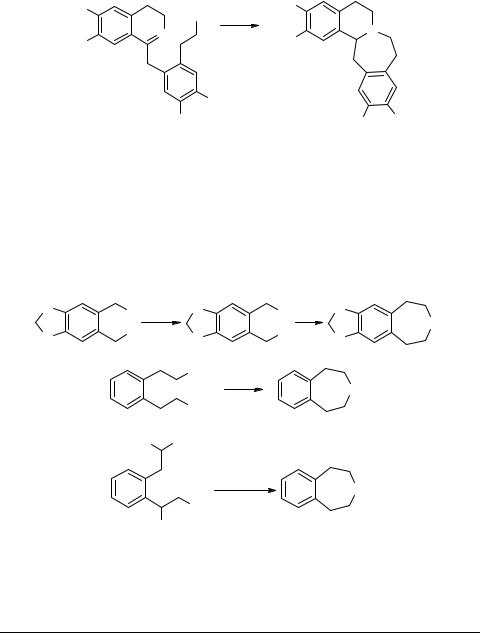
Внутримолекулярное присоединение в макроциклических аминоенонах 45, 46 было положено Мариано в основу стратегии синтеза цефалотаксина (схема 21). Следует отметить, что в случае X = H2 было обнаружено быстрое равновесие между еноном 45 и его циклической формой 47 [68], что делало невозможным выделение продукта 47. Другое целевое соединение 48, напротив, было выделено с выходом 50% (схема 21).
Схема 21
|
Boc |
|
H |
|
|
|
|
O |
N TMSOTf |
O |
N |
O |
|
O |
|
|
|
45, 46 |
|
O |
X |
O |
X |
|
|
O |
N |
|
|
O |
|
|
|
|
|
45, 47 |
X = H2 |
HO |
|
47, 48 |
X |
||
46, 48 |
X = O |
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
55 |
Описано замыкание кольца 3-бензазепина при восстановлении замещенного изохинолина (реакция, хорошо известная в химии 3,4-дигидроизохинолинов, (схема 22) [69].
Схема 22
MeO |
Cl |
MeO |
|
|
|
NaBH4 |
N |
||
MeO |
N |
MeOH MeO |
||
|
||||
|
|
OMe |
|
|
|
OMe |
MeO |
OMe |
4. Образование связей C2–N3 и N3–C4
Одновременное замыкание двух связей бензазепинового кольца, возможное в силу симметрии молекулы, представляет синтетический интерес и поэтому реализовалось многими авторами [70–72] (схема 23):
Схема 23
O |
Cl NaCN |
O |
CN |
[H] O |
|
O |
Cl |
O |
CN |
NH |
|
O |
|||||
|
|
||||
|
|
NH2 Ac2O |
|
NAc |
|
|
|
|
|
||
|
|
NH2 |
|
|
|
|
MeO |
OMe |
|
|
|
|
|
Zn пудра |
|
NH |
|
|
|
2N HCl |
|
||
|
|
|
|
||
|
Ph |
NO2 |
(42−48%) |
||
|
|
||||
В одном из подходов в качестве источника азота были использованы фосфазены (схема 24) [73]. Выходы 2-хлор-3-алкил-бенз[3]азепинов 49 составляют 25% (R = Ph), 30% (R = PhCH2) и 42% (R = CH2COOEt).
56 |
Серия монографий InterBioScreen |
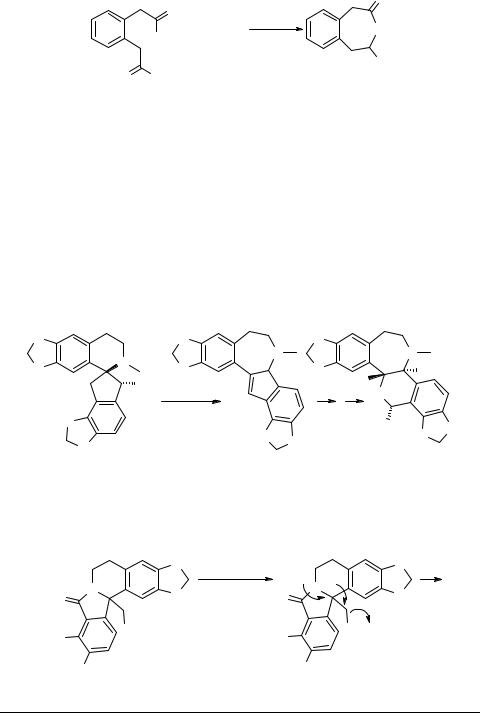
Схема 24
|
O |
O |
|
бензол, ∆ |
|
Cl |
+ Ph3P=NR |
NR |
|
12 ч |
|
O Cl |
|
Cl |
|
49 |
5. Реакции расширения цикла C6–C7
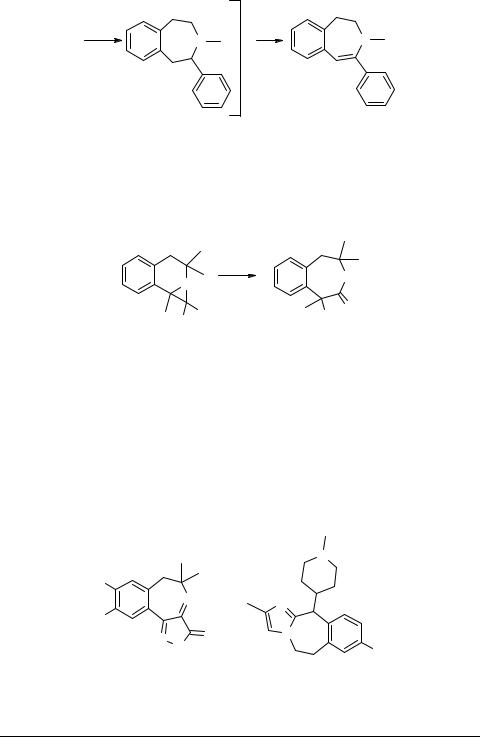
Реакции расширения цикла представляют особый интерес ввиду того, что, разработанные для 3-бензазепинов, они могут быть применены для синтеза бензазоцинов [74], бензазонинов и т.д. В данном разделе можно снова привести некоторые из превращений, описанных выше, например, перегруппировки Пемеррера ([53], схема 13) и Стивенса ([61, 62], схема 17). Спироизохинолин 50 был использован как предшественник в синтезе алкалоида альпинигенина 51 (схема 25) [75], относящегося к реадиновым алкалоидам (к этому же семейству относятся алкалоиды порфироксин 8 [8] и альпинин 9 [9]; имеется обзор по синтезу алкалоидов данного класса [76]).
|
|
|
|
Схема 25 |
|
O |
|
O |
O |
N |
|
|
N |
N |
O |
|
|
O |
O |
H |
|
||
|
|
||||
|
|
OH MeSO Cl |
H |
|
|
|
|
2 |
O |
|
|
O |
|
Et3N, ТГФ |
HO |
|
O |
|
O |
O |
|||
|
|
||||
O |
|
O |
|
||
50 |
|
|
|
||
|
|
51 |
|
||
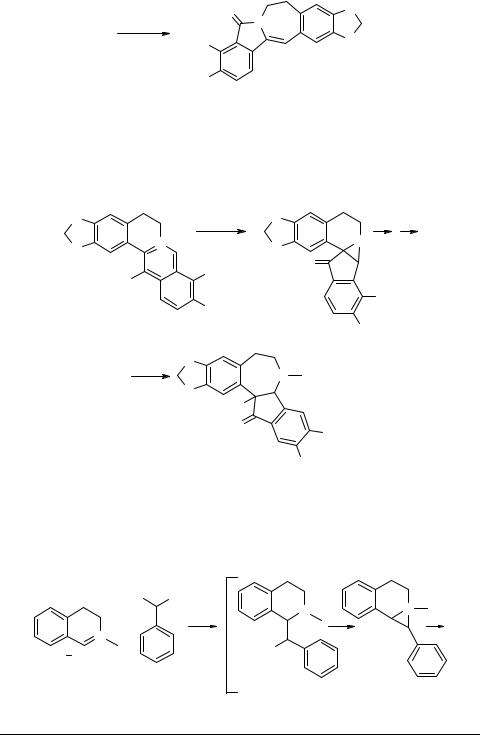
Недавно сообщалось об использовании в реакции расширения цикла ацилиминиевых солей (схема 26) [77].
Схема 26
|
|
O |
SO2Cl2 |
|
|
O |
|
O |
N |
O |
CHCl3 |
/Py (4:1) |
O |
N |
O |
|
Et3N (5 экв.) |
|
|||||
|
|
|
|
|
|
||
MeO |
|
OH |
|
MeO |
|
OSO2Cl |
|
|
|
|
|
|
|||
MeO |
|
|
|
|
MeO |
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
57 |
O |
O |
|
N |
MeO |
O |
MeO
Расширение цикла в ряду солей неооксиберберина 52 (схема 27) может быть легко осуществлено как в условиях восстановления [71], так и в условиях кислотного гидролиза [78, 79]. Авторы предполагают прохождение реакции через интермедиат 53.
Схема 27
O |
|
10% HCl |
O |
|
O |
N+ |
20−70°C |
O |
N |
|
|
O |
||
|
− |
OMe |
|
|
|
|
|
||
|
O |
|
|
|
OMe
|
OMe |
52 |
OMe |
53 |
O
N
O
HO
O OMe
OMe
Карбен, образующийся из 54, атакует катион 2-метил-3,4-дигидроизохино- лина, образуя 3-бензазепин 55 с выходом 53% после перегруппировки и расширения цикла в интермедиате 56 (схема 28) [80]:
Схема 28
Br |
SiMe3 |
N |
+ |
N+ + |
CsF |
N |
|
|
|
||
ТГФ |
Br |
|
|
I |
|
|
|
|
|
|
|
|
54 |
56 |
|
58 |
Серия монографий InterBioScreen |
N |
N |
+ |
−H+ |
|
55 |
Расширение цикла 1,1-дихлор-1,3,4,8b-тетрагидроазирино[2,1-a]изохинолина с расщеплением связи C–N (схема 29) приводит к 1-хлор-1,4,4-триметил-2,3,4,5- 1H-3-бензазепинону-2 (57) [81, 82]:
Схема 29
|
H2O |
N |
NH |
|
Cl |
Cl |
Cl O |
|
57 (49%) |
|
|
|
Опубликованное недавно сообщение об образовании в числе прочих веществ 3-бензазепинов при перегруппировке илидов 2-метил-1,2,3,4-тетрагидроизохино- линия [83] имеет меньшую препаративную ценность.
В некоторых случаях реакции расширения цикла приводят к гетероаннелированным 3-бензазепинам, например, недавно Шкляевым описан оригинальный способ синтеза пиразоло[3,4-а][3]бензазепинов 58 [84]. Среди подобных гетероциклических систем, имидазо[2,1-b][3]бензазепины 59 обладают высокой антиаллергической активностью (схема 30) [85].
Схема 30
|
|
N |
|
R |
|
|
|
R |
N |
N |
|
O |
N |
||
N |
|||
N |
Cl |
||
|
H |
||
|
59 |
||
58 |
|||
R = H, OMe
Избранные методы синтеза и модификации гетероциклов, том 1 |
59 |
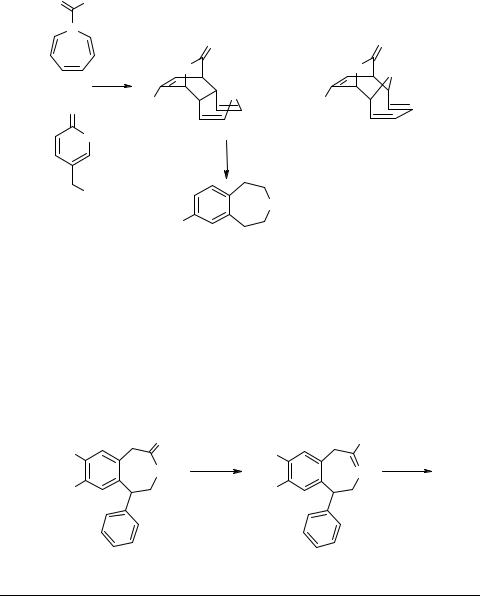
В заключение отметим имеющий скорее теоретическое, чем практическое значение способ формирования бензольного кольца 3-бензазепина 62 (схема 31) по реакции Дильса–Альдера: метиловый эфир α-пирон-5-карбоновой кислоты медленно (5 дней в кипящем толуоле) присоединяется к 1H-азепину с образованием аддуктов 60 (выход 25%) и 61 (выход 20%). Последующее нагревание (7 дней в кипящем толуоле) приводит к экструзии CO2 из аддукта 60 с образованием 3-бензазепина 62 [86].
Схема 31
O OEt
N
|
|
O |
|
|
O |
+ |
∆ |
O |
|
O |
NCO2Et |
|
|
Et + |
|||
|
|
NCO |
|
||
O |
MeO2C |
|
2 |
MeO2C |
|
|
|
|
|||
O |
|
60 |
|
61 |
|
|
|
∆ |
−CO2 |
|
|
O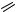 OMe
OMe
NCO2Et
MeO2C
62
Химические свойства 3-бензазепинов
Как ароматические соединения, 3-бензазепины вступают в реакции хлорметилирования [70] и нитрования [71]. Как амины, 2,3,4,5-тетрагидро-1H-3-бензазепины легко алкилируются [87, 88] и ацилируются [70, 89] по атому азота; восстановление 4,5-дигидро-3H-3-бензазепинов различными восстановителями приводит к 2,3,4,5-тетрагидро-1H-3-бензазепинам [64, 65]. Известным путем могут быть получены иминоэфиры 63 и амидразоны 64 (схема 32) [63].
Схема 32
MeO |
O |
|
MeO |
OEt |
|
BF3 |
OEt2 |
NHR1R2 |
|||
|
|
||||
|
NH |
|
|
N |
|
MeO |
|
|
MeO |
|
63
60 |
Серия монографий InterBioScreen |
