
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf
Схема 11
|
|
|
|
Ph |
10 МПа, Н2 |
|
Ph |
|
Ph |
||
BF4− |
|
|
|
|
|
|
|
|
|
||
|
|
+ |
|
|
Ni ск., 120°C |
+ |
R |
|
|||
|
|
|
|
|
|
|
|
|
|||
Ph |
|
|
|
R |
NaOH |
Ph |
N Ph |
||||
|
|
|
|||||||||
|
|
|
N |
|
N R |
O |
|||||
|
|
n |
( ) |
OH |
|
|
n( ) |
|
|
||
|
|
|
|
|
OH |
|
|
||||
|
26, 27, 28 |
|
|
|
29, 30, 31 |
|
32, 33 |
||||
26, 27, 32 |
R = Ph; 27, 30, 33 |
R = Et, n = 2; 28, 31 |
R = Ph, n = 3 |
||||||||
Аналогично протекает восстановление гетерокольца в ряду тетрафторборатов N-гидроксиэтил-5,6,7,8-тетрагидрохинолиния 34, 35 [44] и тетрагидроизохинолиния 38 в 39 [30] (схема 12):
Схема 12
R |
|
RNH2 , 10 МПа, Н2 |
H |
R |
|
|
|
|
|
|
|
|
R |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
Ni ск., 120°C |
|
|
+ |
|
|
|
|
|
||||||||
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
NaOH |
|
|
|
|
|
|
|
||||||||||
|
Ph |
H N |
|
Ph |
|
|
|
|
N Ph |
||||||||||
− N |
|
|
|
|
|
|
|
|
|
O |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
BF4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
34, 35 |
OH |
|
|
|
|
|
|
36, 37 |
OH |
|
|
|
14 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
34, 36 R = Ph; 35, 37 R = 4-MeOC6H4 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
Ph |
|
10 МПа, Н |
|
|
|
|
|
|
Ph |
|
|
|||||
|
|
|
N + |
|
2 |
|
|
|
|
|
|
|
N+ |
|
|
|
|
||
|
− |
|
Ni ск., 140°C |
|
|
|
− |
|
|
|
|
|
OH |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
ClO4 |
|
|
OH |
|
ClO4 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
38 |
|
|
|
|
39 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Восстановление перхлората, иодида, тозилата изохинолиния 40 в растворе метанола на диоксиде платины протекает избирательно по гетерокольцу с образованием соли 2-гидроксициклогексил-1,2,3,4-тетрагидроизохинолиния 41 [42] (схема 13):
Избранные методы синтеза и модификации гетероциклов, том 1 |
71 |
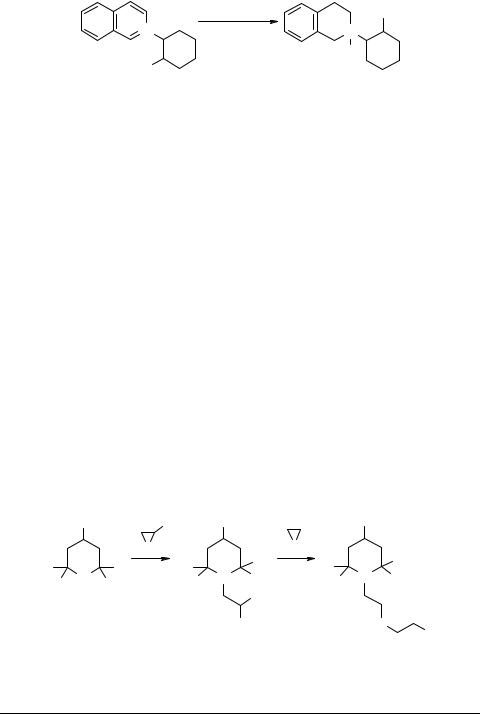
Схема 13
N+ |
Н2, 1−4 атм |
OH |
PtO2, 25−60°C |
N+ |
|
A− |
|
A− H |
HO |
|
41 |
40 |
|
A = OTs, I, ClO4
Таким образом, для каталитического восстановления пиридиниевых солей и их конденсированных производных, содержащих гидроксиалкильные заместители при атоме азота, могут быть использованы различные катализаторы – оксид и диоксид платины, палладий на угле, никель скелетный, никель модифицированный рутением. В реакцию с одинаковым успехом вводились различные соли: хлориды [40], бромиды [41], иодиды, тозилаты, перхлораты [42], тетрафторбораты [44]. Этот метод позволяет осуществить стереонаправленный синтез N-гидрокси- алкилпипиридинов, недоступных через каталитическое алканоламинирования 1,5-дикетонов.
Гидроксиалкилирование пиперидинов и их конденсированных аналогов
Одним из методов синтеза N-гидроксиалкилзамещенных пиперидинов и их конденсированных аналогов является модификация N-незамещенных насыщенных азагетероциклов посредством гидроксиалкилирования. Для этих целей широко используют окись этилена или окись пропилена.
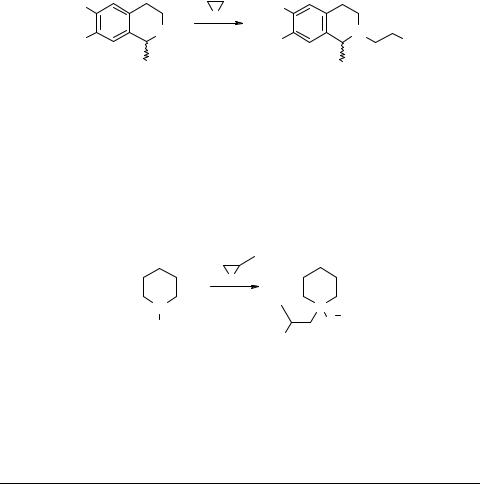
Запатентован способ получения N-гидроксиалкилзамещенных пиперидинов 43, 44, содержащих в положении 4 фрагмент пирролидина, пиперидина и пиперазина путем действия окиси этилена, пропилена на пиперидиновые основания 42. Соединения 43, 44 обладают седативным, снотворным и успокаивающим действием [45]. Реакцию проводят в среде метанола при комнатной температуре
(схема 14):
Схема 14
|
R3 |
R |
|
R3 |
|
R = H |
|
R3 |
|
|
|
|
O |
|
|
R2 |
O |
|
|
|
R2 |
R4 |
|
R2 МеОН |
R4 |
|
МеОН |
R4 |
|
|
||
N |
N |
N |
|
R1 |
||||||
R5 |
R1 |
R5 |
R1 |
|
R5 |
|
||||
H |
|
R |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
42 |
|
|
43 |
OH |
|
|
44 |
O |
OH |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
R = H, Me, Ph; R1 = R2 = R4 = R5 = H, Me;
R3 = пирролидинил, пиперидинил, морфолинил
72 |
Серия монографий InterBioScreen |
При действии избытка окиси этилена протекает оксиалкилирование по гидроксильной группе N-(2-гидроксиэтил)пиперидина 43 с последующим образованием аминоэфироспиртов 44.
Применение окисей пропилена и фенилпропилена в качестве гидроксиалкилирующего агента приводит к N-замещенным пиперидинам 43, содержащим гидроксигруппу при вторичном углеродном атоме. Эпоксидный цикл раскрывается со стороны первичного углеродного атома.
N-Гидроксиэтилирование транс-декагидрохинолина [46], 1,2,3,4-тетрагидро- изохинолина [46], пергидроакридина [10], 1,5-диаза-бис-цикло[4,4,0]декана [47] окисью этилена протекает аналогично.
Гидроксиэтилирование алкалоидов сальсолина, сальсолидина 45 приводит к производным 46 с высоким выходом [46].
Схема 15
RO |
|
O |
RO |
|
|
|
|
|
|
|
|
MeO |
NH |
MeOH |
MeO |
N |
OH |
|
|
|
|||
|
45 |
|
|
46 |
|
R= H (сальсолин), R = Me (сальсолидин)
Вреакцию с оксиранами вступают также и N-гидроксипроизводные аминов. Например, N-гидроксипиперидин 47 взаимодействует с окисью пропилена, образуя цвиттер-ионную систему 48 [48] (схема 16):
Схема 16
O |
|
MeOH |
+ |
N |
N |
OH |
O |
|
HO |
47 |
48 |
Еще одним методом синтеза N-гидроксиалкилпиперидинов 51 может служить окисление N-винилпиперидинов 49 перекисью водорода с дальнейшим восстановлением эпоксидов 50 дибораном [46] (схема 17):
Избранные методы синтеза и модификации гетероциклов, том 1 |
73 |
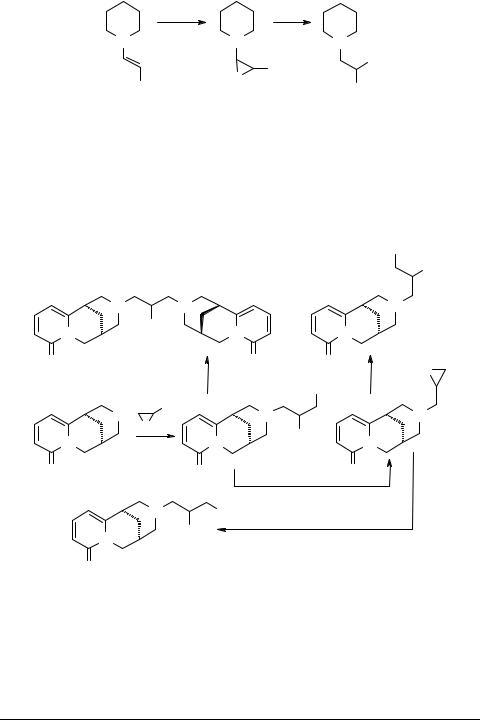
Схема 17
|
H2O2 |
|
B H |
6 |
|
|
|
2 |
|
N |
ТГФ |
N |
|
N |
(диглим) |
|
|||
|
|
|
R |
|
|
|
|
R |
|
|
|
O |
|
|
|
R |
|
OH |
|
49 |
50 |
|
||
|
|
51 |
R = Me, Et, Me2
В указанном направлении реакция протекает в апротонных растворителях, таких, как тетрагидрофуран и диглим. В протонных же растворителях (этанол) проходит восстановление этиленовой связи с образованием N-алкилзамещенных пиперидинов.
Схема 18
|
|
|
|
R |
|
|
|
|
|
OH |
|
N |
N |
|
|
N |
|
N |
OH |
N |
|
N |
|
|
|
||||
O |
56 |
O |
O |
57, 58 |
|
|
O |
||||
|
|
52 |
|
||
|
|
Cl |
NHR2 |
||
|
|
|
|
||
NH |
CH2Cl |
N |
|
N |
|
O |
OH + |
||||
|
|
|
|||
N |
|
N |
N |
||
|
|
||||
O 52 |
|
O 53 |
KOH O 54 |
||
N |
OH |
N |
OH |
|
|
O 55 |
R = пиперидинил, Et |
|
Взаимодействие алкалоида цитизина 52 с эпихлоргидрином изучено в работе [49]. Показано, что реакция может протекать по двум альтернативным направлениям – с раскрытием эпоксидного цикла, либо с замещением атома хлора. При этом образуются производные цитизина 53 и 54 с преобладанием последнего.
При кипячении спиртового щелочного раствора N-(2-гидрокси-3-хлорпро- пил)цитизина 53 протекает дегидрохлорирование с образованием N-(2,3-гидрокси-
74 |
Серия монографий InterBioScreen |

пропилен)цитизина 54. Сопутствующим продуктом является продукт гидролиза N-(2,3-дигидроксипропилен)цитизин 55 (схема 18).
Взаимодействие 53 и 54 с цитизином, пиперидином и диэтиламином приводит к N,N'-дицитизил-2-гидроксипропану 56, N-(2-гидрокси-3-пиперидилпропил)цити- зину 57 и N-(2-гидрокси-3-диэтиламинопропил)цитизину 58, соответственно.
В заключение отметим, что представленный материал демонстрирует широкие возможности каталитических методов для синтеза замещенных пиперидинов и цикланопиперидинов, содержащих при атоме азота фармакофорные гидроксиалкильные группы.
Экспериментальная часть
Контроль за ходом реакций, состав реакционных смесей, определение индивидуальности выделенных продуктов и их строения осуществляли методами ТСХ, ИК-, ЯМР- 1Н и 13С спектроскопии.
ТСХ проводили на пластинках Silufol UV-254; элюенты: гексан–эфир–хлоро- форм (3 : 1 : 1), проявитель – пары иода.
ИК-спектры записаны на спектрометрах Specord M80 (кристаллы КBr) в тонком слое для жидких веществ и в виде суспензии в гексахлорбутадиене и вазелиновом масле для кристаллических соединений. Спектры ЯМР 1Н и 13С – на приборах Varian FT-80A, Bruker DPX-200 при 20–25°С (CDCl3, ДМСО-d6).
Ниже на конкретных примерах приводятся типовые методики синтезов.
Гидроалканоламинирование 1,5-дикетонов
Битартрат N-3-гидроксипропилпергидроакридина [30]. В автоклав емкостью
150 мл помещают 0.02 моль метиленбисциклогексанона 1, 0.02 моль пропаноламина, 80 мл этанола, 1 г катализатора Ni Ренея. Начальное давление водорода 10 МПа, температура 100°С. Реакция заканчивается через 5–10 часов после поглощения рассчитанного количества водорода (0.04 моль). Гидрогенизат отделяют от катализатора, растворитель отгоняют при пониженном давлении, остаток, представляющий масло, кипятят с концентрированным спиртовым раствором винной кислоты (в мольном отношении 1 : 1). Кислый тартрат N-3-гидрокси- пропилпергидроакридина кристаллизуется в виде смеси цис-син-цис и цис-анти-
цис изомеров. Выход 78%. Бесцветные гигроскопичные кристаллы с Тпл 54–56°С
(этанол). Спектр ЯМР 13С (СDCl3, δ, м.д.). Цис-анти-цис: 28.86 (С1, С8), 22.97 (С2, С7), 22.97 (С3, С6), 25.33 (С4, С5), 31.21 (С9), 31.81 (С8а, С9а), 57.13 (С4а, С10а), 47.71,
27.68, 58.90 (гидроксипропил). Цис-син-цис: 32.39 (С1, С8), 22.38 (С2, С7), 26.33 (С3, С6), 26.50 (С4, С5), 27.09 (С9), 35.34 (С8а, С9а), 59.48 (С4а, С10а), 47.71, 27.68, 58.31
(гидроксипропил). Найдено, %: С 59.95, Н 9.50, N 3.75. С20Н35NO7. Вычислено, %:
С 59.85, Н 8.73, N 3.49.
N-2-Гидроксиэтилпергидроакридин (2) [10]. К раствору 0.05 моля КВН4 и
0.5 моля этаноламина в 25 мл воды и 20 мл спирта прибавляют в течение получаса по каплям при перемешивании раствор 0.05 моля метиленбисциклогексанона 1 в
Избранные методы синтеза и модификации гетероциклов, том 1 |
75 |

40 мл спирта. Температуру смеси держат в пределах 30–35°С. После прибавления дикетона реакционную массу перемешивают полчаса, подкисляют конц. НС1, экстрагируют нейтральные вещества эфиром, водный слой подщелачивают, экстрагируют основание эфиром, экстракт сушат над сульфатом магния, удаляют эфир. Остаток перекристаллизовывают, выделяют продукт 2. Выход 25%,
Тпл 113.5–114°С (петролейный эфир). Найдено, %: С 76.3, Н 11.5, N 6.1. С15Н27NO. Вычислено, %: С 75.9, Н 11.5, N 5.9.
N-2-Гидроксиэтил-2,4-дифенилпергидрохинолин (15).
(а) В круглодонную колбу объемом 100 мл помещают 0.01 моля дикетона 13 (Ar = Ar' = Ph), 0.015 моля этаноламина в 40 мл этанола с добавлением 2–4 капель концентрированной соляной кислоты. Смесь кипятят 4–6 часов с обратным холодильником до исчезновения дикетона (контроль по ТСХ). При охлаждении реакционной смеси кристаллизуется оксазологидрохинолин 14. Выход 74%. Бесцветные кристаллы с Тпл 122–124°С (этанол).
(б) В автоклав емкостью 150 мл помещают 70 мл этанола, 0.012 моля соединения 14 (Ar = Ar' = Ph, n = 2) и скелетный никель (10% от массы соединения 14). Начальное давление водорода 10 МПа, температура 120°С. После поглощения 0.024 моля водорода гидрогенизат отфильтровывают от катализатора, обрабатывают 5% раствором гидроксида натрия до рН 8–9. Полученное основание 15 трижды экстрагируют эфиром (по 50 мл), очищают при помощи хроматографической колонки диаметром 20 мм, длиной 250 мм, заполненной силикагелем 40/100, элюент: гексан–диэтиловый эфир 3 : 1. Выход 80%. Светло-желтое масло с
Rf 0.355 (Silufol Uv-254, гексан–эфир–ацетон 3 : 1 : 1). ИК-спектр (ν, см–1) 3300 (ОН), 3080, 3062, 702, 764 (СН аром), 2992, 2884 (СН алиф). Спектр ЯМР 13С (СDCl3, δ, м.д.). 51.03 (С2), 33.61 (С3), 33.71 (С4), 28.67 (С4a), 19.50 (С5), 26.07 (С6), 24.17 (С7), 47.13 (С8), 46.07 (С8a), 49.39, 61.10 (гидроксиэтил). Найдено, %: С 82.21, Н 8.76, N 4.42. С23Н29NO. Вычислено, %: С 82.39, Н 8.66, N 4.18.
Гидроаминирование солей пирилия
N-2-Гидроксиэтил-2-метил-4,6-дифенилпиперидин (18). В автоклав объемом
150 мл помещают 0.013 моля тетрафторбората пирилия 16, 0.026 моля этаноламина, 80 мл этанола, катализатор Ni/Ru (10% от массы исходной соли). Начальное давление водорода 10 МПа, температура 100°С. После поглощения 0.039 моля водорода гидрогенизат отфильтровывают от катализатора, растворитель отгоняют. Основание 18 очищают на хроматографической колонке диаметром 20 мм, длиной 250 мм, заполненной силикагелем 40/100, элюент гексан–эфир 3 : 1. Выход 63%. Бесцветные кристалы с Тпл 119–120°С (этанол). ИК-
спектр (ν, см–1) 3340 (ОН), 3080, 3060, 704, 760 (СН аром), 2996, 2884 (СН алиф). Спектр ЯМР 13С (СDCl3, δ, м.д.). 58.28 (С2), 41.85 (С3), 43.40 (С4), 42.16 (С5), 68.28 (С6), 22.01 (СН3), 52.70, 59.23 (гидроксиэтил). Найдено, %: С 81.05, Н 8.69, N 4.52. С20Н25NO. Вычислено, %: С 81.31, Н 8.53, N 4.74.
76 |
Серия монографий InterBioScreen |

Гидрирование солей пиридиния
N-2-Гидроксиэтил-2-фенил-4-(4-метоксифенил)пергидрохинолин (37) [44].
В автоклав объемом 150 мл помещают 70 мл этанола, 0.012 моля тетрафторбората пиридиния 35 и катализатор Ni-ск. (10% от массы исходной соли). Начальное давление водорода 10 МПа, температура 100–120°С. После поглощения 0.036 моля водорода гидрогенизат отфильтровывают от катализатора, обрабатывают 5% раствором гидроксида натрия до рН 8–9, полученное основание 36 трижды экстрагируют эфиром (по 50 мл), очищают на хроматографической колонке диаметром 20 мм, длиной 250 мм, заполненной Al2O3 третьей степени активности, элюент: гексан–диэтиловый эфир 3 : 1. Выход 75%. Светло-желтое масло с Rf 0.295 (Silufol Uv-254, гексан–эфир–ацетон 3 : 1 : 1). ИК-спектр (ν, см–1) 3320 (ОН), 3082, 3066,
702, 764 (СН аром), 2994, 2880 (СН алиф). Спектр ЯМР 13С (СDCl3, δ, м.д.). 53.26 (С2), 33.80 (С3), 35.96 (С4), 28.72 (С4a), 19.57 (С5), 26.09 (С6), 24.82 (С7), 46.98 (С8),
46.30 (С8a), 54.89 (OCH3), 48.46, 61.05 (гидроксиэтил). Найдено, %: С 78.64, Н 8.15, N 4.05. С24Н31NO2. Вычислено, %: С 78.90, Н 8.55, N 3.84.
Гидроксиалкилирование пиперидинов
N-2-Гидроксиэтилпергидроакридин (2) [10]. Через раствор 0.02 моля пергидро-
акридина в 20 мл 75% спирта в течение 1.5 часа пропускают окись этилена. Через сутки отгоняют растворитель, а остаток перекристаллизовывают из петролейного эфира. Получают 3.3 г соединения 2, Тпл 113–114°С.
Литература
1.Каримов М., Левкович М.Г., Леонтьев В.Б. и др., Хим. прир. соед. 1974 (4) 486.
2.Примухамедов И., Асланов Х.А., Садыков А.С., Узб. хим. журн. 1969 (4) 57.
3.Зупарова К.М., Мухамеджанов Р.С., Далимов Д.Н., Абдувахабов А.А.,
Докл. АН Узб. ССР 1983 (5) 31.
4.Nardi D., Leonardi A., Pennini R., et al., Arzneim.-Forsch. 1993 43 (1) 28.
5.Некрасова В.А., Шуйкин Н.Н., Успехи химии 1965 34 (11) 1945.
6.Якушкин М.И., Химическая промышленность 1966 (7) 13.
7.Клюев М.В., Хидекель М.Л., Успехи химии 1980 49 (1) 28.
8.Кривенько А.П., Николаева Т.Г., Харченко В.Г., ХГС 1987 (4) 435.
9.Химия пяти-, шестичленных N-, O-содержащих гетероциклов, под ред. Кривенько А.П., Саратов: Изд-во Сарат. ун-та, 1997.
10.Высоцкий В.И., ХГС 1970 (9) 1236.
11.Watanabe J., Chim S.Ch., Mitsudo T., Chem. Lett. 1975 (9) 995.
12.Chrzaszczewska A., Starski H., Acta Chim. 1970 (15) 37.
13.Cannon J.G., Rose J.G., Nerland D.E., Darco L.L., J. Heterocycl. Chem. 1969 6
(5) 747.
14.Казимов Ш.К., Абдувахабов А.А., Асланов Х.А., Садыков А.А., Докл. АН Узб. ССР 1976 (8) 30.
15.Казимов Ш.К., Абдувахабов А.А., Асланов Х.А., Садыков А.А., Докл. АН Узб. ССР 1976 (8) 38.
16.Schumacher W., Engel J., Noessner G., et al., Germ. Patent 1992 0619.
Избранные методы синтеза и модификации гетероциклов, том 1 |
77 |

17.Кривенько А.П., Николаева Т.Г., Восстановительное аминирование в синтезе азагетероциклов, Саратов: Изд-во Сарат. ун-та, 1991.
18.Николаева Т.Г., Решетов П.В., Кривенько А.П., Харченко В.Г., ХГС 1983
(10)1370.
19.Харченко В.Г., Кривенько А.П., Николаева Т.Г., А. с. СССР 939 442, Бюлл.
Изобрет. 1982 (24) 9.
20.Харченко В.Г., Кривенько А.П., Николаева Т.Г., А. с. СССР 1 057 496, Бюлл.
Изобрет. 1983 (44) 24.
21.Кривенько А.П., Николаева Т.Г., Комягин Н.Т., в сб. Нуклеофильные реакции карбонильных соединений, Саратов: Изд-во Сарат. ун-та, 1985, с. 19.
22.Кривенько А.П., Николаева Т.Г., Юдович Л.М., ХГС 1987 (12) 1645.
23.Харченко В.Г., Кривенько А.П., Николаева Т.Г., А. с. СССР 1 010 060, Бюлл.
Изобрет. 1988 (13) 21.
24.Кривенько А.П., Николаева Т.Г., Юдович Л.М. и др., ЖОрХ 1987 23 (5) 1000.
25.Кривенько А.П., Решетов П.В., Голиков А.Г., в кн. Азотистые гетероциклы и алкалоиды, под ред. Карцева В.Г., Толстикова Г.А., М.: Иридиум-Пресс, 2001,
т. 1, с. 369.
26.Кривенько А.П., Николаева Т.Г., Петрова Н.В., ХГС 1999 (7) 929.
27.Николаева Т.Г., Решетов П.В., Кривенько А.П., ХГС 1997 (7) 867.
28.Кривенько А.П., Федотова О.В., Николаева Т.Г., Комягин Н.Т., ХГС 1988
(8)1094.
29.Николаева Т.Г., Петрова Н.В., Сафонова А.А. и др., Хим.-фарм. журн. 1988 32
(3)24.
30.Голиков А.Г., Дисс. канд. хим. наук, Саратов: СГУ, 2000.
31.Tokuyama T., Tsujita T., Shimada A., et al., Tetrahedron 1991 47 (29) 5401.
32.Rylander P.N., CatalyticHydrogenation in Organic Synthesis, Orlando: Academic Press, 1979.
33.Караханов Э.А., Дедов А.Г., Каталитическое гидрирование гетероциклических соединений, М.: Изд-во Московского ун-та, 1986, с. 136.
34.Duling J.N., Charles P., J. Am. Chem. Soc. 1962 84 (4) 578.
35.Григорьева М.Е., Гинсте И.К., Любницкая Г.А., ЖОХ 1960 30 (12) 1031.
36.Григорьева М.Е., Оганесян А.Б., Мышь И.А., ЖОХ 1957 27 (6) 1565.
37.Селлер Р.В., Решетов П.В., Кривенько А.П., ХГС 2001 (7) 867.
38.Селлер Р.В., Решетов П.В., Селлер Т.С., Кривенько А.П., ХГС 2000 (4) 471.
39.Решетов П.В., Селлер Р.В., Кривенько А.П., ХГС 1997 (9) 1279.
40.Hamilton T.S., Adams R., J. Am. Chem. Soc. 1928 50 (8) 2260.
41.Wenkert E., Dave K.G., Haglid F., et al., J. Org. Chem. 1968 33 (2) 747.
42.Newton Hayes F., Carroll King L., Peterson D.E., J. Am. Chem. Soc. 1956 78
(11)2527.
43.Голиков А.Г., Решетов П.В., Кривенько А.П., ХГС 1997 (6) 851.
44.Голиков А.Г., Решетов П.В., Кривенько А.П., ХГС 2001 (10) 1339.
45.Nakanishi M., Kuriyama T., Arimura K., Англ. Патент 1 197 760; РЖХим. 1971
(5)Н361П.
46.Kudo T., Nose A., J. Pharm. Jpn. 1974 94 (11) 1475; РЖХим. 1975 11Ж368.
47.Михлина Е.Е., Янина А.Д., Рубцов М.В., ХГС 1969 (3) 547.
48.Robinson M.M., Pierson W.E., Dorfman L., et al., J. Org. Chem. 1966 31 3206.
49.Примухамедов И., Асланов Х.А., Садыков А.С., Узб. хим. журн. 1969 (4) 57.
78 |
Серия монографий InterBioScreen |
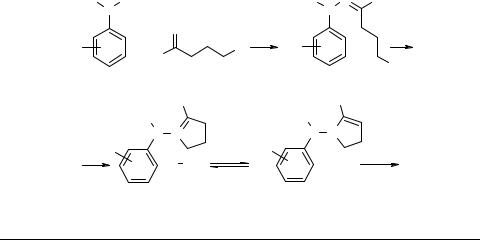
Индолилалкиламины и родственные структуры из γ- и δ-галогенкарбонилов и арилгидразинов
Грандберг И.И.
Московская сельскохозяйственная академия им. К.А. Тимирязева
Как известно, при взаимодействии γ-хлормасляного альдегида с фенилгидразином (80°С, метанол, 8 ч), которое впервые проводилось с целью синтеза 1-фенил- 1,4,5,6-тетрагидропиридазина, вместо ожидаемого продукта был с высоким выходом получен триптамин [1, 2].
Начиная с 1966 г., эта реакция была исследована весьма широко, что привело к разработке простых методов синтеза многих биогенных аминов и других родственных им структур индольного ряда.
Подробное изучение механизма процесса (см. ниже) позволило не только выяснить детали этой весьма интересной реакции, но и перенести полученные результаты на синтез индолов по Фишеру.
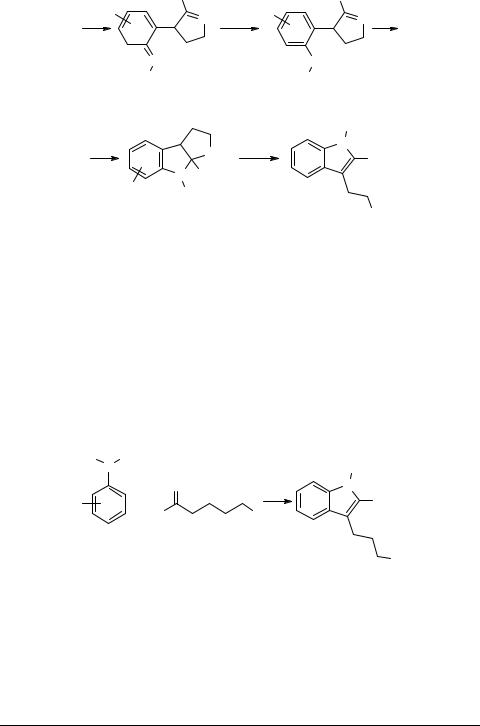
Уже в одной из первых работ [3] была предложена схема процесса (которая приведена ниже), хорошо объясняющая почти все экспериментальные факты. Впоследствии она была детально подтверждена при изучении механизма [4, 5] и оказалась весьма полезной для развития работ в этой области. По этой схеме арилгидразин 1 образует с γ-галогенкарбонильным соединением 2 гидразон 3, циклизующийся в N-анилинопиролин 4. Последний находится в равновесии с енамином 5. По схеме сигматропного [3,3]-сдвига с разрывом связи N–N и завязыванием новой связи С–С енамин 5 превращается в промежуточную систему 6, стабилизирующуюся в орто-замещенный анилин 7, который за счет присоединения группы NHR по активной связи С=N образует производные эзерина 8. Эзерин 8 стабилизируется далее путем β-элиминирования с выбросом протона и размыканием пирролидинового цикла в ароматическую структуру соли триптамина 9.
R2 |
N |
NH2 |
|
R2 |
N |
N |
R3 |
|
|
|
|
|
|
|
|
||
|
|
O |
|
|
|
|
|
|
R1 |
|
+ R3 |
X |
R1 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
2 |
|
|
3 |
|
|
X |
|
1 |
|
|
|
|
|
||
|
|
R3 |
|
R2 |
R3 |
|
|
|
|
|
R2 + |
|
|
|
* |
|
|
|
|
N NH |
|
N N |
|
|
|
|
|
R1 |
|
|
R1 |
* HX |
[3,3] |
|
|
|
|
X |
|
|
|
|
||
|
|
4 |
|
5 |
|
|
|
|
Избранные методы синтеза и модификации гетероциклов, том 1 |
79 |
|||||||
|
R3 |
|
|
R3 |
R1 |
|
N |
R1 |
N |
|
|
|
||
N |
HX |
|
NH HX |
|
R2 |
|
|
|
R2 |
|
6 |
|
|
7 |
|
|
|
|
R2 |
|
|
NH |
|
N |
|
|
|
R3 |
|
|
N |
R3 |
|
|
R1 |
|
HX |
||
R2 |
HX |
|
||
|
8 |
|
|
NH2 |
|
|
|
9 |
|
Триптамины. Варьирование заместителей в ядре арилгидразина или у α-атома азота и использованием γ-хлор (бром, иод) карбонильных соединений, а также этерифицированных толуолсульфокислотой γ-оксикарбонильных соединений не вызывало никаких осложнений при проведении реакции. Выходы колебались, но были не ниже 50% и в большинстве случаев превышали 70% [3, 6–13, 13a].
Гомотриптамины. Использование в реакции δ-галогенкарбонильных соединений также было успешным. Во всех случаях шло гладкое образование 3-(γ-амино- пропил)индолов 10 (гомотриптаминов) [9, 12–14].
R2 |
N |
NH2 |
|
R2 |
|
|
|
||
|
|
O |
|
N |
R1 |
|
+ R3 |
X |
R3 |
|
|
|
||
|
|
|
HX |
|
|
|
|
10 |
NH2 |
Азатриптамины. Использование в этой реакции 2-пиридилгидразина в обычных условиях (80°С) привело к образованию пиридиламинопирола 11a (аналогично промежуточной структуре 5 на общей схеме), который существовал в виде устойчивого димера 11b. Только повышение температуры до 170°С привело к азатриптамину 12 [15, 16].
80 |
Серия монографий InterBioScreen |
