
Карцев В.Г. - Избранные методы синтеза и модификации гетероциклов. Том 1 (2003)(ru)
.pdf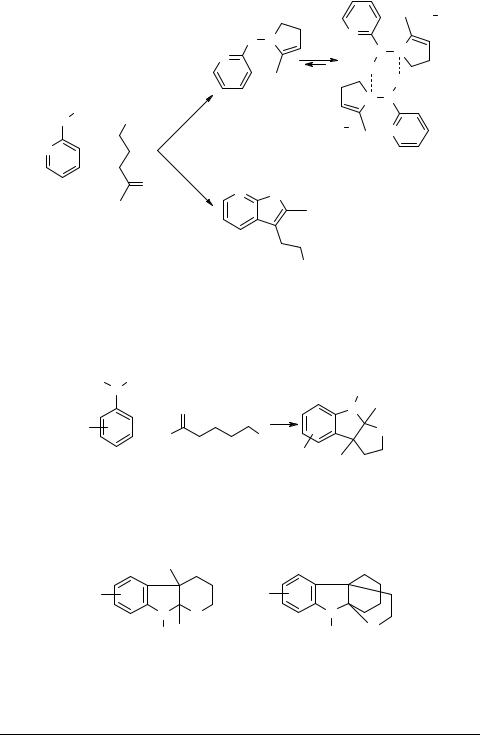
|
|
|
|
H |
N |
Cl |
|
|
|
|
H |
||
|
|
|
|
N N |
||
|
|
|
N |
|
|
N N |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
HCl |
|
H |
|
|
|
|
|
N N |
|
|
NH2 |
|
|
|
|
|
HN |
Cl |
80°C |
11a |
|
H |
|
|
|
Cl |
N |
|||
|
|
|
|
|
||
N |
|
|
|
|
|
|
+ |
|
|
|
|
11b |
|
|
|
170°C |
|
|
|
|
|
|
O |
H |
|
|
|
|
|
N |
|
|
||
|
|
|
N |
|
|
HCl
12 NH2
Эзериновые структуры. Применение в реакции α-алкилзамещенных γ-галоген- кетонов останавливало процесс на стадии образования эзериновых структур 13 (типа 8 на общей схеме), так как в этом случае система не могла стабилизироваться с образованием индола [17–20].
R2 |
N |
NH2 |
|
R2 |
|
|
|
||
|
|
+ R3 |
O |
N |
R1 |
|
X |
NH |
|
|
|
|||
|
|
|
R1 |
HX |
|
|
|
|
13 |
Гомоэзеролиновые структуры 14 [21] и производные эхиболина 15 также легко и с хорошими выходами получались при использовании соответствующих галогенкарбонильных соединений [20, 21].
R1 |
|
R1 |
|
N |
N |
N |
|
R2 |
H |
R2 |
N |
14 |
|
15 |
H |
|
|
Для полученных эзеринов в кислой среде наблюдалась кольчато-цепная таутомерия.
Избранные методы синтеза и модификации гетероциклов, том 1 |
81 |
Это свойство позволило использовать их и соответствующие кислородные аналоги (физовенины) в качестве индикаторов кислотности среды [21–23].
|
|
+ |
|
NH+ |
|
|
+2H |
|
3 |
R1 |
|
−2H+ |
R1 |
+ |
N |
N |
|
N |
|
R2 |
H |
|
|
R2 |
|
|
|
|
Триптамины и гомотриптамины из циклических енаминов. Используя представле-
ния о механизме процесса и его аналогию с синтезом индолов по Фишеру, были использованы в похожей реакции циклические енамины. Действительно, после присоединения арилгидразина к активной двойной связи циклического енамина образующийся аминаль 16 перегруппировывался в арилгидразон аминоальдегида 17, который по обычной фишеровской схеме давал триптамин при n = 1 или гомотриптамин при n = 2 [24–29].
R2 |
N |
NH2 |
|
|
R1 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
R1 |
|
+ |
|
N |
R2 |
H |
|
|
( ) |
N |
|
||||
|
N |
|
|||||
|
|
n |
|
|
N |
|
( )n |
|
|
|
|
|
H |
|
|
|
|
|
|
|
16 |
H N |
|
|
|
|
|
|
|
||
|
|
R1 |
R2 |
|
2 |
( )n+1 |
|
|
|
|
R1 |
|
|
||
|
|
|
N |
H2N |
|
N |
|
|
|
|
N |
( )n |
|
|
|
|
|
|
|
|
|
R2 |
|
|
|
|
|
17 |
n = 1, 2 |
||
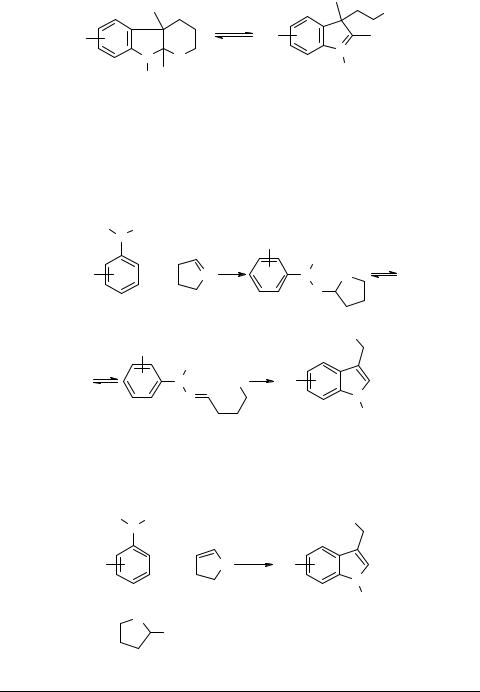
Триптофолы и гомотриптофолы. Точно таким же образом, но с более высокими выходами протекала реакция с циклическими виниловыми эфирами, приводя к триптофолам 18 при n = 1 [30, 31] или гомотриптофолам 19 при n = 2 [30–35].
R2 |
N |
NH2 |
|
|
HO |
|
|
HCl |
|
|
( |
)n+1 |
|
R1 |
|
+ |
n( ) |
O |
R1 |
|
|
|
|
|
N |
||
|
O |
|
n = 1, 2 |
18 n = 1 |
R2 |
|
|
OH |
|
19 n = 2 |
|
||
|
|
|
|
|
||
|
20 |
|
|
|
|
|
82 |
Серия монографий InterBioScreen |
Аналогично реагировали и циклические полуацетали типа 20 [34]. Весьма удобной оказалась модификация метода с использованием легко доступных α-ацилбутиролактонов, которые сразу в процессе реакции за счет гидролиза и декарбоксилирования давали триптофолы [36].
R2 |
N |
NH2 |
O |
R1 |
|
|
|
|
|||
|
|
+ O |
O |
R2 |
OH |
R1 |
|
R3 |
N |
|
|
|
|
|
N |
R3 |
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
|
|
R1 |
R3 |
|
|
|
|
|
N |
|
|
|
|
|
R2 |
|
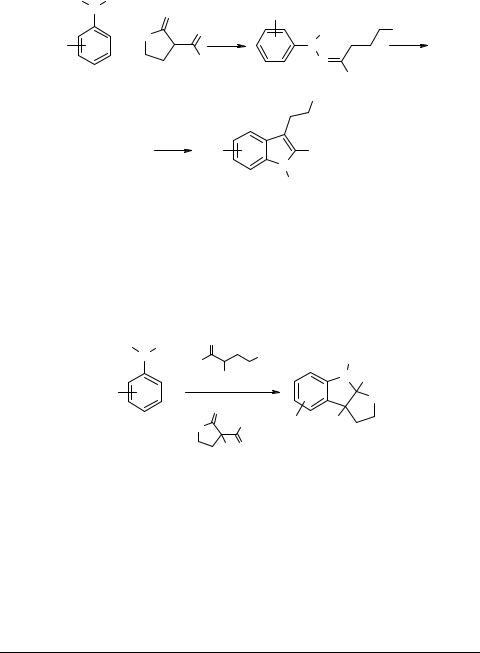
Физовениновые структуры. Используя представления о механизме синтеза индолов по Фишеру и некоторых его модификаций [37–40], мы разработали важную в прикладном смысле схему получения физовениновых структур 21 на основе α-алкилзамещенных ацетопропилового спирта [42–47]. Удалось также в одностадийном процессе применить в этой реакции доступные α-алкил-α-ацилбутиролак- тоны 22 [41, 48]. Для их солей, как и солей эзеринов, была характерна кольчатоцепная таутомерия, которая была подробно рассмотрена в работах [22, 23].
R2 |
N |
NH2 |
O |
OH |
|
|
R2 |
||||
|
R4 |
|
|
||
R1 |
|
|
R3 |
|
N R4 |
|
|
O |
|
O |
|
|
|
|
|
||
|
|
|
R1 |
R3 |
|
|
|
O |
R4 |
||
|
|
|
|
|
R3 O |
21 |
|
|
22 |
|
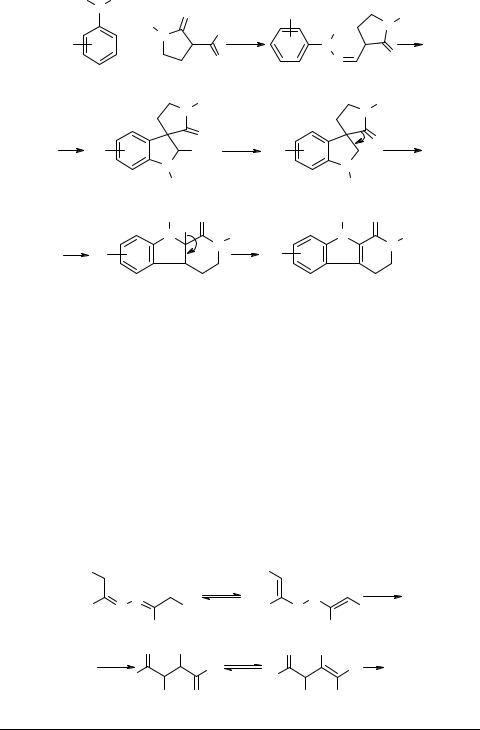
α-Ациллактамы в реакции Фишера. Мы сделали попытку получить триптамины из 3-формил-2-пирролидона 23 по аналогии с описанным выше синтезом триптофолов. Однако с высокими выходами в качестве единственных продуктов реакции были получены 1-оксо-1,2,3,4-тетрагидрокарболины 24 [49, 50], образование которых, по-видимому, протекает следующим образом. На первой стадии формилпирролидон 23 дает с арилгидразином гидразон 25, который, по Фишеру, циклизуется в спироиндолин 26. Последний после протонирования аминогруппы теряет молекулу аммиака с образованием катиона 27, перегруппировывающегося в катион 28, стабилизирующийся в свою очередь в карболин 24.
Избранные методы синтеза и модификации гетероциклов, том 1 |
83 |
R2 |
N |
NH2 |
|
|
O |
|
|
|
|
R1 |
N R3 |
|
|
R3 |
|
|
|
|
|
|
|||||
|
|
N |
|
|
H |
|
|
R2 |
||||
R1 |
|
+ |
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
O |
|
|||
|
|
|
|
|
|
O |
|
|
N |
|
||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
23 |
|
|
|
|
25 |
|
|
|
|
|
|
|
|
N R3 |
|
|
|
|
N R3 |
|
|
|
|
|
|
|
|
O |
|
+ |
|
|
O |
|
|
R1 |
|
|
|
|
NH2 |
|
+H |
R1 |
+ |
|
|
|
|
N |
|
|
−NH3 |
|
|
|||||
|
|
|
|
|
|
|
N |
|
|
|||
|
|
|
R2 |
|
|
|
|
R2 |
|
|||
|
|
26 |
|
|
|
|
|
|
|
27 |
|
|
|
|
|
R2 |
H |
O |
|
|
|
R2 |
O |
|
|
|
|
|
N |
|
N |
|
R3 |
|
N |
N |
R3 |
|
|
R1 |
|
|
|
|
|
|
R1 |
|
|
||
|
|
|
+ |
|
|
−H+ |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
28 |
|
|
|
|
|
|
24 |
|
|
Механизм реакции, детально изученный в наших работах [5, 16, 19, 24, 51–74, 98, 99] и приведенный в общей форме на схеме (см. выше), предлагает рассматривать важнейшую стадию процесса – завязывание новой С–С связи (5–6) как сигматропную [3,3]-перегруппировку. Этот подход позволил оценить и механизм реакции синтеза индолов по Фишеру в общем виде тоже как сигматропную [3,3]-перегруппировку.
Концепция сигматропного [3,3]-сдвига на стадии завязывания связи С–С в реакции Фишера наводила на мысль о щелочном катализе в этом процессе, так как щелочные катализаторы также могли увеличить скорость таутомерного превращения гидразон–енгидразин.
В ряде случаев [75] при щелочном катализе нам удалось получить индолы, однако по эффективности щелочной катализ явно уступал кислотному. Зато весьма интересные результаты были получены при щелочном термолизе азинов, содержащих бензильную группу [76, 77]. В этой реакции мы наблюдали образование пирролов.
Ph |
NaH |
Ph |
H |
[3,3] |
R N N |
|
|||
Ph |
R |
N N |
Ph |
|
R |
|
|
H |
R |
|
|
|
||
NH |
Ph |
|
NH Ph |
|
R |
R |
R |
|
R |
|
|
|
||
Ph |
NH |
|
Ph |
NH2 |
84 |
Серия монографий InterBioScreen |
|
H |
NH2 |
|
|
H |
|
R |
N |
|
R |
N |
R |
|
|
|
R |
−NH3 |
|
|
|
Ph |
|
Ph |
Ph |
|
Ph |
|
|
|
|
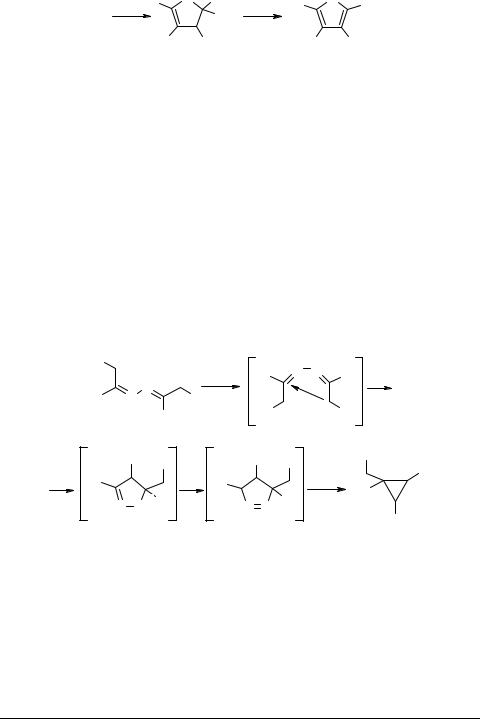
Как и в случае реакции Фишера, на первой стадии циклизации азин превращается в диенгидразин. Это превращение обратимо, причем равновесие сдвинуто в сторону азина. Щелочной катализатор, не сдвигая само равновесие, заметно увеличивает скорость таутомерного превращения. Фенильная группа также способствует увеличению кислотности водорода соседней метиленовой группы и увеличивает вероятность образования енгидразинного таутомера. На следующей стадии происходит сигматропный [3,3]-сдвиг и затем (через несколько стадий, сопровождающихся элиминированием аммиака) образуется пиррольное производное. Вероятность протекания стадии образования углерод-углеродной связи как сигматропного [3,3]-сдвига подтверждается самим фактом образования пиррольного соединения при проведении термолиза без катализатора при 300°С. Во всех случаях, кроме пирролов, были выделены и пиразолы, по-видимому, образовавшиеся по карбанионному механизму [77]. При попытке реализовать процесс для азинов жирно-ароматических кетонов нам удалось обнаружить их перегруппировку в пиразолины, сразу распадающиеся до циклопропанов [79–81] c высокими выходами.
R |
|
|
NaH |
Ar |
N N |
Ar |
|
|
|
|
|||||
|
N N |
|
|
|
|||
Ar |
R |
+ |
R |
|
− |
R |
|
|
|
Ar |
−H |
|
|
||
|
|
|
|
|
|
|
|
|
R |
R |
|
R |
R |
+ |
R |
|
|
Ar |
|||||
|
|
|
|
|
|
||
Ar |
|
|
Ar |
− |
|
+H |
Ar |
|
|
Ar −N2 |
|||||
N |
N− Ar |
|
N N |
||||
|
R |
||||||
|
|
|
|
|
|
|
|
На первой стадии реакции при действии на кетазин гидрида щелочного металла образуется карбанион, который внутримолекулярно циклизуется в анион 2-пиразолина. Последний изомеризуется в анион 1-пиразолина, который, теряя азот в условиях реакции, образует анион циклопропана. На одной из стадий, вероятнее всего на последней, промежуточные анионы или анион циклопропана депротонируют новую молекулу кетазина. В работе [82] предложено рассматривать циклизацию азинов в пиразолины как дисротаторную электроциклическую реакцию. С этих позиций гидрид щелочного металла способствует образованию 1,4-гетеродиеновой структуры.
Избранные методы синтеза и модификации гетероциклов, том 1 |
85 |

Физико-химические исследования. Специально был изучен распад индольных структур под действием электронного удара. Полученные закономерности позволили различать изомерные индолы, замещенные в ядре. Удалось также разработать метод полуколичественного анализа 4- и 6-замещенных изомеров. Детальный анализ спектров ПМР позволил произвести отнесение всех сигналов индольных и триптаминовых структур, что также было использовано в анализе изомерных смесей [90, 91]. Определение индексов Ковача в ГЖХ индолов, индолинов и триптаминов [92–97] позволило проводить количественный анализ смесей изомерных индолов с точным отнесением хроматографических пиков. Комплексное применение этих трех методов позволило нам надежно анализировать довольно сложные смеси индольных структур.
Синтезы "узловых" соединений
ИК-спектры сняты на Jasco-IRS в KBr, УФ-спектры на приборе EPS-3T в спирте, спектры 1Н ЯМР на приборе JNM-4H-10 в CCl4 (интенсивности во всех спектрах соответствуют структурным формулам).
2-Метилгомотриптамин 10 (R2 = H, R3 = Me) [14]. К кипящему раствору 0.1 моль фенилгидразина в 50 мл 90%-го этанола прикапывают раствор 0.1 моль 6-хлоргексанона-2 в 50 мл 90%-го этанола. Реакционную массу нагревают до кипения в колбе с обратным холодильником в течение 8 ч. Затем раствор упаривают на роторном испарителе, остаток растворяют в 100 мл 1% НСl и экстрагируют 30 мл бензола. Водный слой фильтруют и фильтрат подщелачивают едким натром. Выделившийся гомотриптамин экстрагируют бензолом и разгоняют в вакууме в токе инертного газа. Выход триптамина 62% с Ткип 166–170/1 мм,
Тпл 55–56°С (из гексана). Найдено, %: С 76.6, Н 8.6. C12H16N2. Вычислено, %:
С 76.5, Н 8.6. Спектр 1Н ЯМР, δ, м.д.: 1.40 (NH2, c), 1.63 (3β-СН2, м), 2.14 (2СН3, с),
2.58 (3α-СН2 и 3γ-СН2, т), 6.95–7.17 (Наром, м). Гидротартрат: Тпл 160–162°С
(с разложением); пикрат: Тпл 182–183°С.
N-Бензилгомотриптофол 19 (R1 = H, R2 = CH2Ph) [32]. В трехгорлой колбе с мешалкой и обратным холодильником нагревают на кипящей водяной бане 0.05 моль хлоргидрата α-бензилфенилгидразина в смеси 80 мл диоксана и 3 мл воды. Затем к смеси прикапывают раствор 0.075 моль дигидропирана в 20 мл диоксана и нагревают смесь еще 3 ч. На роторном испарителе отгоняют диоксан, к остатку добавляют смесь 50 мл воды и 50 мл бензола, нагревают смесь на водяной бане в течение получаса и отделяют бензольный слой, содержащий триптофол. Водный остаток повторно экстрагируют 30 мл горячего бензола. Бензольные вытяжки разгоняют в вакууме в токе инертного газа. N-бензилгомотриптофол получен с выходом 92% с Ткип 208–212/1 мм, Тпл 79–80°С (из гексана). Найдено, %:
С 81.7, Н 7.2. C18H19NO. Вычислено, %: С 81.5, Н 7.2. Спектр 1Н ЯМР, δ, м.д.: 1.63 (ОН, уш. с), 19.9 (3β-СН2, м), 2.88 (3α-СН2, т), 3.69 (3γ-СН2, т), 5.23 (1α-СН2, с), 6.88 (2Н, с), 7.07–7.22 (Наром, м).
2-Метил-7-азатриптамин[15]. Смесь0.1 моль2-пиридилгидразина, 200 мл80%-го этанола и 0.1 моль γ-хлорпропилметилкетона нагревают в автоклаве до 160°С в
86 |
Серия монографий InterBioScreen |

течение 6 ч. Отгоняют на роторном испарителе этанол, остаток растворяют в 100 мл 1%-ой HCl и экстрагируют нейтральные примеси 50 мл бензола. Водный раствор подщелачивают едким натром и экстрагируют эфиром (3 раза по 30 мл). Эфирные вытяжки сушат над К2СО3 и разгоняют в вакууме. Азатриптамин
получен с выходом 75%, Ткип 180–183°С/1 мм. Найдено, %: С 68.5, Н 7.6. С10Н13N3.
Вычислено, %: С 68.6, Н 7.4. ИК-спектр, ν, см–1: 1490, 1600, 2850–3000, 3420. УФ-спектр, λмакс, нм (lg ε): 226 (4.29), 291 (3.87). Спектр 1Н ЯМР, δ, м.д.: 1.7 (NH2, c), 2.35 (2-СН3, с), 2.78 (α-3-СН2, т), 2.78 (β-3-СН2), 6.5 (1-Н, с), 7.70 (4-Н, д), 6.87 (5-Н, т), 8.08 (6-Н, д). Монопикрат: Тпл 182°С (с разл.).
Нордезокси-9-метилэзеролин [19]. В 100 мл 90%-го метанола кипятят с обратным холодильником смесь 0.1 моль α-метилфенилгидразина и 0.1 моль 3-метил-5-хлор- пентанона-2 в течение 8 ч. Реакционную массу упаривают на роторном испарителе, остаток растворяют в 100 мл 1%-ой HCl и экстрагируют дважды 30 мл бензола. Водный слой отделяют, фильтруют и подщелачивают едким натром. Выделившееся основание экстрагируют 40 мл бензола и бензольную вытяжку
разгоняют в вакууме в токе инертного газа. Выход эзеролина 57%, Ткип 124°С/3 мм, nD20 1.5690, d420 1.0389. Спектр 1Н ЯМР, δ, м.д.: 1.15 (3-α-СН3, с), 1.19 (9-СН3, с), 2.67 (8-СН3, с), 2.2–2.8 (2-СН2, м), 1.4–1.9 (3-СН2, м), 2.16 (NH, c), 6.67 (4Н, д), 6.38 (5Н, т), 6.81 (6Н, т), 6.04 (7Н, д). Найдено, %: С 77.4, Н 9.1. С13Н18N2. Выч., %:
С 77.2, Н 9.0. Монопикрат: Тпл 167–168°С (красный); дипикрат: Тпл 190–191°С (желтый).
2,3,3а,8а-Тетрагидро-3а,8а-диметилфуро[2,3-b]индол [44]. К раствору 7.3 г (0.05 моль) солянокислого фенилгидразина в 50 мл диметилформамида добавляют 5.8 г (0.05 моль) 3-метилпентанон-4-ола-1 и реакционную массу нагревают при 50°С в течение 0.5 ч на кипящей водяной бане и далее 0.5 ч при кипении диметилформамида. Диметилформамид отгоняют в вакууме. К остатку добавляют 50 мл воды и экстрагируют горячим бензолом два раза по 25 мл. При разгонке бензольного экстракта получен 7.2 г (76%) фуроиндола с Ткип 108–110/0.5 мм, Тпл 46–47°С (из гексана). Найдено, %: С 76.2, Н 7.9. С12Н15NO. Вычислено, %:
С 76.2, Н 8.00. УФ-спектр, λмакс, нм (lg ε). 216 (4.02), 223 (3.87), 243 (3.78). Спектр 1Н ЯМР, δ, м.д.: 1.22 (3α-СН3, с), 1.35 (8α-СН3, с), 1.9–2.0 (β-СН2, м), 3.1–3.8
(α-СН2, м), 4.83 (NH, с), 6.1–6.9 (Наром, м). Пикрат: Тпл 137–138°С (из спирта).
1-Оксо-2-метил-1,2,3,4-тетрагидро-β-карболин 24 (R2 = H, R3 = Me) [49].
К раствору 0.03 моль солянокислого фенилгидразина в смеси 35 мл изопропилового спирта, 15 мл воды и 5 мл конц. HCl приливают раствор (0.03 моль) енамина 1-метил-3-формилпирролидона-2 в 10 мл 50%-го изопропилового спирта и нагревают смесь до кипения с обратным холодильником 3 ч. Выпавшие кристаллы карболина отфильтровывают и кристаллизуют из гексана. Карболин полу-
чен с выходом 60%, Тпл 234°С. ИК-спектр, ν, см–1: 1640 (С=О), 3469, 3240 (NH).
УФ-спектр, λмакс, нм (lg ε): 227 (4.17), 238 (4.04), 302 (4.11). Спектр 1Н ЯМР, δ, м.д.: 3.00 (4-Н, т), 3.14 (N-CH3, c), 3.64 (3-H, т), 10.50 (NH, c). М.в. 200 (масс-
спектрометрически).
Избранные методы синтеза и модификации гетероциклов, том 1 |
87 |

Литература
1.Грандберг И.И., Зуянова Т.И., Афонина Н.И., А. с. 192 818 (1966), Бюлл.
изобрет. 1967 (6).
2.Грандберг И.И., Изв. АН СССР, Сер. хим. 1966 1682.
3.Грандберг И.И., Зуянова Т.И., ХГС 1968 875.
4.Грандберг И.И., ХГС 1974 579.
5.Грандберг И.И., Изв. ТСХА 1972 (5) 188.
6.Грандберг И.И., Зуянова Т.И., Афонина Н.И., Иванова Т.А., ДАН СССР 1967
176 583.
7.Грандберг И.И., Зуянова Т.И., Афонина Н.И., Иванова Т.А., Докл. ТСХА 1967
124 325.
8.Грандберг И.И., Зуянова Т.И., А. с. 196 852, Бюлл. изобрет. 1967 (12).
9.Грандберг И.И., Афонина Н.И., Зуянова Т.И., А. с. 201 412, Бюлл. изобрет.
1967 (18).
10.Грандберг И.И., Афонина Н.И., Зуянова Т.И., ХГС 1968 1038.
11.Грандберг И.И., Пржевальский Н.М., Иванова Т.А. и др., Изв. ТСХА 1969
(5) 208.
12.Грандберг И.И., Зуянова Т.И., ХГС 1971 51.
13.Грандберг И.И., Боброва Н.И., ХГС 1973 213.
13а.Грандберг И.И., Нам Н.Л., Сорокин В.И., ХГС 2000 (5) 625.
14.Грандберг И.И., Зуянова Т.И., ХГС 1970 1495.
15.Грандберг И.И., Ярышев Н.Г., ХГС 1972 1070.
16.Грандберг И.И., Ярышев Н.Г., ХГС 1972 1702.
17.Грандберг И.И., Иванова Т.А., А. с. 201 411, Бюлл. изобрет. 1967 (18).
18.Грандберг И.И., Иванова Т.А., Докл. ТСХА 1970 160 232.
19.Грандберг И.И., Иванова Т.А., ХГС 1970 480.
20.Грандберг И.И., Иванова Т.А., ХГС 1970 939.
21.Грандберг И.И., Иванова Т.А., Ярышев Н.Г., ХГС 1970 1276.
22.Грандберг И.И., Иванова Т.А., ХГС 1970 1489.
23.Грандберг И.И., Дашкевич С.Н., Иванова Т.А., А. с. 382 968, Бюлл. изобрет.
1973 (23).
24.Грандберг И.И., Никитина С.Б., ХГС 1971 54.
25.Грандберг И.И., Никитина С.Б., Ярышев Н.Г., Изв. ТСХА 1970 (2) 196.
26.Грандберг И.И., Никитина С.Б., Докл. ТСХА 1971 162 374.
27.Грандберг И.И., Никитина С.Б., ХГС 1971 1204.
28.Грандберг И.И., Никитина С.Б., ХГС 1972 1216.
29.Грандберг И.И., Пржевальский Н.М., Иванова Т.А., А. с. 248689, Бюлл.
изобрет. 1969 (24).
30.Грандберг И.И., Афонина Н.И., А. с. 239341, Бюлл. изобрет. 1969 (11).
31.Грандберг И.И., Москвина Т.П., ХГС 1972 1366.
32.Грандберг И.И., Москвина Т.П., ХГС 1970 942.
33.Грандберг И.И., Москвина Т.П., Докл. ТСХА 1971 162 380.
34.Грандберг И.И., Москвина Т.П., ХГС 1974 90.
35.Грандберг И.И., Москвина Т.П., Изв. ТСХА 1973 (4) 167.
36.Грандберг И.И., Токмаков Г.П., ХГС 1974 205.
37.Грандберг И.И., Сибирякова Д.В., А. с. 199 892, Бюлл. изобрет. 1967 (16).
88 |
Серия монографий InterBioScreen |

38.Грандберг И.И., Бровкин Л.В., Белякова Т.А., Сибирякова Д.В., ХГС 1969 97.
39.Грандберг И.И., Зуянова Т.И., Афонина Н.И., Иванова Т.А., А. с. 242 901,
Бюлл. изобрет. 1969 (16).
40.Грандберг И.И., Боброва Н.И., ХГС 1974 1085.
41.Грандберг И.И., Токмаков Г.П., ХГС 1975 207.
42.Грандберг И.И., Дашкевич С.Н., ХГС 1971 1194.
43.Грандберг И.И., Дашкевич С.Н., А. с. 276062, Бюлл. изобрет. 1970 (23).
44.Грандберг И.И., Дашкевич С.Н., ХГС 1970 1631.
45.Грандберг И.И., Дашкевич С.Н., Докл. ТСХА 1970 160 243.
46.Грандберг И.И., Дашкевич С.Н., ХГС 1971 342.
47.Грандберг И.И., Дашкевич С.Н., ХГС 1971 782.
48.Грандберг И.И., Токмаков Г.П., А. с. 502883, Бюлл. изобрет. 1976 (6).
49.Токмаков Г.П., Грандберг И.И., ХГС 1980 331.
50.Грандберг И.И., Токмаков Г.П., А. с. 523096, Бюлл. изобрет. 1976 (28).
51.Грандберг И.И., Пржевальский Н.М., Высоцкий В.И., Хмельницкий Р.А.,
ХГС 1970 447.
52.Грандберг И.И., Зуянова Т.И., Пржевальский Н.М., Минкин В.И., ХГС 1970
750.
53.Сорокин В.И., Дисс. канд. хим. наук, М., 1973.
54.Грандберг И.И., Пржевальский Н.М., ХГС 1970 1273.
55.Грандберг И.И., Сорокин В.И., ХГС 1973 31.
56.Грандберг И.И., Пржевальский Н.М., ХГС 1969 943.
57.Грандберг И.И., Пржевальский Н.М., Высоцкий В.И., ХГС 1970 1499.
58.Грандберг И.И., Зуянова Т.И., Жигулёв К.К., ХГС 1972 1708.
59.Грандберг И.И., Иванова Т.А., Зуянова Т.И., Изв. ТСХА 1970 (3) 212.
60.Высоцкий В.И., Хмельницкий Р.А., Грандберг И.И., Изв. ТСХА 1970 (5) 204.
61.Грандберг И.И., Дашкевич С.Н., Изв. ТСХА 1971 (1) 189.
62.Грандберг И.И., Дашкевич С.Н., ХГС 1971 1194.
63.Жигулёв К.К., Хмельницкий Р.А., Грандберг И.И., Высоцкий В.И., ХГС 1972
1065.
64.Грандберг И.И., Пржевальский Н.М., Изв. ТСХА 1972 (2) 192.
65.Грандберг И.И., Сибирякова Д.В., Бровкин Л.А., ХГС 1969 94.
66.McLean T., McLean S., Reed R., J. Chem. Soc. 1955 2519.
67.Pausacker K., Schubert C., J. Chem. Soc. 1950 1814.
68.Freundlich H., Kroepelin H., Z. Phys. Chem. 1926 122 39.
69.Пржевальский Н.М., Грандберг И.И., ХГС 1974 1581.
70.Пржевальский Н.М., Грандберг И.И., Клюев Н.А., ХГС 1976 1065.
71.Пржевальский Н.М., Грандберг И.И., Клюев Н.А., Беликов А.Б., ХГС 1978
1349.
72.Трофимов Б.А., Коростова С.Е., Собекина Л.Н. и др., ХГС 1982 1931.
73.Sheradsky T., Tetrahedron Lett. 1970 25.
74.Hous H.O., Richey F.L., J. Org. Chem. 1960 25 1430.
75.Грандберг И.И., Боброва Н.И., Изв. ТСХА 1978 (6) 220.
76.Грандберг И.И., Дмитриев Л.Б., Сорокин В.И., Ларшин Ю.А., ЖОрХ 1979
(15)89.
77.Клюев Н.А., Грандберг И.И., Дмитриев Л.Б., Ларшин Ю.А., ЖОрХ 1979
(15)2274.
Избранные методы синтеза и модификации гетероциклов, том 1 |
89 |

78.Грандберг И.И., Сорокин В.И., Успехи химии 1974 43 266.
79.Грандберг И.И., Якущенко И.К., Дмитриев Л.Б., ЖОрХ 1979 (15) 89.
80.Грандберг И.И., Якущенко И.К., Дмитриев Л.Б., Изв. ТСХА 1979 (4) 170.
81.Грандберг И.И., Якущенко И.К., А. с. 727608, Бюлл. изобрет. 1980 (14).
82.Elguero J., Jacquier R., Marzin C., Bull. Soc. Сhim. 1970 4119.
83.Высоцкий В.И., Хмельницкий Р.А., Грандберг И.И., Фридляндский Г.В.,
Изв. ТСХА 1971 (3) 206.
84.Хмельницкий Р.А., Кунина Е.А., Дашкевич С.Н., Грандберг И.И., Изв. ТСХА
1971 (4) 214.
85.Хмельницкий Р.А., Клюев Н.А., Долгих А.Ф. и др., Изв. ТСХА 1973 (3) 192.
86.Хмельницкий Р.А., Высоцкий В.И., Грандберг И.И., ЖОрХ 1969 (5) 417.
87.Высоцкий В.И., Хмельницкий Р.А., Грандберг И.И., Будылин В.А., Изв. ТСХА
(4)1970 221.
88.Хмельницкий Р.А., Высоцкий В.И., Грандберг И.И. и др., ЖОрХ 1971
(7)1514.
89.Клюев Н.А., Грандберг И.И., Субоч В.П. и др., ЖОрХ 1979 (15) 2237.
90.Высоцкий В.И., Хмельницкий Р.А., Грандберг И.И., Изв. ТСХА 1970 (5) 204.
91.Грандберг И.И., Дашкевич С.Н., Изв. ТСХА 1971 (1) 189.
92.Дмитриев Л.Б., Грандберг И.И., Изв. ТСХА 1973 (5) 206.
93.Грандберг И.И., Беляева Л.Д., Дмитриев Л.Б., ХГС 1973 37.
94.Грандберг И.И., Беляева Л.Д., Дмитриев Л.Б., ХГС 1973 1204.
95.Грандберг И.И., Дмитриев Л.Б., Беляева Л.Д., Докл. ТСХА 1971 162 398.
96.Грандберг И.И., Беляева Л.Д., Дмитриев Л.Б., ХГС 1971 58.
97.Дмитриев Л.Б., Грандберг И.И., ХГС 1975 946.
98.Пржевальский Н.М., Грандберг И.И., ХГС 1982 940.
99.Грандберг И.И., ЖОрХ 1983 (15) 2439.
90 |
Серия монографий InterBioScreen |
