
- •1. Адсорбционная хроматография: определение, сущность. Тонкослойная хроматография: определение, сущность, применение в медицине. Коэффициент подвижности, степень разделения.
- •2. Бумажная хроматография: сущность, классификация, применение в медицине.
- •4. Газо-адсорбционная хроматография и газо-жидкостная хроматография: определение, сущность, применение в медико-биологических исследованиях.
- •5. Методы количественной обработки хроматограмм: абсолютная калибровка, метод простой и внутренней нормировки, метод внутреннего стандарта.
- •6. Электрическая подвижность ионов , факторы, влияющие на ее величину.
- •7. Удельная электрическая проводимость
- •8. Молярная электрическая проводимость
- •10. Кондуктометрические методы анализа
- •11. Электрическая проводимость биологических объектов в норме и патологии
- •12. Электролиты в организме. Слюна как раствор электролитов.
- •13. Электродные потенциалы. Стандартные электродные потенциалы.
- •14. Классификация электродов: 1) электроды первого рода; 2) второго рода; 3) газовые электроды; 4) ов электроды.
12. Электролиты в организме. Слюна как раствор электролитов.
ЭЛЕКТРОЛИТЫ входят в состав всех клеток и тканей организма, составляя более 4% их массы. Они играют роль в поддержании осмотического давления, которое влияет на распределение в клетках воды и растворенных веществ. Кроме пассивного транспорта, в организме имеет место активный транспорт. Катионы натрия, калия, кальция, анионы хлора участвуют в возникновении мембранных потенциалов клеток, проводимости нервных волокон. Электролитный обмен тесно связан с обменом органических веществ. В значительной степени это обусловлено влиянием электролитов на степень диссоциации, гидратацию, растворимость, устойчивость многих внутриклеточных и внеклеточных белков. Большое значение при этом имеет валентность и химическая природа ионов. Этими факторами определяется также способность ионов взаимодействовать с ВМС-белками и нуклеиновыми кислотами.
СЛЮНА – секрет слюнных желез, выделяющийся в полость рта. Слюна обладает pH от 5,6 до 7,6. На 98,5 % и более состоит из воды, содержит соли различных кислот, микроэлементы и катионы некоторых щелочных металлов, муцин (формирует и склеивает пищевой комок), лизоцим (бактерицидный агент), ферменты амилазу и мальтазу, расщепляющие углеводы до олиго- и моносахаридов, а также другие ферменты, некоторые витамины. Также состав секрета слюнных желез меняется в зависимости от характера раздражителя. Состав: вода, белки, муцин, холестерин, глюкоза, аммоний, мочевая кислота, соли натрия, соли калия, соли кальция, соли магния, хлориды, гиброкарбонаты, мочевина.
13. Электродные потенциалы. Стандартные электродные потенциалы.
В зависимости от природы соприкасающихся фаз различают четыре вида электрических потенциалов:
Электродный потенциал, возникающий на границе металл-раствор, содержащий катионы этого металла. Вычисляется по уравнению Нернста:
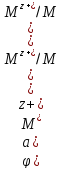
Величина электродного потенциала, возникающего на границе металл-раствор, зависит от:
-природы металла
-активности потенциалопределяющих ионов в растворе
-температуры раствора
Значение электродного потенциала численно равно ЭДС гальванической цепи, составленной из стандартного водородного электрода и электрода, потенциал которого подлежит определению и имеет знак «+», если на нем протекает процесс восстановления и знак «–», если процесс окисления.
2. Окислительно-восстановительный (редокс) потенциал, возникающий на границе инертный металл-раствор, содержащий сопряженную окислительно-восстановительную пару.
3. Диффузионный потенциал, возникающий на границе двух растворов, содержащих разные ионы или разные концентрации одних и тех же ионов.
4. Мембранный потенциал, возникающий по обе стороны мембраны, обладающей избирательной проницаемостью, разделяющей растворы различной концентрации.
В живом организме содержится множество различных соприкасающихся фаз, содержащих ионы, поэтому возникновение межфазных потенциалов имеет важное значение для жизнедеятельности организма.
СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ (φ) возникает на границе металл–раствор при активности потенциалопределяющих ионов в растворе 1 моль/л и Т = 298 К. Абсолютное значение измерить или рассчитать невозможно. Определяют фи относительно стандартного электрода. По Международному соглашению в качестве стандартного электрода используют стандартный водородный электрод.
