
- •1. Адсорбционная хроматография: определение, сущность. Тонкослойная хроматография: определение, сущность, применение в медицине. Коэффициент подвижности, степень разделения.
- •2. Бумажная хроматография: сущность, классификация, применение в медицине.
- •4. Газо-адсорбционная хроматография и газо-жидкостная хроматография: определение, сущность, применение в медико-биологических исследованиях.
- •5. Методы количественной обработки хроматограмм: абсолютная калибровка, метод простой и внутренней нормировки, метод внутреннего стандарта.
- •6. Электрическая подвижность ионов , факторы, влияющие на ее величину.
- •7. Удельная электрическая проводимость
- •8. Молярная электрическая проводимость
- •10. Кондуктометрические методы анализа
- •11. Электрическая проводимость биологических объектов в норме и патологии
- •12. Электролиты в организме. Слюна как раствор электролитов.
- •13. Электродные потенциалы. Стандартные электродные потенциалы.
- •14. Классификация электродов: 1) электроды первого рода; 2) второго рода; 3) газовые электроды; 4) ов электроды.
6. Электрическая подвижность ионов , факторы, влияющие на ее величину.
Скорость направленного движения иона, т. е. путь, пройденный ионом в растворе под действием электрического поля в направлении к электроду за единицу времени, зависит от действующей на ион силы, т. е. от напряженности электрического поля:
V = иЕ
где V — скорость движения иона, м/с; Е - напряженность поля, В/м; и - коэффициент пропорциональности, называемый электрической подвижностью иона или просто подвижностью иона, м2/(В • с).
ПОДВИЖНОСТЬ ИОНА характеризует его способность преодолевать сопротивление среды при направленном движении в электрическом поле. Рассмотрим основные факторы, влияющие на подвижность иона в водных растворах при наличии электрического поля.
Заряд и радиус иона, т. е. его природа: чем больше заряд и чем меньше радиус иона, тем сильнее гидратируется ион, тем ниже подвижность иона в растворе.
Природа растворителя, его диэлектрическая проницаемость и вязкость. Чем полярнее растворитель, тем больше размеры гидратированного иона и меньше его подвижность. Вязкость растворителя обуславливает сопротивление среды движущемуся иону: чем больше вязкость, тем меньше подвижность иона.
Температура раствора. При повышении температуры уменьшаются вязкость растворителя и толщина сольватных оболочек ионов, а также снижается межионное взаимодействие. Все это приводит к увеличению подвижности ионов.
Ионная сила раствора. Чем больше ионная сила раствора, тем сильнее межионное электростатическое взаимодействие и создаваемые им тормозящие эффекты.
Концентрация ионов. Чем больше концентрация ионов в растворе, тем сильнее электростатическое взаимодействие ионов, снижающее их подвижность. Концентрация ионов зависит от силы электролита и его количества в растворе. При разбавлении растворов сильных электролитов подвижность соответствующих ионов растет, поскольку уменьшается их концентрация, а следовательно, снижается межионное взаимодействие в растворе. В растворах слабых электролитов (обычно а < 0,03) подвижность ионов практически не зависит от разбавления, так как концентрация ионов в этих растворах всегда невелика.
Поскольку подвижность ионов зависит от многих факторов, и прежде всего от их концентрации в растворе, то для характеристики свойств ионов используются значения предельной электрической подвижности ионов в данном растворителе при данной температуре.
Предельной подвижностью иона (и°, м2/(В • с)) называется средняя скорость его направленного движения, приобретаемая им в бесконечно разбавленном растворе в однородном электрическом поле напряженностью 1 В/м.
7. Удельная электрическая проводимость
Количественной характеристикой способности растворов проводить ток служит электрическая проводимость.
Электрической проводимостью называется физическая величина, обратная электрическому сопротивлению проводника: ω = 1 /R.
Единицей
электрической проводимости в СИ является
сименс (См), 1 См - 1
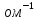 .
.
Электрическое сопротивление однородного проводника прямо пропорционально его длине l и обратно пропорционально площади поперечного сечения в:
В = (рl)/s
где р - удельное сопротивление, характеризующее природу проводника и выражаемое в Ом • м.
Удельная электрическая проводимость характеризует свойства проводящей среды — раствора электролита.
Удельная электрическая проводимость раствора электролита равна количеству электричества, переносимому содержащимися в нем ионами через поперечное сечение раствора площадью 1 м2 в однородном электрическом поле напряженностью 1 В/м за 1 секунду.
Удельная электрическая проводимость зависит от многих факторов, и прежде всего от природы электролита, его концентрации и температуры. Анализ позволяет сделать следующие выводы:
Удельная электрическая проводимость максимальна у растворов сильных кислот и несколько меньше у растворов сильных оснований, что объясняется полной диссоциацией этих электролитов и высокой подвижностью ионов Н30+ и ОН-.
Наименьшие значения во всем интервале концентраций имеет удельная электрическая проводимость растворов слабых электролитов (СН3СООН) в связи с низкой концентрацией ионов в их растворах (а « 1).
Удельная электрическая проводимость растет с концентрацией до некоторых максимальных значений, что отвечает увеличению количества ионов в единице объема раствора. Достигнув максимума, удельная электрическая проводимость начинает снижаться несмотря на рост концентрации электролита. Подобный характер зависимости связан у сильных электролитов с уменьшением подвижности ионов из-за возрастающего по мере увеличения концентрации раствора межионного взаимодействия, а у слабых электролитов - со снижением степени электролитической диссоциации, а значит, с уменьшением количества ионов.
При снижении концентрации электролита до очень малых значений (при с —> 0) удельная электрическая проводимость растворов электролитов стремится к удельной электрической проводимости чистой воды (10"6-1()-5 См/м).
Увеличение температуры повышает удельную электрическую проводимость, так как возрастают подвижность ионов и степень электролитической диссоциации слабого электролита.
