
Betekhtin
.pdf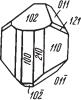
Раздел V. Кислородные соли (оксисоли) |
451 |
ление пены на поверхности выплавляемого олова. Вольфрам как элемент был открыт позднее; название его происходит от названия минерала.
Химический состав. Содержание WO3 около 75%. Из примесей уста навливаются: Mg (до 0,5%), иногда CaO, Та2О5, Nb2O5, SnO2 и др.
Сингония моноклинная; призматический в. с. L2РС. Пр. гр. P2/c(C42h). а0 = 4,78; b0 = 5,73; с0 = 4,98; β = 90°26'. Кристаллическая структура близка к структуре брукита (точнее к α PbO2), катионы металлов обеих пози ций имеют шестерную координацию; они образуют в гексагональной плотнейшей упаковке (плоскость (100)) цепочки реберно связанных ок таэдров, вытянутые вдоль оси с и соединяющиеся через общие вершины. Двухвалентные металлы и вольфрам размещены послойно, чередуясь через один слой. Такие особенности структуры позволяют рассматривать минералы группы вольфрамита особняком от такого типичного вольф рамата, как шеелит (см. ниже); их можно вполне правомерно считать близ кими к сложным оксидам, таким как колумбит и др.
Нередко встречающиеся кристаллы вольфрамита имеют толстотаблитчатый или призматический облик (рис. 251), иногда уплощенный по {100}. Отдельные ин дивиды в некоторых месторождениях достигают круп ных размеров (до 20 см и больше). Вертикальные грани
часто бывают исштрихованы вдоль оси с. Двойники на блюдаются по (100), иногда по (001). Встречается также Рис. 251. Кристалл
в сплошном виде в крупнозернистых агрегатах. |
вольфрамита |
|
Цвет гюбнерита от желто оранжевого до коричневого, обычно имеет красноватый или фиолетовый оттенок; ферберит — черный. Черта у гюб нерита светлая до желтовато коричневой и даже желтой. У ферберита бо лее темная бурая до черной. Блеск на плоскостях спайности зеркальный, алмазный, а в других направлениях жирный. Гюбнерит в тонких оскол ках просвечивает. Показатели преломления для гюбнерита: Ng = 2,32, Nm = 2,22 и Np = 2,17. По мере увеличения содержания железа возраста ют: Nm у малопрозрачного ферберита 2,40 (для Li света).
Твердость 4,5—5,5. Хрупкий. Спайность по {010} совершенная. Уд. вес 6,7—7,5. Железистые разности обладают относительно большим удель ным весом. Богатые железом разности слабомагнитны.
Диагностические признаки. Для вольфрамита характерны: бурова то черный цвет, темно бурая черта, высокий удельный вес, совершенная спайность в одном направлении (отличие от черного сфалерита, у кото рого спайность в нескольких направлениях, а также от колумбита, танта лита, касситерита, не обладающих совершенной спайностью).
П. п. тр. на угле при сильном дутье сплавляется в магнитный королек. При кипячении сплава вольфрамита с содой в воде, подкисленной HCl, с оловом получается голубое окрашивание (реакция на W). С бурой реа гирует на Mn и Fe. В HCl не растворим.
452 |
Описательная часть |
Происхождение и месторождения. Встречается главным образом в кварцевых, гидротермальных кварцевых жилах, нередко приуроченных к массивам гранитов. В ассоциации с ним иногда наблюдаются кассите рит, молибденит, арсенопирит, пирит, халькопирит и др.
В грейзенах гранитных массивов вольфрамит ассоциирует с такими минералами, как слюды, топаз, флюорит, турмалин, иногда берилл, кас ситерит, молибденит и др.
Известны сульфидные жилы, содержащие вольфрамит в парагенезисе с халькопиритом, молибденитом, пиритом, висмутином, сфалеритом и др.
Реже и обычно в небольших количествах он встречается в пегмати товых жилах среди гранитов.
Вминералогическом отношении интересны не раз наблюдавшиеся случаи эндогенного замещения вольфрамитом кристаллов шеелита как с периферии, так и вдоль трещин. В свою очередь, нередко устанавливают ся явления замещения вольфрамита шеелитом.
Взоне окисления при выветривании хотя и не легко, но подвергается изменению, превращаясь в так называемую вольфрамовую охру. При этом двухвалентное железо окисляется до трехвалентного. Под влиянием это го в процессе разрушения кристаллической решетки образуются землис тые массы желто бурого или бурого цвета, состоящие главным образом из гидровольфрамата трехвалентного железа (ферритунгстит). Иногда
образуются желтовато зеленые окислы вольфрама — тунгстит (H2WO4). Гюбнерит, разрушаясь, аналогичным образом дает черные «псиломе
лановые» скопления, содержащие WO3. Характерно, что находимые в элювии желваки псиломелана даже в удалении от месторождения содер
жат WO3 до единиц процентов.
Обычно же в районе месторождений вольфрамит, как относительно устойчивый минерал, переходит в россыпи. Однако характерно, что по мере удаления от коренных месторождений обломки минералов группы вольфрамита сравнительно быстро уменьшаются в размерах и затем ис чезают. Объясняется это относительной хрупкостью этих минералов, уси ливающейся к тому же их совершенной спайностью.
ВРоссии известны гидротермальные месторождения Забайкалья (Джи да, Букука); Алтая (Калгуты). Из иностранных отметим крупнейшие в мире месторождения Южного Китая в провинциях Юньнань и Цзянси (Сихуа шань), а также на севере Вьетнама, в Южной Бирме и на полуострове Ма лакка. В западных штатах США ряд месторождений разрабатывается в Ко лорадо, Южной Дакоте, Неваде и других местах. Из европейских объектов заслуживают упоминания месторождения Португалии и Испании.
Практическое значение. Минералы рассматриваемой группы являются главнейшим источником вольфрама, используемого для различных целей.
1. Главным потребителем этого металла является черная металлургия, использующая вольфрам (до 85–90 % всей добычи) для производства осо
Раздел V. Кислородные соли (оксисоли) |
453 |
бых сортов твердой стали, обладающих свойствами самозакалки. Такая сталь употребляется для изготовления быстрорежущих инструментов.
2.Кроме того, он входит в состав «стеллитов» — сплавов вольфрама
сCr, Со и другими металлами,— используемых для особых инструмен тов, а также сверхтвердых сплавов: «победит», «видна», «сталинит», «во
ломит» и др.г обладающих весьма высокой твердостью и потому приме няемых для изготовления специальных коронок для бурения скважин.
3.В электротехнике вольфрам идет на изготовление нитей для элект рических лампочек, антикатодов в рентгеновских трубках и пр.
4.Соединения вольфрама используются также в химической промыш ленности, в керамике для окраски стекла и фарфора и для других целей.
2. Группа шеелита
К этой группе относятся как вольфраматы, так и молибдаты Са и Pb, кристаллизующиеся в тетрагональной сингонии; лишь для вольфрамата свинца известна также моноклинная модификация.
ПОВЕЛЛИТ — Са[МоО4]. Химический состав. СаО — 28 %, МоО3 —
72 %. Встречаются разности с изоморфной примесью WO3 (до 8 %). Сингония тетрагональная; дипирамидальный в. с. L4PC. Пр. гр.
I41/a(C 64h). a0 = 5,23; с0 = 11,44. Кристаллическая структура аналогична структуре шеелита (см. ниже). Встречается в землисто листоватых псев доморфозах по молибдениту. Самостоятельные кристаллы имеют дипи рамидальный облик, иногда таблитчатый по {001}. Грани {112} часто по крыты косой штриховкой.
Цвет повеллита бледно желтый, желтовато зеленый (для кристаллов). Черта светлая с желтоватым или зеленоватым оттенком. Блеск алмаз ный. Ng = 1,984 и Nm = 1,974.
Твердость 3,5. Хрупкий. Спайность отсутствует. Уд. вес 4,25–4,52. Диагностические признаки. В псевдоморфозах по молибдениту легко
узнается по реликтовым пластинчатым формам и бледно желтому цвету. Для кристаллов характерны бипирамидальный облик и реакции на Мо и Са.
П.п. тр. сплавляется в полупрозрачную массу. С фосфорной солью
вокислительном пламени дает желтовато зеленое, а в восстановитель ном — темно зеленое стекло. Растворяется в HCl. Разбавленный соляно
кислый раствор в присутствии NH3 (в избытке) с щавелевокислым аммо нием дает осадок щавелевокислого кальция.
Происхождение и месторождения. Как уже указано, часто наблю дается в виде псевдоморфоз по молибдениту в зонах окисления молиб деновых месторождений. Очевидно, образуется в результате реакции молибденовой кислоты, возникающей в результате окисления, с каль цийсодержащими поверхностными водами. С течением времени по степенно выщелачивается с образованием пустот в кварце на месте кри сталлов молибденита.

454 |
Описательная часть |
Экзогенный повеллит часто встречается почти во всех зонах окисле ния молибденитовых месторождений. Эндогенный же повеллит доволь но редок.
ВРоссии повеллит известен в виде псевдоморфоз по молибдениту
впегматите одной из копей Ильменских гор (Ю. Урал).
Практическое значение. По сравнению с молибденитом имеет вто ростепенное значение, тем более что в значительных массах встречается сравнительно редко.
ШЕЕЛИТ — Ca[WО4]. Назван по фамилии шведского химика Шееле (1742–1786), впервые открывшего вольфрамовую кислоту именно в этом минерале (в вольфрамите вольфрам был открыт позднее).
Химический состав. CaO — 19,4 %, WO3 — 80,6 %. В виде изоморфной примеси иногда устанавливается MoO3 (до 10 %). Известна также медьсо держащая разновидность — Cu шеелит — с содержанием CuO до 7 %. Иног да устанавливаются редкие земли (преимущественно цериевая группа).
|
Сингония тетрагональная; дипирамидальный в. с. L4PC. Пр. гр. |
|||
I4 |
/a(C6). a |
0 |
= 5,246; с = 11,349. Кристаллическая структура изображена |
|
1 |
4 |
0 |
на рис. 252. Элементарная ячейка пред |
|
|
|
|
|
|
|
|
|
|
ставляет собой центрированную тетраго |
|
|
|
|
нальную призму. Кальций занимает пози |
|
|
|
|
ции в высокосимметричной подрешетке, |
|
|
|
|
имеющей ячейку, как бы составленную из |
|
|
|
|
двух кубических гранецентрированных |
|
|
|
|
ячеек. Расположение анионных тетраэдри |
|
|
|
|
ческих групп WO4 и 8 координированных |
|
|
|
|
катионов Са хорошо видно из рисунка: |
|
|
|
|
кислород и вольфрам занимают позиции, |
|
|
|
|
близкие к положению атомов фтора в плот |
|
|
|
|
ноупакованной подрешетке кальция во |
|
|
|
|
флюорите. Облик кристаллов псевдоокта |
|
|
|
|
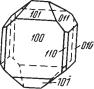
эдрический (рис. 253), иногда таблитчатый |
|
|
|
|
по {001}. На гранях (112) иногда наблюда |
|
|
|
|
ется косая штриховка. |
|
Рис. 252. Кристаллическая |
Двойники срастания по (110) и (001) |
||
|
встречаютсянередко.Агрегаты.Чащенаблю |
|||
|
структура шеелита |
|||
|
дается в виде неправильной формы включе |
|||
|
|
|
|
|
|
|
|
|
ний и зерен, реже в виде сплошных масс. |
|
|
|
|
Цвет. Редко бывает бесцветен, обыч |
|
|
|
|
но окрашен в серый, желтый, зеленова |
|
|
|
|
то желтый, бурый, оранжевый и даже |
|
|
|
|
красный цвет. Черта белая. Блеск жир |
|
|
|
|
новатый, на плоскостях спайности — ал |
Рис. 253. Кристаллы шеелита |
мазный. Ng = 1,937 и Nm = 1,920. |
|||
Раздел V. Кислородные соли (оксисоли) |
455 |
Твердость 4,5. Хрупкий. Спайность по {111} ясная. Излом неровный до ступенчатого. Уд. вес 5,8–6,2. Прочие свойства. В катодных лучах обычно сильно светится голубым цветом.
Диагностические признаки. В силикатных породах шеелит иногда трудно заметить. Необходим большой опыт для диагностики его на глаз. В кристаллах узнается по псевдооктаэдрическому облику, а в изломе и в агрегатах — по жирноватому относительно сильному блеску при относитель но невысокой твердости, довольно ясной спайности, большому удельному весу и реакции на вольфрам. Весьма характерно для него свечение голубым цветом в катодных лучах. Этим свойством широко пользуются для обнару жения его в забоях и даже для примерной оценки содержания в рудах.
П. п. тр. плавится трудно. В HCl и HNO3 разлагается, выделяя жел тую вольфрамовую кислоту (H2WO4 . Н2О), растворимую в аммиаке. Ра створ в HCl при кипячении с оловом принимает красивый синий цвет.
Происхождение и месторождения. Шеелит сравнительно часто встречается как гидротермальный минерал в различных по составу руд месторождениях.
Внебольших количествах он иногда устанавливается в пегматитах. Однако наиболее крупными являются контактово метасоматические месторождения, где шеелит ассоциирует с силикатами (гранатами, пиро ксенами и др.), кварцем и нередко с сульфидами, в частности с молибде нитом. Часты его находки в вольфрамитоносных, золоторудных и других жильных месторождениях.
Взоне окисления не вполне устойчив. С поверхности в кварцевых жилах на месте шеелита иногда устанавливаются пустоты выщелачива ния. Тем не менее шеелит довольно часто обнаруживается в шлихах (в тяжелой фракции).
ВРоссии известными являются скарновое месторождение Тырныауз (Кабардино Балкария, Северный Кавказ), Бурановское (Челябинская обл., Южный Урал) и Боевское (Екатеринбургская обл., Ср. Урал) месторож дения. Присутствует в кварцевых жилах месторождений Восток 2 (При морье) и Букука (Восточное Забайкалье) и в др. Отмечен в скарнах и
вкварцевых жилах в Хепоселькя близ Питкяранты (Северное Приладо жье). Крупные кристаллы встречены в Тэнкергыне (Чукотка).
Из иностранных месторождений упомянем шеелитоносные скарны Май хуры (Таджикистан). Следует указать также на ряд месторождений контак тового происхождения в западных штатах США, крупнейшее месторожде ние Крамат Пулай в Малайе, где шеелит нередко встречается в ассоциации с касситеритом в метаморфизованных известняках и сланцах, а также в квар цевых жилах, затем в северной части о. Тасмания и во многих других местах.
Практическое значение. Шеелитовые руды, как и вольфрамитовые, служат источником получения вольфрама. О применении этого металла см. выше (вольфрамит).

456 |
Описательная часть |
ВУЛЬФЕНИТ — Pb[МоО4]. Назван в честь австрийского минерало га Ф. Вюльфена (1728—1805), изучившего свинцовые руды Каринтии.
Химический состав: PbO — 61,4 %, МоО3 — 38,6 %. Иногда наблюда ются примеси CaO, CuO, MgO, WO3, изредка CrO3 и V2O5.
Сингония тетрагональная; дипирамидальный в. с. L4PC. Пр. гр. I41/a (C 64h). a0 = 5,42; с0 = 12,08. Кристаллическая структура изображена на рис. 252. Облик кристаллов. Часто наблюдается в виде квадратных табличек, реже в виде комбинаций тупых или острых пирамид (рис. 254). Сплошные кри сталлические агрегаты встречаются сравнительно редко.
Рис. 254. Кристаллы вульфенита
Цвет вульфенита восково или медово желтый, серый, бурый, иногда оранжевый и даже красный. Черта белая или весьма слабо окрашенная. Блеск алмазный, жирный в изломе. Nm = 2,40 и Nр = 2,28.
Твердость 3. Спайность по {111} ясная. Уд. вес 6,3–7,0.
Диагностические признаки. Для вульфенита обычно характерны медово желтый цвет, таблитчатый облик кристаллов, алмазный блеск, большой удель ный вес и парагенезис с другими свинцовыми минералами зоны окисления.
П. п. тр. плавится. С содой на угле дает королек свинца. С фосфорной солью в окислительном пламени дает желтовато зеленое, а в восстанови тельном — темно зеленое стекло (реакция на Мо). В HCl растворяется медленно, покрывается белой пленкой PbCl2.
Происхождение и месторождения. Как трудно растворимая в воде соль довольно часто встречается в зонах окисления свинцово цинковых месторождений. Источник молибдена может быть двояким: либо молиб деновая кислота может приноситься просачивающимися водами из бо ковых пород, либо образуется в результате окисления и концентрации за счет молибдена, рассеянного в сульфидах самого месторождения.
Обычно вульфенит наблюдается в виде мелких кристалликов и крис таллических корок на стенках пустот выщелачивания. Известны также случаи образования псевдоморфоз вульфенита по другим свинцовым минералам зоны окисления, в частности по церусситу. В этом случае он ассоциирует с церусситом, англезитом и галенитом.
Не исключена также возможность его нахождения в низкотемпера турных гидротермальных месторождениях свинцово цинковых руд.
Раздел V. Кислородные соли (оксисоли) |
457 |
Хорошие кристаллы встречаются в месторождениях Сиджак (Кирги зия), Кызыл Эспе и Сортуз (Казахстан). Прекрасные кристаллы извест ны из Лос Ламентос в Чиуауа (Мексика).
Практическое значение. В случае наличия существенных количеств это го минерала вместе с другими окисленными минералами свинца может слу жить объектом добычи для получения наряду со свинцом также и молибдена.
3. Водные молибдаты и вольфраматы
Здесь мы кратко опишем пока еще недостаточно изученные водные кислородсодержащие соединения трехвалентного железа с молибденом и вольфрамом.
ФЕРРИМОЛИБДИТ — Fe23+[MoO4]3 . 8Н2О. Сингония ромбическая. Наблюдается в волокнистых или чешуйчатых массах серно желтого и кана реечно желтого цвета. Ng = 1,935–2,05, Nm = 1,733–1,79 и Np = 1,720–1,78.
Твердость 1–2. Спайность по {001} средняя. Уд. вес 4,5. Легко пла вится. Растворяется в кислотах и разлагается NH4OH.
Является продуктом изменения молибденита. Встречается в зонах окисления рудных месторождений, был известен на Алексеевском руд нике (Минусинский район).
ФЕРРИТУНГСТИТ — (W,Fe3+)(O,OH)3. Сингония гексагональная. Наблюдается в микроскопических пластинках и чешуйчатых агрегатах светло желтого или буровато желтого цвета. Оптически отрицательный, Nm = 1,80; Np = 1,72. Уд. вес 5,57. Другие физические свойства не изуче ны. Разлагается в кислотах с выделением WO3 желтого цвета. Как про дукт окисления вольфрамита был установлен в руднике Германия на ме сторождении Дир Грейл в окр. Вашингтон (США) и в других местах.
КЛАСС 6. ФОСФАТЫ, АРСЕНАТЫ И ВАНАДАТЫ
Общие замечания. К этому классу относится сравнительно большое число разнообразных по составу минеральных видов. Общее весовое ко личество их в земной коре, однако, относительно невелико.
Трехвалентные анионы [РО4]3–, [AsO4]3– и [VO4]3– обладают сравни тельно крупными размерами, поэтому наиболее устойчивые безводные соединения типа AXO4 можно ожидать в сочетании с трехвалентными крупными катионами. Во введении к описанию кислородных солей ука зывалось, что такими катионами являются ионы редких земель и Bi. Со единения с малыми катионами, как общее правило для всех типичных кислородных солей, гораздо шире представлены водными нормальными солями (с гидратированными катионами).
Из фосфатов двухвалентных металлов, но с дополнительными аниона ми (ОН, F, О, отчасти Cl) или в виде кислых соединений, наиболее устойчи выми являются соединения также с относительно крупными катионами (Са,
458 |
Описательная часть |
Sr и отчасти Pb), а для арсенатов и ванадатов характерны соединения с Pb, причем добавочным анионом служит Сl, и, наконец, двойные соединения Pb или Са с Cu, Zn, Mg и отчасти с Mn··. Для кальция, кроме того, известны водные кислые соли.
В связи с этим уместно остановиться на сравнении двухводных солей — фосфата и арсената Са между собой и с сульфатом Са (гипсом). Эти со единения кристаллизуются в моноклинной сингонии и имеют много весьма сходных свойств (табл. 13).
Таблица 13
Сравнение свойств некоторых соединений Са
Минерал |
|
|
|
|
|
|
a0 |
b0 |
с0 |
β |
Твер- |
Уд. |
||||
|
|
|
|
|
|
дость |
вес |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гипс — CaSO |
4 |
. 2H |
2 |
O |
|
|
|
|
|
|
10,47 |
15,15 |
6,28 |
98°58' |
2 |
2,31 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Брушит — СаНРО |
. 2Н |
2 |
О |
|
|
|
10,47 |
15,15 |
6,28 |
95°15' |
2 |
2,25 |
||||
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|||
Фармаколит — CaHAsO |
|
. |
2H |
2 |
O |
10,97 |
15,40 |
6,29 |
96°36' |
2–2,5 |
2,64 |
|||||
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
||
На этом примере мы еще раз наглядно убеждаемся в том, что катион Н1+, обладающий ничтожными размерами, будучи включен в кристалли ческую структуру, практически не влияет на ее размеры. Анионы [SO4]2– и [РО4]3–, как можно видеть из сопоставления приведенных данных, име ют совершенно одинаковые размеры, a [AsO4]3– — несколько больший. Соответственно анионам, показатели преломления в этих минералах воз растают от гипса к фармаколиту; однако двупреломление у всех этих ми нералов почти одинаковое. Удельные веса находятся в полном соответ ствии с атомными весами катионов в комплексных анионах (S3+, Р5+и As5+).
Что касается фосфатов и арсенатов двухвалентных малых катионов (Mg, Fe··, Ni, Co··, Cu··, Zn), то для них, как и следовало ожидать, весьма характерны водные нормальные соли с восемью, четырьмя и тремя моле кулами Н2О.
Одновалентные металлы (Na, Li), как правило, образуют двойные со единения с Аl3+, а также ряд редких сложных водных солей.
Особое положение по составу среди водных солей занимают так на зываемые «урановые слюдки» и сложные ванадаты.
Исключительный интерес представляют явления гетеровалентного изоморфизма, нередко устанавливаемые в данном классе соединений, в частности среди фосфатов. Особенно показательные примеры мы нахо дим по изоморфному замещению анионных радикалов.
Так, трехвалентный анион [РO4]3– может быть замещен одинаково построенными и равновеликими анионами: двухвалентными [SO4]2– и четырехвалентным [SiO4]4–. При этом могут иметь место разные случаи.
Раздел V. Кислородные соли (оксисоли) |
459 |
1.Изоморфное замещение в анионной части соединения происходит при сохранении состава и заряда в катионной части. В этом случае величина об щего заряда анионов не должна меняться. Это достигается тем, что при заме
не трехвалентного аниона [РO4]3– четырехвалентным анионом [SiO4]4– од новременно в состав минерала входит двухвалентный анион [SO4]2–. Только при этом условии общий заряд аниона может быть сохранен.
В этих случаях кристаллическая структура и физические свойства ми неральных видов, естественно, сохраняются. К этому можно добавить, что и среди катионов возможна одновременная замена ионов Ca2+ равновелики ми ионами Na1+, Y и TR (при сохранении состава и заряда в анионной части).
2.Изоморфное замещение в анионной части соединения может сопро вождаться одновременным замещением в катионной части с переменой ва
лентности. Так, в монаците, имеющем состав СеРО4, уже давно было заме чено, что иногда в существенных количествах присутствует SiO2, т. е. анион [SiO4]4–, и одновременно с этим к Се3+ изоморфно примешивается в соот ветственном количестве катион Th4+, иногда U4+ и Zr4+. В последнее время тонкими химическими анализами И. Д. Борнеман Старынкевич показала, что в некоторых монацитах изоморфная примесь Са2+ сопровождается
вхождением в состав анионной части двухвалентного аниона [SO4]2–.Та ким образом, общая химическая формула этих разновидностей монацита
должна быть написана в следующем виде: (Се,Th,Ca)[PO4,SiO4,SO4]; в слу чае доминировании кальция, при сохранении структурного типа монаци та, минерал получает видовое название чералит.
Надо указать, что при гетеровалентном изоморфизме не обязательно строгое совпадение количественных соотношений ионов в катионной и анионной частях разных соединений. Важно, чтобы: 1) суммарные поло жительные и отрицательные заряды были равны; 2) размеры заменяющих ионов были одинаковыми или близкими; 3) общее число катионов и ани онов сохранялось при замещении (за исключением тех случаев, когда в число катионов входит протон Н1+).
На общей характеристике физических свойств весьма разнообразных минералов данного класса мы останавливаться не будем. Они колеблют ся в широких пределах. Это более уместно сделать при описании отдель ных групп минералов.
Что касается условий образования относящихся к этому классу мно гочисленных минералов, то следует сказать, что подавляющее большин ство их, особенно водных соединений, связано с экзогенными процесса ми минералообразования (в зонах окисления рудных месторождений и осадочных отложениях). К числу эндогенных минералов относятся по чти исключительно фосфаты, причем большинство образуется в конеч ных стадиях магматических процессов, главным образом в пегматитах, иногда гидротермальных жилах. Для апатита (фосфата кальция) извест ны также магматические месторождения (в нефелиновых сиенитах).
460 |
Описательная часть |
Поскольку среди солей данного класса широко представлены как без водные, так и водные соединения, то, в отличие от сульфатов, все относя щиеся сюда минералы делятся на две большие группы:
1)безводные фосфаты, арсенаты и ванадаты;
2)водные фосфаты, арсенаты и ванадаты.
Безводные фосфаты, арсенаты и ванадаты
Безводные соединения данного класса в природе представлены срав нительно большим числом минералов. Кроме нормальных солей ортокис лот, известны редкие представители кислых солей. Гораздо шире распро странены основные соли.
1. Группа монацита
МОНАЦИТЫ — (Се, La, Nd...)[PO4]. «Монайзен» по гречески — быть уединенным. Встречаются обычно в виде единичных кристаллов.
Химический состав. Содержание окисей редких земель (главным об разом Ce, La и Nd, в зависимости от доминирования одного из которых монацит получает суффикс в скобках после названия) достигает 50—68 %; в виде изоморфной примеси присутствует Y2O3 (до 5 %). Содержание Р2O5 обычно колеблется в пределах 22—31,5 %. Довольно часто в виде изоморф ных примесей присутствует также ThO2 (до 5—10 %, в некоторых случа ях до 28 %), изредка ZrO2 (до 7 %) и наряду с ними SiO2 (до 6 %), а иногда CaO и наряду с ним SO3.
Таким образом, с кристаллохимической точки зрения мы здесь имеем замечательный пример гетеровалентного изоморфизма. Химическая фор мула таких разновидностей монацита должна, с использованием перемен
ных индексов, иметь следующий вид: (Се(1 x y)ThxCay)([PO4](1 x y 2z)
[SiO4](x+z)[SO4](y+z)).
В очень незначительных количествах содержится также MgO, MnO, PbO, Fe2O3, Al2O3 и Н2О.
|
Сингония моноклинная; призматический в. с. L2PC. |
|||||
|
Пр. гр. Р2 |
/п (C 5 |
). а = 6,79; b = 7,04; с = 6,74; β=104°24′. |
|||
|
1 |
2h |
0 |
0 |
0 |
|
|
Облик кристаллов обычно таблитчатый по {100} (рис. |
|||||
|
255), реже призматический, изометрический и пирами |
|||||
|
дальный. Из форм распространены: пинакоиды {100}, |
|||||
|
{010}, {101}, призмы {110}, {011} и др. Часто наблюдает |
|||||
Рис. 255. Таблит |
ся штриховка. Двойники по (100) и по (001). Встреча |
|||||
ется обычно в мелких кристаллах. Вес отдельных круп |
||||||
чатый кристалл |
||||||
ных экземпляров иногда все же достигал нескольких |
||||||
монацита |
||||||
килограммов.
Цвет монацита желтовато бурый, коричневый, красный, изредка зеленый. Блеск сильный стеклянный, жирный. Ng = 1,837, Nm = 1,787 и Np = 1,785.
Твердость 5–5,5. Спайность иногда совершенная по {001}. Уд. вес 4,9–5,5. Прочие свойства. Часто радиоактивный (присутствие ThO2).
