
Betekhtin
.pdf
Раздел V. Кислородные соли (оксисоли) |
421 |
Химический состав. CuO — 69,2 % (Сu — 55,3 %), СО2 — 25,6 %, Н2О — 5,2 %. Кристаллы в химическом отношении довольно чисты. Из механичес ких примесей как редкий случай в образцах из Березовского месторождения на Урале были установлены чешуйки вторичного самородного золота.
Сингония моноклинная; призматический в. с. L2PC.
Пр. гр. P21/c(C 52h). а0 = 4,96; b0 = 5,83; с0 = 10,27. Облик кристаллов. Наблюдающиесякристаллыимеютвидкорот
ких столбиков или призм, а также толстых таблиц (рис.
231). Встречается нередко в друзах мелких кристаллов, Рис. 231. Крис сплошных зернистых массах, иногда радиально лучистых агрегатах и в землистом состоянии («медная синь»).
Цвет азурита темно синий, в землистых массах голу бой. Черта голубая. Блеск стеклянный. Ng = 1,838, Nт = 1,758 и Np = 1,730.
Твердость 3,5–4. Хрупок. Спайность по {001} совершенная, по {100} несовершенная. Уд. вес 3,7–3,9.
Диагностические признаки. Легко узнается по характерному синему цве ту и ассоциации с малахитом и другими кислородными соединениями меди.
П. п. тр. легко плавится, в восстановительном пламени дает королек меди. В кислотах растворяется с шипением. Растворяется также в амми аке, окрашивая раствор в голубой цвет.
Происхождение. В небольших количествах почти постоянно встреча ется в парагенезисе с малахитом, часто отлагаясь после него. Нередко созда ются условия, при которых он менее устойчив, чем малахит, и замещается последним. Известны псевдоморфозы малахита по кристалликам азурита. Характерно, что этот позднейший малахит не обладает радиально волокни стым строением, а представлен сплошной скрытокристаллической массой.
Практическое значение. Вместе с другими кислородными соедине ниями меди идет в плавку в металлургических печах. Чистый азурит, если встречается в значительных массах, может употребляться для изготовле ния синей краски.
Водные карбонаты
Среди карбонатов, содержащих в своем составе молекулы Н2О, более распространены водные карбонаты Na, Mg, U и др. Здесь мы рассмотрим лишь десятиводный карбонат натрия.
НАТРОН — Na2[CO3] . 10Н2О. Назван по составу. В русской литера туре постоянно фигурирует под названием «сода», которое употреблялось еще в XVII в.; происхождение его неизвестно. Не следует называть его на тритом, это наименование относится к безводному минералу Na2[CO3].
Химический состав. Na2O — 21,6 %, CO2 — 15,4 %, Н2О — 63,0 %. Меха ническими примесями могут быть другие легкорастворимые соли натрия.
422 |
Описательная часть |
Сингония моноклинная; призматический в. с. L2PC. Кристаллическая структура не уточнена. Кристаллы имеют форму ромбоидальных таблиц. Обычно наблюдается в зернистых агрегатах.
Цвет. Бесцветная, белая или серая. Блеск стеклянный. Ng = 1,440, Nm = 1,425 и Np = 1,405.
Твердость 1–1,5. Спайность по {100} совершенная. Уд. вес 1,42–1,47. Из чистых насыщенных растворов Na2CO3 при атмосферном давлении выпадает в интервале температур от –2 до 32 °С.
Диагностические признаки. Легко растворима в воде. При действии HCl бурно выделяет углекислый газ. На воздухе быстро теряет воду и белеет. При слабом нагревании, так же как и многие другие богатые во дой кристаллогидраты, плавится, вернее, растворяется в собственной кри сталлизационной воде, выделяя термонатрит (Na2CO3 . H2O). При сплав лении остатка в ушке платиновой проволочки пламя окрашивается в интенсивный желтый цвет (реакция на натрий).
Происхождение. В значительных массах образуется в некоторых со ляных озерах, богатых натрием, при избытке растворенного СО2. Пола гают, что сода может возникать при реакции обменного разложения Na2SO4 с приносимым бикарбонатом кальция — Ca[НСО3]2. Образова ние ее может протекать и биохимическим путем при восстановлении суль фатов микроорганизмами и последующем воздействии углекислоты с выделением H2S по реакциям:
Na2SO4 → Na2S+O4;
Na2S + Н2О + СО2 → Na2CO3 + H2S.
В виде снежно белых выцветов и налетов она возникает на поверхно сти рыхлых горных пород и почв в странах с сухим жарким климатом.
Все известные крупные содовые озера у нас распространены в Азиат ской части России. В Доронинском содовом озере (Восточная Сибирь) она добывалась в зимнее время. С этой целью на поверхность льда выкачи вался рассол слоем до 6 см. В процессе замерзания рассола сода осажда лась на поверхности нижнего ледяного покрова. После улетучивания по верхностного льда (при сильных ветрах) она собиралась в кучи и отправлялась на завод для переработки. В подземных горных выработ ках горы Карнасурт в Ловозерском массиве нефелиновых сиенитов (Кольский полуостров) образующаяся в настоящее время сода, совмест но с опалом, образует сталактиты.
Соду выделяют озера Кулундинской степи к югу от ст. Кулунда (Се верный Казахстан): Петуховские и Михайловские озера. Садка соды в них начинается осенью, при понижении температуры (зимой она добы вается со дна озер).
Крупные содовые озера распространены в Триполи, Египте, Иране, Тибете, Юго Восточной Калифорнии (оз. Серлз) и др.
Раздел V. Кислородные соли (оксисоли) |
423 |
Практическое значение. Сода употребляется в самых различных от раслях промышленности: мыловаренной, стекольной, красильной, а также химической и металлургической. В странах, бедных содовыми озерами, сода получается искусственно, главным образом из мирабилита и галита.
КЛАСС 3. СУЛЬФАТЫ
Общие замечания. Необходимо прежде всего напомнить, что геохи мия серы характеризуется своеобразными особенностями, не свой ственными многим химическим элементам. Помимо того что этот эле мент способен давать электрически нейтральные 8 атомные молекулы S8 (см. о самородной сере), он образует различно заряженные положитель ные и отрицательные ионы. Как мы знаем, существуют отрицательно заря женные ионы S2– (аналог O2–) и [S2]2– как продукты электролитической дис социации H2S. С этими анионами связано образование сульфидов. В окислительной обстановке сера может давать молекулярное соединение SO2 (сернистый газ), а в растворах — комплексные анионы [SO3]2– и в бо лее окислительной среде [SO4]2–, в которых участвуют катионы S4+ и S6+ соответственно. Кристаллические образования, представляющие собой со единения металлов с этими анионами, называются сульфитами (всего два минеральных вида) и сульфатами (широко распространены в природе).
Таким образом, возникновение сернокислых солей металлов может происходить лишь в условиях повышенной концентрации кислорода или, как говорят, при повышенном парциальном давлении кислорода в окру жающей среде и при относительно низких температурах. Такие условия в земной коре, как известно, создаются вблизи земной поверхности, где и встречается подавляющая масса этих соединений как эндогенного, так и экзогенного происхождения.
Хотя среди минералов этого класса мы наблюдаем большое разнооб разие соединений, однако число устойчивых и широко распространен ных в земной коре сульфатов сравнительно невелико.
Для такого крупного комплексного аниона, каким является [SO4]2–, стойкие кристаллические структуры возможны лишь при сочетании этого аниона с крупными двухвалентными катионами. Действительно, как мы увидим, наиболее устойчивы сульфаты Ba, Sr и Pb. Катионы с меньшими ионными радиусами входят в состав сульфатов лишь в гидратированном состоянии, т. е. будучи одеты в «рубашку» из молекул Н2О. При этом чем меньше катион, тем большее количество молекул Н2О способно с ним свя заться. Для богатых водой сульфатов количество Н2О для одного и того же типа соединения может меняться в зависимости от давления паров Н2О во внешней среде. Так, например, для сульфата закиси железа существуют соли с семью, шестью, пятью и одной молекулами Н2О. Все они отличаются друг от друга своими особенностями кристаллических структур.
424 |
Описательная часть |
Одновалентные катионы щелочных металлов в состав простых суль фатов входят, естественно, в двойном количестве или в ассоциации с Н+. Они образуют слабые кристаллические структуры и легко растворяются в воде (так же как и сульфаты двухвалентных малых катионов).
Сульфаты трехвалентных металлов, главным образом Аl3+ и Fe3+, встречаются только в виде водных соединений.
Широко распространены двойные и более сложные соли одно , двух и трехвалентных металлов. Очень часто встречаются сульфаты с доба вочными анионами, чаще всего [ОН]1–, иногда Сl1–, [СО3]2–, [РО4 ]3– и др. Чаще всего это имеет место, когда в состав соединения входят трехвалент ные металлы или сильно поляризующие катионы Cu2+.
В заключение отметим некоторые общие для минералов этого класса физические свойства. Прежде всего обращает внимание, так же как и в карбонатах, отсутствие минералов с высокой твердостью. Среди сульфа тов мы не знаем минералов с твердостью выше 3,5. Для богатых водой минеральных видов она снижается даже до 2. Из оптических свойств суль фатов по сравнению с ранее рассмотренными классами солей характер ны гораздо более низкие величины двупреломления (Ng–Np). Встреча ются даже оптически изотропные минералы. Объясняется это тем, что тетраэдрические группы SO4 по сравнению с плоскими группами СО3 и NO3 представляют собой изометрические структурные единицы. Весьма характерно, что в тех сульфатах, которые в качестве дополнительного аниона содержат ион [СО3]2–, двупреломление значительно повышается (примером может служить каледонит — Pb5Cu2[SO4]3[CO3][OH]6).
При описании мы будем объединять минералы в группы, как обычно, по химическому составу и типам кристаллических структур. Однако та ких групп для безводных минералов оказывается очень немного. Осталь ные, довольно многочисленные и разнородные по составу минералы наи более целесообразно сгруппировать по признакам валентности катионов, объединив вместе безводные и водные сульфаты.
1. Группа барита
Сюда относятся сернокислые соединения Sr, Ba и Рb, не встреча ющиеся в природе в виде водных сульфатов. Безводный сульфат каль ция (ангидрит) хотя кристаллизуется в той же ромбической сингонии, что и указанные сульфаты, но существенно отличается от них как по кристаллической структуре, так и по формам кристаллов, что связано с меньшей величиной радиуса иона Ca2+. Так как ангидрит по условиям образования в природе чрезвычайно тесно связан с водным сульфатом кальция (гипсом), то подробную характеристику его мы дадим отдель но, вместе с гипсом.
БАРИТ — Ba[SO4]. От греч. барос — тяжесть. Большой удельный вес этого минерала легко ощутим в руке. Среди очень немногочисленных
Раздел V. Кислородные соли (оксисоли) |
425 |
бариевых минералов барит является главным, а среди безводных суль фатов — наиболее распространенным после ангидрита.
Химический состав. BaO — 65,7 %, SO3 — 34,3 %. В виде изоморфных примесей устанавливаются Sr и Са. Разновидность с высоким содержа нием стронция называется баритоцелестином. Изредка встречаются раз ности, богатые Рb и Ra (хокутолит). Из посторонних примесей устанав ливаются иногда Fe2O3, глинистые, органические и прочие вещества.
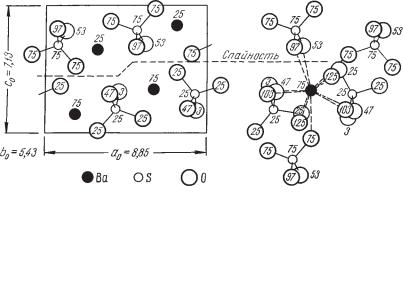
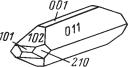
Сингония ромбическая, ромбо дипирамидальный в. с. 3L23PC. Пр. гр. Pnma(D162h). а0 = 8,85, b0 = 5,43; с0 = 7,13. Кристаллическая структура. На рис. 232 показана проекция элементарной ячейки структуры на плоскость (010). Ионы Ba2+ и S6+ располагаются на расстояниях 1/4 и 3/4 высоты b (см. цифры). Группы SO4 представляют собой не совсем правильные тет раэдры и, как можно видеть по цифрам, ориентированы неодинаково. Каждый ион Ba окружен двенадцатью кислородными ионами, принадле жащими к семи различным группам SO4 (рис. 232). Облик кристаллов. Часто встречающиеся кристаллы барита обычно обладают таблитчатым обликом (рис. 233а) вследствие развития грани {001}. Реже распростра нены призматические, столбчатые (рис. 233б), обычно образованные гос подствующими гранями призм {011} или {101} в комбинации с {001}, и изометрические кристаллы (рис. 233в). Часто чрезвычайно богаты ком бинациями. Двойники редки; обычно наблюдаются полисинтетические двойники, обусловливающие штриховатость на гранях. Характерны рас щепленные кристаллы, иногда имеющие форму «розы». Агрегаты чаще
Рис. 232. Кристаллическая структура барита в проекции на плоскость (010)
а |
б |
в |
Рис. 233. Кристаллы барита
426 |
Описательная часть |
зернистые, реже плотные, скрытокристаллические, землистые. Наблю даются также в виде сталактитов и других «натечных» форм с концент рически зональным строением. Известны шаровидные и эллипсоидаль ные конкреции с радиально лучистым строением. В пустотах часто удается наблюдать эффектные друзы небольших кристаллов.
Цвет. Встречаются бесцветные водяно прозрачные кристаллы. Боль шей же частью барит посторонними примесями окрашен в белый или се рый (микроскопическими включениями газов и жидкостей), красный (окисью железа), желтый или бурый (вероятно, гидроокислами железа), темно серый и черный (битуминозными веществами), иногда голубова тый, зеленоватый и другие оттенки. Блеск стеклянный, на плоскостях спайности {010} перламутровый. Ng = 1,648, Nm = 1,637 и Np = 1,636.
Твердость 3–3,5. Хрупок. Спайность по {001} совершенная, по {210} средняя и по {010} несовершенная. Уд. вес 4,3–4,5.
Диагностические признаки. Среди наиболее широко распространен ных сульфатов барит обладает самым большим удельным весом (лишь у англезита уд. вес выше). Характерны совершенная спайность в одном направлении, нерастворимость в HCl даже при нагревании (отличие от всех карбонатов). От некоторых силикатов, похожих на него по спайнос ти и другим признакам, отличается значительно меньшей твердостью. Без химических реакций трудно отличим от целестина.
П. п. тр. растрескивается, сплавляется лишь в тонких осколках по кра ям, причем пламя окрашивается в желто зеленый цвет (характерно для бария). С содой на платиновой пластинке сплавляется в прозрачную мас су, которая по охлаждении становится мутной (при сплавлении на угле эта масса расплывается и впитывается внутрь). В отличие от целестина, сернистый барий, получающийся в восстановительном пламени п. п. тр., после смачивания HCl окрашивает пламя не в карминно красный, а в желто зеленый цвет. В концентрированной H2SO4 в порошкообразном состоянии медленно растворяется. От прибавления воды раствор мутне ет, т. е. снова выделяется Ba[SO4].
Происхождение и месторождения. Барит в природе образуется различ ными путями, но лишь в условиях повышенного парциального давления кислорода и при относительно низких температурах. Поэтому он, подобно всем другим безводным сульфатам, не встречается как магматогенный ми нерал в изверженных, а также в глубинных метаморфических породах.
В гидротермальных месторождениях он довольно обычен. В качестве спутника он устанавливается во многих месторождениях сульфидных, марганцевых (с манганитом, браунитом), железных (с сидеритом, гема титом) и других руд. Известны золото баритовые жилы. Встречаются почти чисто баритовые, барито кальцитовые, барито флюоритовые жилы с небольшой примесью кварца и редких сульфидов (галенита, сфалери та, халькопирита, иногда киновари и др.).
Раздел V. Кислородные соли (оксисоли) |
427 |
Барит в небольших количествах, главным образом в виде конкреций, распространен также в осадочных породах, но в иных условиях, чем ангид рит, гипс и целестин. Он, например, никогда не встречается в соляных ме сторождениях, крайне редок в известняках, но зато часто устанавливается
восадочных месторождениях марганца (в окисных и карбонатных рудах), железа, в глинистых, песчанистых и других осадках прибрежных зон мо рей. Объясняется это тем, что растворимые соли бария, приносимые с суши
поверхностными водами, при первой же встрече с ионами [SO4]2– в мор ских водах образуют практически нерастворимый сульфат бария. Желва ки барита обнаруживаются среди илов и в современных морях.
Взонах выветривания горных пород и рудных месторождений в рай онах с сухим климатом при внимательном изучении мелкие кристаллы барита часто столбчатого облика нередко устанавливаются в ассоциации с гипсом и гидроокислами железа.
Барит — химически устойчивый минерал, поэтому устанавливается
вэлювии, нередко в крупных обломках, а также 6 шлихах, получаемых при промывке россыпей. Однако как все минералы, обладающие хоро шей спайностью и невысокой твердостью, по мере продвижения в россы пи быстро измельчается и постепенно исчезает.
Из многочисленных месторождений барита в России укажем лишь гидротермальные месторождения Белореченское (Краснодарский край)
иДжаланкол (Карачаево Черкесия).
ВЗападной Грузии имеется ряд жильных баритовых месторождений
вКутаисском, Болнисском и других районах, среди туфов и эффузивных пород (порфиритов). Сплошные баритовые массы симметрично полос чатого или колломорфного строения в виде примесей содержат: кальцит,
вочень небольшом количестве кварц, изредка пирит, халькопирит и га ленит. На полуострове Мангышлак (Зап. Казахстан) в крупном по запа сам месторождении Аурташ барит осадочного происхождения образует пласт в известняках можностью до 0,5 м, распространенный на огромной площади на глубине до 3 м. Месторождения Каракалинского района в Туркмении (в горах Копетдага) также представлены целой серией жил в осадочных породах (песчаниках, глинистых сланцах и др.). В ряде жил
(Арпаклен) барит находится в ассоциации с витеритом — Ва[СО3], кото рый местами псевдоморфно развивается по бариту.
К числу крупнейших иностранных месторождений барита принадлежит Мегген в Вестфалии (Германия). Здесь огромной длины (до 7 км) платооб разная залежь, местами сопровождающаяся залежью сульфидов, главным образом пирита, располагается на границе между средне и верхнедевонски ми осадками. Происхождение этой залежи точно не выяснено. Красивые кристаллы и розы барита известны в Стоунхэме в Колорадо (США).
Практическое значение. Барит находит широкое применение в раз личных отраслях промышленности.
428 |
Описательная часть |
1.В виде тонкоизмельченного порошка как утяжелитель вводится
всостав «глинистых растворов», используемых для цементации рыхлых пород при бурении нефтяных залежей с целью борьбы с газовыми выбро сами и укрепления стенок скважин.
2.В химической промышленности является сырьем для изготовления раз личных солей и препаратов, используемых в пиротехнике, кожевенном деле (для удаления шерсти), сахарном производстве, при изготовлении фотобума ги, в керамике для производства эмалей, для выплавки специальных стекол, обладающих высоким коэффициентом преломления, в медицине и т. д.
3.В резиновой и бумажной промышленности применяется в качестве наполнителя и утяжелителя.
4.В лакокрасочной промышленности употребляется для производства высокосортных белил (в смеси с ZnO и ZnS), цветных красок и др.
5.Как главная составная часть штукатурки для стен рентгеновских лабораторий употребляется с целью защиты работников от вредного дей ствия рентгеновских лучей.
6.Металлический барий применяется для изготовления некоторых радиоламп.
ЦЕЛЕСТИН — Sr[SO4]. От лат. celestis — небесный (первые найден ные образцы этого минерала имели нежно голубой оттенок). Относитель но редко встречается, но среди минералов стронция является главным.
Химический состав. SrO — 56,4 %, SO3 — 43,6 %. Иногда содержит Са и Ba (нередко в значительных количествах).
Сингония ромбическая; ромбо дипирамидальный в. с. 3L23PC. Пр. гр.
Pnma(D16). а = 8,36; b = 5,36; с |
0 |
= 6,84. |
||
2h |
0 |
0 |
|
|
|
|
Кристаллическая структура совершенно анало |
||
|
|
гична структуре барита. Облик кристаллов. Встре |
||
|
|
чающиеся кристаллы очень похожи на кристаллы |
||
|
|
барита. Обычно имеют таблитчатый, столбчатый |
||
Рис. 234. Кристалл |
или призматический (рис. 234) облик, нередко про |
|||
являют блочность и склонны к расщеплению. Аг8 |
||||
целестина |
регаты чаще зернистые, реже шестоватые, жилко |
|||
ватые и скорлуповатые. Встречается в виде желваков и секреций, причем в пустотах наблюдаются друзы кристаллов.
Цвет целестина голубовато белый или голубовато серый, реже с крас новатым или желтоватым оттенком. Иногда обнаруживаются бесцветные, водяно прозрачные кристаллы. Блеск стеклянный, на плоскостях спай ности — перламутровый отлив. Ng = 1,631, Nm = 1,624 и Np = 1,622. Твер8 дость 3–3,5. Хрупок. Спайность по {001} совершенная, по {210} средняя и по {010} несовершенная. Уд. вес 3,9–4,0.
Диагностические признаки. В зернистых массах от карбонатов Mg, Са, Sr, Ba и др. отличим по поведению в кислотах (карбонаты при растворении с нагреванием выделяют СО2). По цвету иногда похож на ангидрит, но от
Раздел V. Кислородные соли (оксисоли) |
429 |
личается по направлениям спайности и большему удельному весу. От ба рита часто трудно отличим. Очень характерна реакция на стронций.
П. п. тр. плавится в белый шарик, окрашивая пламя в интенсивный карминно красный цвет, особенно после смачивания НСl (реакция на стронций). На угле с содой дает серную печень. В крепкой H2SO4 раство ряется. Раствор мутится при прибавлении воды.
Происхождение и месторождения. Целестин в более или менее зна чительных массах в виде желваков, гнезд, иногда сплошных залежей встре чается в толщах осадочных пород (в доломитах, известняках, гипсонос ных глинах, мергелях и др.). Его находки нередко бывают приурочены к определенным горизонтам среди этих пород.
Он был также установлен в морских организмах, в частности в скелетах одной группы радиолярий. Иногда он встречается в раковинах аммонитов и в других окаменелостях как результат позднейшего отложения в них.
Известны, правда, очень редкие, но типичные гидротермальные жилы целестина, содержащие галенит, сфалерит и другие сульфиды. Наблю дался также в миндалинах изверженных пород.
Целестин довольно часто встречается в виде секреций в осадочных гипсоносных породах пермского возраста, распространенных в Архангель ской области (долина р. Пинега), в Верхнем и Среднем Поволжье с само родной серой (Водинское), в Башкирии, Оренбургской области и др. Зна чительное количество пунктов нахождения известно также в Закаспии (в Туркмении (Бейнеу Кыр, Арик), на о. Мангышлак (Унгозя)) и других районах Средней Азии.
Из иностранных месторождений отметим крупные месторождения це лестина в районах Бристоля (Англия), Вестфалии и Вальдека (Германия).
Практическое значение. Целестин является главным источником солей стронция, употребляемых в пиротехнике (для получения яркого карминно красного пламени) и в химической промышленности: сахар ной (в виде окиси стронция для удаления сахара из меломассы), стеколь ной и керамической (для изготовления иризирующих стекол, особых гла зурованных кирпичей) и пр. В последнее время начали применять стронций в виде металла при производстве специальных сплавов, напри мер, в качестве присадки к меди с целью повышения ее прочности и од нородности (электропроводность при этом не снижается).
АНГЛЕЗИТ — Pb[SO4]. Впервые был установлен на о. Англези (Уэльс), откуда и произошло его название.
Химический состав. PbO — 73,6 % (Pb — 68,3 %), SO3 — 26,4 %. От примесей обычно свободен. Известна разность, богатая BaO (8,45 %).
Сингония ромбическая; ромбо дипирамидальный в. с. 3L23PC. Пр. гр.
Pnma (D162h). а0 = 8,45; b0 = 5,38; с0 = 6,93. Кристаллическая структура
совершенно аналогична структуре барита. Облик кристаллов. Крис таллы англезита часто весьма богаты комбинациями граней. Обычно

430 |
Описательная часть |
имеют таблитчатый облик (рис. 235), реже ко роткостолбчатый или пирамидальный. Крупные кристаллы вообще редки. Агрегаты. Чаще встре чается в виде кристаллических корочек на гале ните, друз мелких кристаллов, в плотных зерни стых или землистых массах.
Цвет. Бесцветен и часто водяно прозрачен. Нередко окрашен в серый, желтоватый или бу рый цвет (гидроокислами железа). Наблюда
ющийся иногда черный цвет обусловлен микроскопическими включени ями неразложившегося галенита. Блеск алмазный. Ng = 1,894, Nm = 1,882 и Np = 1,877.
Твердость 2,5–3. Весьма хрупок. Спайность по {001} средняя, по {210} и {010} несовершенная. Уд. вес 6,1–6,4.
Диагностические признаки. Для англезита характерны высокий удельный вес, алмазный блеск, в окисленных рудах тесная ассоциация
сгаленитом и поведение перед паяльной трубкой.
П.п. тр. растрескивается и легко плавится. На угле с содой дает сер ную печень и затем в восстановительном пламени — королек свинца.
В концентрированной H2SO4 растворяется лишь при нагревании. Одна ко полностью растворяется в КОН (отличие от целестина и барита).
Происхождение и месторождения. Как труднорастворимый продукт окисления галенита и других сернистых соединений свинца англезит об разуется главным образом в зонах окисления свинцово цинковых суль фидных месторождений, очень часто в ассоциации с гораздо более рас
пространенным церусситом Pb[CO3].
Как показывает изучение под микроскопом, англезит является пер вым кислородным соединением свинца, которое возникает при окисле нии галенита по периферии и вдоль направлений спайности по реакции:
PbS + O4 = PbSO4. Однако англезит под влиянием углекислоты, в свою очередь, легко переходит в карбонат свинца — церуссит (Pb[CO3]). Оба эти минерала в силу низкой их растворимости в воде обычно образуют вокруг кусков сплошного галенита белую корку, предохраняющую от дальнейшего окисления центральные участки галенита1. Этим объясня ется тот факт, что при разбивании округлых белых желваков, казалось бы, нацело окисленных свинцовых руд в центральных частях, нередко обнаруживается сплошной галенит.
Характерно также, что общее содержание свинца в зонах окисления всегда выше, чем в первичных сульфидных рудах. Это обусловлено тем,
1 На этом свойстве основано хранение серной кислоты в сосудах, внутренние стенки которых покрыты слоем металлического свинца: образующаяся нерастворимая тонкая обо лочка PbSO4 столь плотна, что не допускает дальнейшего превращения свинца в сульфат.
