
Betekhtin
.pdfРаздел I. Самородные элементы и интерметаллические соединения |
191 |
Происхождение и месторождения. В природе графит образуется при восстановительных процессах в условиях высоких температур.
Встречается иногда среди магматических горных пород разнообраз ного состава, преимущественно щелочных. Источником углерода во мно гих случаях являются вмещающие углеродсодержащие горные породы.
Известны случаи находок графита в пегматитах. Встречаются мета' соматические месторождения на контактах известняков с изверженными породами, а также жильные месторождения крупнолистоватого графита.
Широко распространены метаморфические месторождения графита, возникшие за счет каменных углей или битуминозных отложений в усло виях регионального метаморфизма или под влиянием интрузий магмы.
К числу крупных месторождений графита в Росии относится Алибе' ровское в Тункинских горах (Прибайкалье). Графит залегает среди извер женных пород (сиенитов) в виде штоков и представляет собой смесь пре красного по качеству чешуйчатого или мелкокристаллического графита с магматическими минералами (микроклином, нефелином и др.). Места ми по окраинам эти тела сопровождаются грубозернистым известняком. Сами магматические породы также содержат графит. Очень интересны графитовые образования типа секреций, распространенные среди плот ных масс графита. Эти неправильной формы тельца имеют наружную ко рочку из тангенциально ориентированных чешуек и радиально лучистое строение внутренней части. Образование графита связывают с восстанов лением окиси углерода, выделявшейся при поглощении магмой извест няков. С воздействием основных пород на известняки или каменные угли связано, по видимому, образование графита вдоль базальтовых даек на месторождении Курейка (плато Путорана, Средняя Сибирь). На круп ном месторождении Чебере (Алдан) метаморфогенный графит с кварцем образует высокие концентрации в мощных слоях гиперстен биотитового плагиогнейса, что обеспечивает значительные запасы.
Вдоль северо западного побережья Азовского моря (к северу от Мари уполя) и в других местах Украины разрабатываются вкрапленные круп ночешуйчатые графитовые руды, залегающие в виде выветрелых на по верхности пластов в древних метаморфических породах — гнейсах. Одним из мировых центров добычи графита традиционно являлся остров Цей' лон (Шри Ланка), во многих местах которого между пластами гнейсов и известняков развиты прерывистые наклонные жилы сплошного графи та. Значительные месторождения известны также в Канаде (пров. Квебек и Онтарио), Англии (Камберленд) и др.
Практическое значение. Графит применяется для самых различных видов производства: для изготовления графитовых тиглей, в литейном деле, производстве карандашей, электродов, для смазки трущихся час тей, в красочной промышленности и др.

Раздел II
СУЛЬФИДЫ, СУЛЬФОСОЛИ И ИМ ПОДОБНЫЕ СОЕДИНЕНИЯ
Общие замечания. К рассматриваемому разделу относятся сернис тые, селенистые, теллуристые, мышьяковистые сурьмянистые и висму тистые соединения металлов1. К ним принадлежит весьма значительное количество важных в промышленном отношении минералов, играющих существенную роль в составе многочисленных месторождений металли ческих полезных ископаемых.
Наибольшее число минералов представлено сернистыми соединени ями (сульфидами, сульфосолями)2. Все сульфиды, за исключением серо водорода, в природе распространены в твердом состоянии.
Общее число химических элементов, дающих в том или ином виде бескислородные соединения с серой, достигает 40. Главнейшие из них следующие: Н, V, K, Са, Mg, Mn, Fe, Ni, Co, Сu, Zn, Ga, Ge, As, Mo, Ru, Rh, Pd, Ag, Cd, In, Sn, Sb, Re, Os, Ir, Pt, Hg, Tl, W, Pb и Bi.
Общее весовое количество сернистых соединений, по приблизитель ному подсчету В. И. Вернадского, составляет максимум 0,15 % (к весу земной коры), причем главенствующее значение из металлов в этих со единениях имеет Fe. Сернистые соединения всех остальных элементов, не считая сероводорода, в весовом отношении в земной коре составляют ничтожный процент (около 0,001 %). Из них типичные соединения с се рой образуют: Zn, Pb, Cu, Ag, Sb, Bi, Fe, Ni, Co, Mo и Hg.
Селенистые соединения (селениды) известны для следующих элемен тов: Н, Cu, Ag, Pd, Hg, Co, Cd, Fe, Zn, Pb и Bi. Кроме того, селен нередко присутствует в сернистых соединениях в виде изоморфной примеси к сере.
Теллуристые соединения (теллуриды) по сравнению с селенидами пользуются в природе несколько более широким распространением, хотя число элементов, соединяющихся с теллуром, все же ограничено. Эти элементы: Сu, Ag, Аu, As, Hg, Pb, Bi, Ni, Co, Fe и Pt. Все они образуют самостоятельные минералы.
Мышьяковистые простые соединения (арсениды) установлены для следующих немногих элементов: Fe, Ni, Co, Cu, Ru, Pd, Rh, Ir и Pt. Более
1 Многие теллуриды, арсениды, антимониды и висмутиды имеют преобладающую долю металлического типа связи и могут рассматриваться в первом разделе классифи кации в качестве интерметаллидов.
2 Сульфосолями (тиосолями) называют соли гипотетических сульфокислот (тиокис лот), в которых роль сульфоангидридов играют As2S3, Sb2S3, Bi2S3 и др.
Раздел II. Сульфиды, сульфосоли и им подобные соединения |
193 |
широко распространены сложные соединения в виде сульфосолей — суль фоарсенитов, главным образом для следующих металлов: Сu, Ag и Pb.
Сурьмянистые простые соединения (антимониды) известны для Ni, Co, Pt, Pd, Rh, Ag и Au. Часто устанавливаются сложные соединения — сульфоантимониты Ni, Co, Сu, Ag, Au, Tl, Hg, Ir, Rh, Fe и Pb.
Висмутистые простые соединения в природе практически неизвест ны, за исключением висмутидов платины, палладия и золота, относимых к интерметаллидам. Наблюдаются лишь сульфовисмутиты Сu, Ag и Pb.
Количество простых селенистых, теллуристых, мышьяковистых, сурь мянистых и висмутистых соединений несравненно меньше, чем сернис тых соединений.
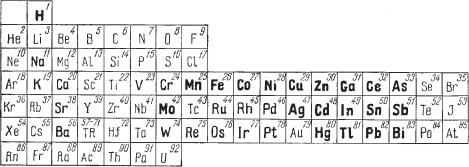
Химические особенности соединений. Если мы обратимся к таблице химических элементов Д. И. Менделеева (рис. 88), то заметим, что сернис тые соединения характерны для элементов, располагающихся почти исклю чительно в правой части этой таблицы, особенно для металлов так называ емых побочных рядов периодической системы. То же самое можно сказать и о селенистых, теллуристых, мышьяковистых и других соединениях.
Рис. 88. Элементы, для которых характерны минералы — сульфиды,
иим подобные соединения (набраны полужирным шрифтом)
Влевой части таблицы особняком стоит лишь водород, сернистое со единение которого H2S является аналогом воды и играет огромную роль
вобразовании сульфидов металлов.
Явно выраженное сродство серы с тяжелыми металлами проявляется в том, что она образует с ними почти нерастворимые в воде сернистые соединения. В противоположность им подобные же соединения большин ства легких металлов (Na, К, Mg и др.) устанавливаются лишь в раство ренном состоянии в водах.
В химическом отношении рассматриваемые здесь соединения часто сравнивают с кислородными соединениями — простыми окислами и кис лородными солями. Действительно, в химических формулах этих типов
194 |
Описательная часть |
соединений имеются общие черты (например, Си2О и Cu2S, HgO и HgS,
Sb2O3 и Sb2S3 и т. д.).
Большинство простых сернистых, селенистых и теллуристых соеди нений с химической точки зрения являются производными H2S, H2Se и Н2Те (например: халькозин Cu2S, сфалерит и вюрцит ZnS, антимонит Sb2S3, тиманнит HgSe, клаусталит PbSe, алтаит PbTe и др.).
К сложным сернистым соединениям относятся или двойные соедине' ния, или такие, которые с химической точки зрения приходится относить к особому классу сульфосолей. В химическом отношении практически любая сульфосоль может быть формально представлена как продукт вза имодействия двух или большего числа простых сернистых соединений: сульфооснования AxSy (где символом A обозначен некоторый металл) и сульфоангидрида BkSl (B — полуметалл As, Sb или Bi). В результате мо жем получить сульфосоль любого наперед заданного состава: так 2PbS+ +Bi2S3 = Pb2Bi2S5 (козалит).
Кроме того, распространены простые соединения типа А[Х2] — дисуль' фиды, которые В. И. Вернадский относит к производным H2S2. Сравни вая с окислами, он считает их аналогами перекисей (персульфидами). Действительно, дисульфиды при нагревании легко отдают часть серы, подобно перекисям, теряющим часть кислорода.
Арсениды и антимониды (простые соединения металлов с мышьяком и сурьмой) существенно отличаются по химической природе от сернис тых соединений. Ни мышьяк, ни сурьма не могут являться изоморфны ми заместителями серы, как это принималось в старое время. К таким соединениям относятся, например, NiAs, NiSb, Fe[As2], Co4[As4]3 и др. К персульфидам и диарсенидам очень близки по химическим и физиче ским свойствам также сульфоарсениды (Fe[AsS] и др.) и сульфоантимо' ниты (Ni[SbS] и др.).
Многие соединения из рассматриваемого класса образуют друг с дру гом твердые растворы в виде непрерывных рядов или с ограниченной смесимостью в твердом состоянии. К ним, например, можно отнести ряды: HgS — HgSe, Co[As2] — Ni[As2] — Fe[As2] и многие другие. Наконец, ши роко распространены полиморфные и политипные модификации.
Многие соединения из рассматриваемого класса образуют друг с дру гом твердые растворы в виде непрерывных рядов или с ограниченной смесимостью в твердом состоянии. К ним, например, можно отнести ряды: HgS — HgSe, Co[As2] — Ni[As2] — Fe[As2] и многие другие.
Особенности кристаллического строения и физические свойства.
Как показывают имеющиеся данные рентгенометрических исследований, сульфиды и им подобные соединения должны быть отнесены к ионно ковалентным соединениям, иногда с некоторым участием металлической связи. В большинстве своем они сильно отличаются от типичных ион ных кислородных соединений по целому ряду весьма характерных свойств
Раздел II. Сульфиды, сульфосоли и им подобные соединения |
195 |
и стоят гораздо ближе к самородным элементам, чем к окислам и кисло родным солям. Эти отличия обусловлены свойствами самих атомов или ионов, входящих в состав сернистых, селенистых, теллуристых, мышья ковистых и сурьмянистых соединений.
Ионы S, Se, Те, As и Sb по сравнению с кислородом обладают сущест
/
венно большими радиусами, более легкой способностью поляризоваться
иобразовывать слабые гомополярные связи. С другой стороны, ионы металлов, образующих с ними соединения, в менделеевской таблице за нимают места в правой части (в семействе железа и побочных рядах боль ших периодов) и принадлежат к числу сильно поляризующих ионов с 18 электронной наружной оболочкой. Комплексные ионы, хотя и наблю даются в сложных сернистых соединениях — сульфосолях, не обладают столь прочными связями, как это имеет место, например, в силикатах
идругих кислородных солях.
Явление поляризации приводит к тому, что в кристаллических струк турах происходит значительное объединение и делокализация электронов соседних противоположно заряженных ионов, о чем можно сделать за ключение по явно выраженному для большинства сульфидов и подобных им соединений металлическому блеску, свойственному вообще типичным металлам. С этим легко увязывается также и электропроводность большин ства сернистых, мышьяковистых и прочих соединений. Этим объясняют ся и наблюдающийся иногда недостаток атомов металлов по сравнению с атомами неметаллов (например, в пирротине — Fe1–XS), нередкое отсутствие строгих дальтоновских соотношений в составе минералов и т. д.
В соединениях с S, Se, Те металлические свойства увеличиваются по мере замены серы селеном и теллуром. В ряду семейства железа усиле ние этих свойств происходит по мере приближения от Мn к Ni. To же са мое мы можем заметить в ряду As, Sb и Вi, где металлические свойства усиливаются по мере приближения к висмуту. Действительно, висмутин (Bi2S3) характеризуется более сильным металлическим блеском, чем ан тимонит (Sb2S3), тогда как аурипигмент (As2S3) полупрозрачен и облада ет лишь алмазным блеском.
Об условиях нахождения в природе. Подавляющая масса скоплений сернистых и им подобных соединений наблюдается в рудных месторожде ниях гидротермального происхождения. Это обстоятельство и служит ос нованием к предположению о том, что тяжелые металлы из магматических очагов выносятся в виде летучих или легкоподвижных соединений и вы падают в условиях пониженных давлений и температур преимуществен но в виде сернистых соединений. На основании экспериментальных дан ных допускают, что перенос этих соединений в гидротермальных растворах мог совершаться в виде истинных растворов тяжелых метал лов в соединении с Cl, F, В и др., из которых при более низких температурах вследствие увеличения диссоциации растворенного H2S на ионы Н+ и S2–
196 |
Описательная часть |
выпадают сернистые соединения как труднорастворимые продукты хими ческих реакций обменного разложения (А. Г. Бетехтин). При этом в раство рах могли принимать участие и комплексные соли с сернистыми щелоча ми или их сульфогидратами (NaHS, KHS и др.), в которых легко растворяется и золото. При распаде этих соединений при низких темпера турах наряду с обычными сульфидами металлов могло образоваться и зо лото в самородном виде (сульфиды его неизвестны в природе, хотя теллу риды встречаются).
В иных условиях происходит образование сульфидов в осадочных глинистых породах, а также в битуминозных и угленосных отложениях. Обычными сульфидами в этих породах являются пирит и марказит Fe[S2]. Они образуются в восстановительных условиях при наличии Н2S, воз никающего в результате разложения белковых веществ в органических остатках без доступа кислорода или при недостатке его и во многих слу чаях, по видимому, не без участия бактерий.
При процессах выветривания, т. е. в присутствии воды и кислорода почти все относящиеся сюда минералы, легко окисляясь, разлагаются, образуя первоначально большей частью легко растворимые в воде суль фаты, а затем гидроокислы, окислы, карбонаты и другие кислородные соединения, характеризующие состав так называемой зоны окисления рудных месторождений. Исключение составляют лишь некоторые хими чески устойчивые в этих условиях минералы: киноварь (HgS), сперрилит (Pt[As2]) и лаурит (Ru[S2]).
Классификация сульфидов и им подобных соединений. Основываясь на химической характеристике отдельных типов соединений, все рассматрива емые здесь соединения необходимо прежде всего разделить на два класса.
Класс 1. Простые сернистые, селенистые, теллуристые, мышьяковис тые и сурьмянистые соединения; сюда же включим и минералы типа двой ных соединений.
Класс 2. Сульфосоли, т. е. минералы, близкие по химической консти туции к солеобразным типам соединений.
КЛАСС 1. ПРОСТЫЕ СЕРНИСТЫЕ И ИМ ПОДОБНЫЕ СОЕДИНЕНИЯ
За исключением сероводорода, все простые сернистые и им подобные соединения в земной коре распространены в виде твердых кристалличе ских веществ и являются минералами. Среди них по типам химических соединений выделяются различные главные группы минералов (сульфи дов, арсенидов и антимонидов).
1. Группа халькозина
Вэтой группе объединяются минералы меди и серебра типа A2S, A2Se
иА2Те. Многие из них существуют в природе в двух модификациях: бо
Раздел II. Сульфиды, сульфосоли и им подобные соединения |
197 |
лее высокотемпературной кубической и низкотемпературной ромбиче ской или моноклинной.
ХАЛЬКОЗИН — Cu2S. Название происходит от греч. халькос — медь. Синоним: медный блеск.
Для Cu2S существует три модификации — одна низкотемпературная, ус тойчивая ниже 91 °С ромбической сингонии (собственно халькозин или β халькозин), и две высокотемпературных (выше 91 °С): гексагональная и ку бическая (α халькозин). Гексагональная модификация, имеющая состав, точно отвечающий формуле Cu2S, неустойчива и, распадаясь, переходит в кубическую модификацию — α халькозин (дигенит), имеющий антифлюо ритовую структуру и состав Cu2–XS, где x = 0,03 – 0,11 (а0 = 5,55). Условием устойчивости α халькозина является статистический пропуск ~10 % поло жений Сu с заменой других 10 % одновалентной меди на двухвалентную.
Высокотемпературная гексагональная модификация Cu2S имеет структуру с плотнейшей гексагональной упаковкой анионов серы. Ионы меди помещаются в центрах всех треугольников из анионов серы каждо го слоя укладки, a0 = 3,89, с0 = 6,68.
Природный халькозин нередко представляет собой смесь низкотем пературного ромбического (β халькозина) и α халькозина.
Химический состав. Сu — 79,9 %, S — 20,1 %. Обычно имеются при меси: Ag, иногда Fe, Co, Ni, As, Аu. Некоторые из них, по крайней мере последние, обусловлены механическими примесями.
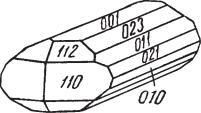
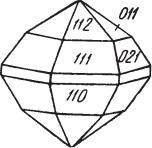
Сингония ромбическая; ромбо дипирамидальный в. с. 3L23PC. Пр. гр. Аb2т(2152v). a0 = 11,9; b0 = 27,2; с0 = 13,41. Изредка псевдокубический. В тех случаях, когда халькозин кристаллизуется при температуре ниже 91 °С, обычно наблюдаются следующие грани призм: {110}, {021}, {011}, {023}, пи накоида {001}, ряда дипирамид {111}, {112}, {113} и др. Кристаллическая структура ромбического халькозина
очень сложная и в деталях не изучена. |
|
Облик кристаллов. Кристаллы наблю |
|
даются сравнительно редко. Большей |
|
частью они встречаются в виде толстых |
|
таблиц по {001} и коротких столбиков |
|
вдоль оси а (рис. 89), но нередко они |
|
имеют гексагональный облик (рис. 90). |
Рис. 89. Призматический кристалл |
Гексагональный облик кристаллы халь |
|
козина часто приобретают вследствие |
халькозина. Турьинские рудники |
образования тройников с плоскостями |
(Урал) |
|
срастания по (110). Наблюдаются также двойники прорастания по (032) и реже по (112).
Агрегаты. Обычно встречается в виде сплошных тонкозернистых масс или в виде вкраплений в псевдоморфозах по борниту, халькопириту, иног да сфалериту, галениту, ковеллину, пириту и др.
198 |
Описательная часть |
|
|
|
Цвет халькозина свинцово серый. |
|
|
Черта темно серая. Блеск металличе |
|
|
ский. |
|
|
Твердость 2,5–3. Слабо ковок. Спайj |
|
|
ность несовершенная по {110}. Уд. вес |
|
|
5,5–5,8. Хороший проводник электриче |
|
|
ства. |
|
|
Диагностические признаки. Харак |
|
|
терными являются свинцово серый цвет, |
Рис. 90. Кристалл халькозина |
|
низкая твердость, ковкость (от острия |
|
ножа остается блестящий след, что от |
|
гексагонального облика. Турьинские |
||
рудники (Урал) |
|
личает халькозин от весьма похожей на |
него блеклой руды). Раствор в HNO3 приобретает зеленый цвет. Характерна ассоциация халькозина с медны ми минералами, чаще всего с борнитом.
П. п. тр. плавится, окрашивая пламя в голубой цвет. На угле с содой получается королек меди. В кислотах растворяется лучше всего в HNO3, выделяя серу.
Происхождение и месторождения. В природе ромбический халько зин образуется как в эндогенных, так и в экзогенных условиях, но исклю чительно при низких температурах (ниже 91 °С).
Как эндогенный минерал он изредка встречается в некоторых гидро' термальных, богатых медью и бедных серой сульфидных месторождени ях. В парагенезисе с халькозином в этих случаях наблюдается чаще дру гих эндогенный борнит. Таковы месторождения Удоканское (Забайкалье), Джезказганское (Казахстан), Редрут в Корнуолле (Англия) и др.
Однако в главной массе халькозин образуется экзогенным путем
втак называемых зонах вторичного сульфидного обогащения во всех медно сульфидных месторождениях (см. рис. 57). Как и другие вторич ные сульфиды меди, халькозин возникает при реакциях между первич ными сульфидами и растворами сульфатов меди, просачивающимися из зоны окисления медных месторождений. Часто он развивается ме тасоматическим путем на месте вторичного борнита. Иногда он непос редственно замещает первичный халькопирит, в ряде случаев — гале нит, сфалерит и другие сульфиды первичных руд.
Известны случаи образования халькозина из меденосных растворов
восадочных породах, содержащих органические остатки, в виде псевдо морфоз с сохранением всех деталей строения этих остатков, главным об разом древесины.
Взоне кислородного выветривания халькозин неустойчив и, разру
шаясь, переходит в куприт (Сu2О), малахит, азурит и другие кислород ные соединения. При неполном окислении нередко за счет халькозина образуется самородная медь по реакции:
Cu2S + 2О2 = CuSO4 + Сu.
Раздел II. Сульфиды, сульфосоли и им подобные соединения |
199 |
Крупные месторождения халькозиновых руд сравнительно редки.
Взначительных количествах они образуются в низах мощных, хорошо проработанных поверхностными агентами зон окисления в богатых ме дью сульфидных месторождениях. В них халькозин как главный медный минерал слагает зоны вторичного сульфидного обогащения.
На территории России в больших сплошных массах халькозиновые руды в свое время добывались на Турьинских рудниках (Северный Урал). Там же встречались хорошо образованные кристаллы этого минерала, де тально изученные акад. П. В. Еремеевым. Бедные вкрапленные халько зиновые руды установлены в крупных месторождениях Коунрад в Казах стане (к северу от оз. Балхаш) и Алмалык в Узбекистане (к югу от Ташкента).
За границей большой известностью пользуется месторождение Бьютт в Монтане (США), где халькозин в парагенезисе с борнитом, энаргитом, пиритом и другими минералами прослежен в первичных рудах значитель но ниже уровня грунтовых вод, т. е. является эндогенным минералом.
Практическое значение. Халькозин является самым богатым медью сульфидом, и потому халькозиновые руды важны для медной промыш ленности более чем какие либо другие руды сульфидных месторождений.
Внастоящее время на долю халькозинсодержащих руд падает весьма зна чительная часть мировой добычи меди. В частности, к ним относятся крупнейшие по запасам месторождения бедных вкрапленных руд типа Коунрада, массовая эксплуатация которых рентабельна, несмотря на от
носительно низкое содержание меди.
АРГЕНТИТ — β Ag2S и АКАНТИТ — α Ag2S. Названия происходят от лат. argentum — серебро и греч. аканта — шип, соответственно. Синоним: серебряный блеск. «Серебряная чернь» является порошковатой разновид ностью сернистого серебра и встречается совместно с плотным аргентитом.
Ag2S встречается в виде двух модификаций: 1) более высокотемператур ной кубической модификацией β Ag2S, устойчивой выше 179 °С, — арген' тита; 2) низкотемпературной псевдоромбической моноклинной модифи
кации α Ag2S, образующейся при температурах ниже 179 °С, — акантита. Кубическая модификация при понижении температуры претерпевает пара морфное превращение в псевдоромбическую модификацию, как это пока зывает рентгенометрическое исследование кубических кристаллов.
Несмотря на предложение особых названий для каждой модифика ции сернистого серебра, в минералогической практике фактически уко ренилось общее название «аргентит», которое применяется и к парамор фозам низкотемпературной модификации по высокотемпературной.
Химический состав. Ag — 87,1 %, S — 12,9 %. Из изоморфных приме сей в аргентите нередко наблюдается Cu. Обычно бывает загрязнен так же соединениями Pb, Fe, Sb и др.
200 |
Описательная часть |
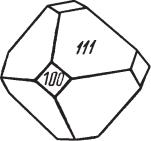
Сингония кубическая (аргентит), гексаоктаэдрический в. с. Пр. гр. Pn3m (О9h). Кристаллическая структура. Относится к структурному типу куприта (см. в соответствующем разделе). Низкотемпературная модифи кация (акантит) — моноклинная (структурно изучена недостаточно). Пр. гр. P21/c(C52h); a0 = 9,47; b = 6,95, с = 8,28; β = 124°. Габитус соб ственных кристаллов акантита, образовавших ся при температурах ниже 179 °С — призмати чески дипирамидальный, облик — шестоватый до копьевидного. Акантит часто встречается в виде несовершенных, нередко полисинтетиче ски сдвойникованных кристаллов, в составе па раморфоз по кристаллам аргентита, представ
Рис. 91. Кристалл арген ленным кубом, кубооктаэдром (рис. 91), изредка
тита (обычная форма)
ромбододекаэдром.
Цвет свинцово серый. Блеск в изломе металлический.
Твердость 2–2,5. Ковок. Спайность несовершенная по {110} и {100}. Уд. вес 7,2–7,4. Прочие свойства. Проводником электричества стано вится лишь при высоких температурах. Под действием сильных свето вых лучей отполированная поверхность аргентита в течение несколь ких секунд темнеет.
Диагностические признаки. По макроскопическим, т. е. устанавли ваемым на глаз признакам нелегко поддается определению. Часто сопро вождается серебряной чернью, иногда самородным серебром.
П.п. тр. на угле плавится с образованием ковкого королька серебра.
ВHNO3 растворяется с выделением серы; от прибавления HCl получает ся густой творожистый белый осадок AgCl, растворяемый в аммиаке.
Происхождение и месторождения. Аргентит встречается в гидротер' мальных месторождениях сульфидных серебросодержащих руд, часто в парагенезисе с самородным серебром, и другими серебросодержащими минералами.
Однако наибольшим распространением этот минерал, вернее акантит, пользуется в нижних частях зон окисления месторождений сульфидных серебросодержащих руд в ассоциации с такими минералами, как церус
сит (Рb[СО3]), хлораргирит (AgCl), самородное серебро и др. Наблюда лись псевдоморфозы акантита по самородному серебру и многим слож ным по составу минералам, представляющим сернистые, мышьяковистые, сурьмянистые соединения серебра (прустит, пираргирит, стефанит и др.).
Большие самостоятельные скопления аргентита наблюдаются край не редко. В значительных массах вместе с самородным серебром он встречался в месторождении Конгсберг (Норвегия), а также во многих месторождениях Мексики (Цакатекас, Гуанахуато и др.) в ассоциации с сульфосолями серебра (полибазит, пираргирит, прустит и пр.).
