
Betekhtin
.pdfРаздел I. Самородные элементы и интерметаллические соединения |
181 |
Водних случаях он генетически связан с высокотемпературными об разованиями — изредка в пегматитах, чаще в грейзеново кварцевожиль ных оловянно вольфрамовых месторождениях, в ассоциации с такими
минералами, как арсенопирит (FeAsS), висмутин (Bi2S3), ферберит (FeWO4), молибденит (MoS2), касситерит (SnO2), топаз, берилл, турма лин и др. Так, на месторождении Кара'Оба в Центральном Казахстане, висмут с висмутином, пиритом, вольфрамитом и козалитом находится в виде полиэдрических зерен, выполняющих интерстиции в кварце. Отме чен и в грейзенах Шерловой Горы (Забайкалье).
Отмечен висмут и в своеобразных бериллиеносных метасоматитах Изумрудных копей на Ср. Урале, представляющих собой результат грей зенизации ультраосновных пород. На этом месторождении, в кварц по левошпатовых с бериллом и фенакитом гнездах и жилах среди слюдитов, висмут образует изолированные выделения с висмутином, флюоритом и молибденитом.
Вдругих случаях самородный висмут бывает тесно связан с мышьяко вистыми соединениями никеля, кобальта, урановыми минералами, сернис тыми соединениями серебра, свинца, цинка и др. Таковы, например, ассоциа ции в многочисленных жильных месторождениях Рудных гор (на границе Саксонии и Богемии) — Шнееберг, Аннаберг, Яхимов и др. В более значи
тельных количествах вместе с висмутином (Bi2S3) он встречается в кварце во баритовых жилах боливийских месторождений — Таcна, Оруро и др.
5. Группа серы
Сюда относятся самородные элементы VI группы таблицы Менделе ева: сера, селен и теллур. Из них сера является типичным металлоидом, тогда как селен и особенно теллур обладают свойствами полуметаллов.
Для самой серы устанавливаются три полиморфные модификации, из которых в природных условиях наиболее устойчивой является ром бическая модификация — α сера. При атмосферном давлении и темпера туре выше 96,5 °С она переходит в β серу моноклинной сингонии, а при охлаждении вновь возвращается в прежнее кристаллическое состояние; γ сера также моноклинна, но неустойчива при атмосферном давлении при низких температурах, при комнатной температуре превращается в α серу. Другие три искусственно полученные полиморфные модифика ции серы в природных условиях не встречаются.
СЕРА — S. Наиболее устойчивую при комнатной температуре α моди фикацию серы называют обычно ромбической серой, или просто серой.
Химический состав. В ряде случаев устанавливается химически чис тая сера, но обычно она бывает загрязнена посторонними механически ми примесями: глинистым или органическим веществом, капельками нефти, газами и пр. Известны также редкие разновидности с изоморф ной примесью Se обычно до 1 %, изредка до 5,2 % — селенистая сера, а также Те, иногда As и в исключительных случаях Тl.
182 |
Описательная часть |
Сингония ромбическая; ромбо дипирамидальный в. с. 3L23PC. Пр. гр.
Fddd(D242h). а0 = 10,48; b0 = 12,92; с0 = 24,55. Кристаллическая структура.
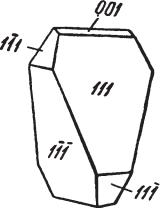
Согласно рентгенометрическим исследованиям, ромбическая сера обла дает редкой для неорганических соединений молекулярной и притом очень сложной кристаллической структурой. В структуре каждый атом серы с двух сторон перекрывается со сферами соседних атомов, причем цепоч ки, состоящие из 8 атомов, замкнуты в виде зигзагообразно «сморщенно го» кольца (рис. 77). Отсюда видно, что молекула серы — S8. Расстояние
°
между атомами S—S равно 2,12 A. Элементарная ячейка сложена 16 таки ми электрически нейтральными молекулами (кольцами), очень слабо связанными друг с другом вандерваальсовской связью. Облик кристалj лов. Кристаллы чаще имеют пирамидальный (рис. 78) или усеченно пи рамидальный вид (рис. 79), реже ромботетраэдрический (рис. 80). По следний случай, когда кристалл по внешней морфологии имеет
Рис. 78. Кристалл серы пирамидального облика
Рис. 77. Вид сверху и сбоку |
|
восьмиатомного кольца |
|
(молекулы) серы. Ниже дана |
|
схема расположения центров |
Рис. 79. Кристалл серы усеченно пирамидального |
атомов |
облика |
Раздел I. Самородные элементы и интерметаллические соединения |
183 |
|
симметрию более низкую, чем установлено |
|
|
рентгеновским анализом для его структуры, |
|
|
относится к явлению гипоморфизма (от греч. |
|
|
гипо — низкий, морфэ — форма). Характерные |
|
|
габитусные формы серы: {001}, {011}, {111}, |
|
|
{113} и др. Двойники редки — с плоскостью |
|
|
срастания по (111), иногда по (011) и (110). |
|
|
Агрегаты. Часто встречается в сплошных, |
|
|
иногда землистых массах. Изредка наблюдают |
|
|
ся натечные почковидные формы и налеты (в |
|
|
районах вулканических извержений). |
|
|
Цвет. У α серы наблюдаются различные |
|
|
оттенки желтого цвета: соломенно желтый, ме |
|
|
дово желтый, желтовато серый, бурый и чер |
Рис. 80. Ромбо тетраэдриче |
|
ный (от углеродистых примесей). Черты по |
ский кристалл серы |
|
чти не дает, порошок слабо желтоватый. Блеск на гранях алмазный, в изломе жирный. В кристаллах просвечивает.
Твердость 1–2. Хрупка. Спайность несовершенная по {001}, {110}
и{111}. Уд. вес 2,05–2,08. Прочие свойства. Электропроводность и теп лопроводность очень слабые (хороший изолятор). При трении заряжает ся отрицательным электричеством. Растрескивается от теплоты руки.
Диагностические признаки. Характерны цвет, низкая твердость, хруп кость, жирный блеск в изломе кристаллов и легкоплавкость.
П.п. тр. и от спички легко плавится (при 112,8 °С) и загорается голу
бым пламенем с выделением характерного запаха SO2 (отличие от похо жего на серу аурипигмента — As2S3). Легко растворима в сероуглероде, скипидаре, керосине, но не разлагается в НСl и H2SO4. Крепкая HNO3
ицарская водка окисляют серу, переводя ее в H2SO4.
Таким образом, самородная сера как единственный среди рассматри ваемых в этом разделе минерал, обладающий молекулярным строением вещества, характеризуется совершенно особыми свойствами. Наличие в структуре в качестве структурных единиц электрически нейтральных молекул S8 легко объясняет такие свойства, как плохая электропровод ность, низкая теплопроводность, слабая связь между молекулами, что выражается в низких температурах плавления и возгонки, слабых меха нических свойствах, низкой твердости, в отсутствии ясно выраженной спайности, в связи с чем находятся очень неровный излом и жирный блеск, а кольцевая форма структурных единиц (молекул S8), сильно отлича ющаяся от формы шара, обусловливает резкую оптическую анизотропию кристаллического вещества, анизотропию теплового расширения и т. д.
Следует добавить, что такие свойства, как небольшой удельный вес и невысокая температура плавления остроумно используются при добыче самородной серы из глубоко залегающих сероносных пластов: по трубам
184 |
Описательная часть |
в буровые скважины нагнетается перегретый водяной пар, и расплавлен ная сера, освободившись одновременно от посторонних механических примесей, с восходящей струей поднимается на поверхность, где улавли вается самыми простыми способами.
Происхождение и месторождения. Самородная сера встречается ис ключительно в самой верхней части земной коры и на ее поверхности. Образуется различными путями.
1. При вулканических извержениях, осаждаясь в виде возгонов на стен ках кратеров, в трещинах пород, иногда изливаясь в расплавленном виде с горючими водами сольфатарных источников и застывая в логах и доли нах в виде потоков в районах современной вулканической деятельности (Курильские острова, Япония). Часто ассоциирует с другими продукта ми возгона и сульфатами, образовавшимися при воздействии SO2 на ок ружающие породы. Возникает в результате неполного окисления серово дорода в сольфатарах или как продукт реакции его с сернистым газом:
2H2S + 2O = 2H2O + 2S; H2S + SO2 = H2O + O + 2S.
2.При разложении сернистых соединений металлов, главным образом пирита, в нижних частях зоны окисления рудных месторождений. Обыч но бывает сильно загрязнена различными механическими примесями.
3.При разложении гипсоносных осадочных толщ. Часто наблюдается парагенезис самородной серы с гипсом, на разъеденных участках которо го она образуется в виде кристаллических и порошковатых масс. Многое
вэтом процессе образования еще неясно.
4.Осадочным (биохимическим) путем в нормальных осадочных по родах, представленных обычно пластами, содержащими гипс, твердые и жидкие битумы (асфальт, нефть) и др. Этот тип месторождений широко распространен на земном шаре и имеет большое промышленное значе ние. При этом основная масса самородной серы образовалась, очевидно, сингенетически, т. е. одновременно с другими осадками. Однако нередко наблюдаются и эпигенетические образования серы во вмещающих поро дах, происшедшие, по видимому, при позднейшей миграции ее под влия нием тектонических процессов, переноса нефтями, растворами и т. п.
Происхождение серы биохимическим путем связывают с жизнедея тельностью анаэробных бактерий, перерабатывающих сульфаты, в резуль тате чего образуется сероводород, неполное окисление которого приво дит к выпадению серы.
В России и ближнем зарубежье залежи серы широко распростране ны. В районе Самары в Поволжье известны крупные осадочные место рождения, например Алексеевское и Водинское, где сера встречается в виде кристаллов до 15 см с кальцитом, гипсом и целестином. Заслуживают
Раздел I. Самородные элементы и интерметаллические соединения |
185 |
упоминания ячеистые массы гипергенной самородной серы, сохраняющие отпечатки кристаллов пирита, замещенных серой при выветривании в зоне окисления Березовского месторождения (Средний Урал). На терри тории Средней Азии следует отметить: 1) месторождение Гаурдак (Турк менистан); 2) Шор'Су (Узбекистан) — в трещинах и пустотах различных осадочных пород в парагенезисе с нефтью, озокеритом, гипсом, целести ном, кальцитом, арагонитом и др. В числе зарубежных месторождений большой известностью пользуются крупные месторождения Сицилии, очень мощные месторождения в штатах Техас и Луизиана (США), свя занные с соляными куполами. Представляет интерес огромная залежь серы, образовавшаяся в кратерном озере в районе Хоробетсу (Япония), аналогичные скопления имеются и на Курильских островах.
Практическое значение. Главное применение сера имеет в производ стве серной кислоты, используемой во многих отраслях промышленнос ти, затем в сельском хозяйстве (для борьбы с вредителями), в резиновом производстве (процесс вулканизации резины), при изготовлении спичек, фейерверков, красок и пр.
6. Группа углерода
Относящиеся сюда минералы также занимают особое положение сре ди самородных элементов. Эта группа представлена двумя резко различ ными по физическим свойствам полиморфными модификациями угле рода: алмазом и графитом.
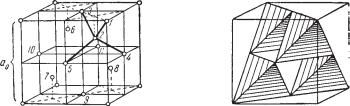
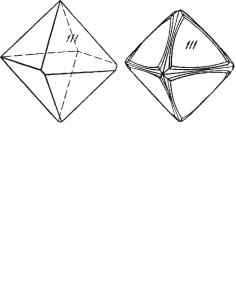
Кристаллическая структура алмаза (рис. 81) характеризуется решет кой гранецентрированного куба, но атомы углерода располагаются не только в вершинах и на гранях куба, но также в центрах половинного числа малых кубов (октантов), чередующихся с пустыми малыми кубами. Более наглядно эта структура показана на рис. 81б в виде комбинации тетраэдров, в которых, кроме четырех атомов по вершинам, в центре рас полагается пятый атом (рис. 82в). Каждая вершина тетраэдра является общей для четырех смежных тетраэдров.
а |
б |
Рис. 81. Кристаллическая структура алмаза.
а— изображение центров атомов; б — та же структура в виде тетраэдров, вершины
ицентры которых являются центрами атомов углерода
186 |
Описательная часть |
а б в
Рис. 82. Разные способы изображения тетраэдрического расположения атомов. Расстояния от центров атомов на всех трех фигурах одинаковы
Атомы углерода в кристаллической структуре алмаза находятся в состо янии sp3 гибридизации валентных электронов, они соединены друг с другом исключительно ковалентными жесткими связями по направлени ям, соединяющим центр тетраэдра с его вершинами. Связывающие элект ронные пары находятся в серединах отрезков, соединяющих центры бли жайших атомов углерода и прочно локализованы, энергетический зазор между состоянием этих электронов и уровнем электронов проводимости составляет очень большую величину — 3,6 ЭВ. Поэтому алмаз является ти пичным диэлектриком, что обусловливает ряд таких специфических свойств, как бесцветность и прозрачность, низкая электропроводность, необычайно высокая твердость, весьма высокая устойчивость при широких колебаниях температуры и давления (в частности, при нагреве до температуры 2500 °С в отсутствие кислорода не обнаруживает никаких изменений), очень высокая устойчивость по отношению к кислотам и щелочам и др.
|
Структура графита весьма суще |
|
|
ственно отличается от структуры алмаза. |
|
|
Ионы углерода в графите лежат слоями, |
|
|
представленными плоскими гексагональ |
|
|
ными сетками (рис. 83). Каждый ион в |
|
|
плоской сетке окружен тремя соседними |
|
|
° |
|
|
ионами на расстоянии 1,42 A (в алмазе |
|
|
° |
|
|
1,54 A), расстояние же между плоскими |
|
|
° |
|
|
сетками — 3,40 A(больше чем в два раза). |
|
Рис. 83. Расположение центров |
Состояние атомов углерода в графите та |
|
атомов в слоях структуры графита. |
ково (sp2 гибридизация), что каждый из |
|
Каждый следующий слой как бы |
них способен образовать лишь три кова |
|
сдвинут на расстояние в половину |
||
лентные σ связи. Третий электрон каждо |
||
диаметра шестерных колец |
||
го атома участвует в р связи, электрон |
||
|
ные облака которой в виде сообщающихся каналов сосредоточены по обе стороны от слоя, содержащего центры атомов углерода. Электроны в этих каналах делокализованы и могут передвигаться вдоль плоскости слоя, обеспечивая проводимость металлического типа.

Раздел I. Самородные элементы и интерметаллические соединения |
187 |
Отсюда становится понятным ряд свойств графита: его значительно меньший удельный вес по сравнению с алмазом, чрезвычайно легкая рас щепляемость на тонкие чешуйки и резко выраженная оптическая ани зотропия. Налицо также анизотропия твердости, которую удается уста новить при очень точных тонких исследованиях (перпендикулярно плоскости спайности 5,5 по Моосу, но в то же время благодаря очень слабому сцеплению слоев графит настолько мягок, что мажет бумагу и пальцы). Этим же объясняется неоднородность поглощения света, чем и обусловлен серый цвет минерала. Таким образом, тип связи атомов в графите в отличие от алмаза в какой то мере носит металлический характер, т. е. в связях участвуют также «металлические» электроны. С этим вполне увязываются такие свойства, как полуметаллический блеск, высокая электропроводность и др. Но по химической и термиче ской стойкости графит все же близок к алмазу.
Если мы структуру алмаза изобразим в таком виде, как это показано на рис. 84а, т. е. вдоль тройной оси (ср. номера атомов на рис. 81а), то в горизонтальных плоских сетках также заметим гексагональные кольца (атомы 6, 11, 8, 9, 7 и 10), с той лишь разницей, что эти сетки не совсем плоские: три атома располагаются несколько выше по сравнению с дру гими тремя. Этим и объясняется, почему в кристаллах алмаза спайность
средняя по {111}, тогда как в графите — |
|
|
по {0001} совершенная. |
|
|
АЛМАЗ — С. Название происходит от |
|
|
греч. адамас — непреодолимый (очевид |
|
|
но, имелись в виду его наивысшая твер |
|
|
дость и устойчивость по отношению |
|
|
к физическим и химическим агентам). |
|
|
Разновидности: 1) борт — неправиль |
|
|
ной формы сростки и шаровидные лучис |
а |
|
тые агрегаты; 2) карбонадо — тонкозер |
|
|
нистые пористые агрегаты, окрашенные |
|
|
аморфным графитом и посторонними |
|
|
примесями в буровато черный цвет. |
|
|
Химический состав. Бесцветные раз |
|
|
новидности состоят из чистого углерода, |
|
|
достаточно распространены примеси азо |
|
|
та и реже бора, приводящие к появлению |
|
|
желтого и розового оттенков соответ |
б |
|
ственно. Густоокрашенные же и непроз |
||
|
||
рачные разновидности в несгораемом ос |
Рис. 84. Расположение центров |
|
татке, достигающем иногда нескольких |
||
атомов в алмазе (а) при горизон |
||
процентов, обнаруживают SiO2, MgO, |
||
тальном расположении плоских |
||
CaO, FeO, Fe2O3, Al2O3, TiO2 и др. В виде |
сеток (111) и в графите (б) |
188 |
Описательная часть |
|
|
включений в алмазах нередко на |
|
|
блюдается графит и некоторые дру |
|
|
гие минералы. |
|
|
Сингония кубическая; гексатет |
|
|
раэдрический в. с. 3L24L36P. Пр. гр. |
|
|
|
4 |
|
Fd3m(O7). a = 3,559. |
|
|
h |
0 |
Облик кристаллов октаэдриче ский (рис. 85), иногда с треугольны
Рис. 85. Кристаллы алмаза октаэдриче |
ми скульптурами антискелетного |
|
ского облика |
||
роста на гранях, менее обычен доде |
||
|
||
|
каэдрический; редко кубический и |
|
|
изредка тетраэдрический. Харак |
|
|
терные формы: {111}, {100} и {110}. |
|
|
Нередко устанавливаются криво |
|
|
гранные кристаллы (рис. 86), так на |
|
|
зываемые «додекадроиды» и «окта |
|
|
эдроиды». Наблюдаются двойники |
|
Рис. 86. Кривогранные кристаллы алмаза |
срастания по (111), реже по (100). |
|
Размеры отдельных кристаллов ва |
||
(по А. Е. Ферсману) |
||
рьируют от мельчайших до очень |
||
|
крупных, весящих несколько сот и даже тысяч каратов (метрический ка рат равен 0,2 г). Крупнейшие кристаллы весили (в каратах): «Куллинан» — 3025, «Эксцельзиор» — 969,5, «Виктория» — 457, «Орлов» — 199,6 и др.
Цвет. Бесцветный водяно прозрачный или окрашенный в голубой, синий, желтый, розовый, бурый и черный цвета. Блеск сильный алмаз ный. Показатель преломления N = 2,40–2,48.
Твердость 10. Абсолютная твердость в 1000 раз превышает твердость кварца и в 150 раз — корунда. Хрупок. Спайность средняя по {111}. Уд. вес 3,47–3,56. Электропроводность слабая, полупроводникового типа, а у беспримесных разностей вовсе отсутствует.
Диагностические признаки. Алмаз является единственным минера лом столь исключительной твердости. Характерны также сильный алмаз ный блеск и часто кривоплоскостные грани кристаллов. Мелкие зерна в шлихах легко узнаются по люминесценции, резко проявляющейся в уль трафиолетовых лучах. Цвета люминесценции обычно голубовато синие, иногда зеленые.
Происхождение и месторождения. Коренные месторождения гене тически связаны с ультраосновными глубинными изверженными поро дами повышенной щелочности: кимберлитами, лампроитами и отчасти
сперидотитами, и др.
Вэтих породах кристаллизация алмаза происходит, очевидно, в верхней мантии, на больших глубинах в условиях высоких температур и давления, в восстановительной обстановке, при высоких давлениях углеводородного по

Раздел I. Самородные элементы и интерметаллические соединения |
189 |
составу флюида. Кимберлиты, по всей вероятности, служат лишь «средством доставки» алмазов из области их стабильной генерации к поверхности Зем ли. Необходимо отметить, что подъем материала из области стабильности алмаза к поверхности должен быть быстрым настолько, чтобы алмаз не ус пел графитизироваться, а остался бы в метастабильном состоянии.
Опыт синтеза алмазов указывает, что их образование может происхо дить и вне области стабильности (метастабильное зарождение и рост), в том числе и из флюидной (газовой) фазы. Это указывает на возможность роста кристаллов алмаза в кимберлитах в период извержения.
Вассоциациях с алмазом наблюдались: графит, оливин (Mg,Fe)2[SiO4], хромшпинелиды (Fe,Mg)(Cr,Al,Fe)2O4, ильменит (FeTiO3), пироп (крас ный магнезиальный гранат), магнетит (FeFe2O4), гематит (Fе2О3) и др.
Крупнейшие месторождения алмазов известны в ряде районов Юж ной Африки по р. Вааль, в Юго Западном Трансваале и на юго западном берегу Африки. Они представлены алмазоносными полуразложенными кимберлитами, заполняющими вместе с обломочными породами гигант ские по размерам, вертикально уходящие вниз на несколько километров трубчатые полости (диатремы) с эллиптическим или неправильной фор мы сечением. Образование этих диатрем связывают с грандиозными взрывными процессами, происходившими на больших глубинах. В неко торых месторождениях добыча алмаза в настоящее время происходит с глубины свыше километра (Кимберли). Добытая руда («синяя земля») дробится и промывается на специальных обогатительных фабриках. Со держание алмаза в породе составляет 0,000 052 % (по весу). Отсюда про исходят самые крупные алмазы в мире («Куллинан», «Эксцельзиор» и др.). Кроме коренных месторождений, в Юго Западной Африке широко распространены также богатые россыпи в системах рр. Вааль и Оранже' вой. Большая добыча алмазов производится также в Конго. С открытием лампроитовых1 трубок в районах Аргайл и Эллендэйл в Северо Западной Австралии эта страна вышла на одно из первых мест по добыче алмазов.
В50–60 е гг. XX в. в северной части Якутии были открыты довольно многочисленные диатремы, выполненные подобными южно африканским, но более свежими алмазоносными кимберлитами. Отдельные трубки по лучили специальные названия: «Мир», «Зарница» и др. Добыча алмазов в Якутии с тех пор существенно выросла и продолжается полным ходом. Обнаружены алмазоносные кимберлиты и в Архангельской области.
Россыпные месторождения алмаза, устойчивого в экзогенных услови ях, образуются за счет разрушения и размыва алмазоносных пород. Они известны в Южной Африке, Бразилии (Диамантина, штат Минас
1 Лампроит — высококалиевая разновидность кимберлита, сложенная флогопитом
иклинопироксеном.

190 Описательная часть
Жерайс), Индии (Голконда), где ведется добыча с древнейших времен и от куда происходят крупные алмазы «Орлов», «Коинур», и в других местах.
Практическое значение. Совершенно прозрачные алмазы после огра нения применяются в ювелирном деле как драгоценные камни (бриллиан ты). Для технических целей употребляются мелкие алмазы, а также борт и карбонадо. Главным образом они используются в металлообрабатывающей, камнеобрабатывающей, абразивной и прочих отраслях промышленности.
ГРАФИТ — С. Название происходит от греч. графо — пишу. Разно видности: графитит — скрытокристаллическая разность, шунгит — аморфная, богатая примесями разность, образовавшаяся, по видимому, в результате природного коксования углей.
Химический состав графита редко отличается чистотой. В значитель ных количествах (до 10–20 %) в нем часто присутствует зола, состоящая из различных компонентов (SiO2, Al2O3, FeO, MgO, CaO, P2O5, CuO и др.), иногда вода, битумы и газы (до 2 %).
Сингония гексагональная; дигексагонально дипирамидальный в. с. L66L27PC. Пр.гр. P63/ттс (D46h). а0 = 2,47; с0 = 6,79. Облик кристаллов. Хо рошо образованные кристаллы встречаются крайне редко. Они имеют вид шестиугольных пластинок или табличек (рис. 87), иногда с тре угольными штрихами на грани
(0001). Характерные формы:
– –
{0001}, иногда {1011}, {1122} и др.
|
Агрегаты часто тонкочешуйча |
|
Рис. 87. Кристаллы графита |
тые. Реже распространены шес |
|
товатые или волокнистые массы. |
||
|
Цвет графита железно черный до стально серого. Черта черная блес тящая. Блеск сильный металловидный; скрытокристаллические агрега ты матовые. Оптически отрицателен. Показатель преломления Nm — 1,93–2,07. В тончайших листочках просвечивает серым цветом.
Твердость 1. В тонких листочках гибок. Жирен на ощупь. Мажет бумагу
ипальцы. Спайность совершенная по {0001}. Уд. вес 2,09–2,23 (изменяется в зависимости от степени дисперсности и наличия тончайших пор), у шун гита 1,84–1,98. Прочие свойства. Обладает высокой электропроводностью.
Диагностические признаки. Легко узнается по цвету, низкой твердости
ижирности на ощупь. От сходного с ним молибденита (MoS2) отличается более темным железно черным цветом, более слабым блеском, меньшим удельным весом (всплывает в бромоформе) и высокой электропроводнос тью (молибденит плохо проводит электричество). Черта графита на бумаге при растирании не меняет цвета. Если коснуться цинковой палочкой графи тачерезкаплюCuSO4,нанембыстровыделяетсяпленкаметаллическоймеди.
П.п. тр. не плавится. При накаливании в струе кислорода сгорает труднее, нежелиалмаз.Улетучивается,неплавясь,лишьвпламенивольтовойдуги.В кис лотах не растворяется. Порошок в смеси с KNO3 при нагревании дает вспышку.
