
8 группа
.pdfМИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
ХИМИЯ ЭЛЕМЕНТОВ VIII ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Учебное пособие
Издательско-полиграфический центр Воронежского государственного университета
2013
Утверждено научно-методическим советом химического факультета 12 декабря 2012 г., протокол № 9
Составители: И.Я. Миттова, Е.В. Томина, Б.В. Сладкопевцев, Д.О. Солодухин
Рецензент д-р хим. наук, профессор В.Н. Семенов
Учебное пособие подготовлено на кафедре материаловедения и индустрии наносистем химического факультета Воронежского государственного университета.
Рекомендуется для студентов 1-го курса химического факультета дневного отделения.
Для направлений: 020300 – Химия, физика и механика материалов, 020100 – Химия
2
ПРЕДИСЛОВИЕ
Данное учебное пособие является продолжением первых трех частей, в которых были рассмотрены Периодический закон как основа неорганической химии, химия элементов I–VI групп Периодической системы. В четвертой части рассматривается химия элементов VIII группы Периодической системы химических элементов Д.И. Менделеева.
Пособие призвано помочь студенту-первокурснику в изучении дисциплины «Неорганическая химия» и по сути дела является конспектом лекционного курса, где отображены все основные ключевые моменты, которые необходимо учесть при ее изучении.
Являясь продолжением цикла пособий по курсу «Неорганическая химия», данное издание в целом сохраняет структуру и последовательность изложения материала. Описание начинается с общей характеристики простых веществ, их распространенности в природе, способов получения и химических свойств, в отдельных подразделах рассматриваются свойства соединений элементов группы. Особое внимание уделено применению химических элементов и их соединений в качестве разнообразных современных материалов.
Для реализации принципа наглядности в пособии приведено большое количество иллюстративного материала и таблиц, которые позволяют в компактном виде представить обширные объемы материала и отразить основные закономерности в изменении свойств химических элементов и их соединений.
При написании использованы современные литературные источники, список которых приведен в конце пособия. Иллюстративный материал большей частью взят из учебников «Неорганическая химия» (под ред. Ю.Д. Третьякова, М. : Асаdemia, 2004) и «Химия элементов» (Н. Гринвуд, А. Эрншо. М. : БИНОМ. Лаб. знаний, 2008).
Настоящее пособие прежде всего предназначено для студентов первого курса химического факультета, однако оно может быть полезным и студентам старших курсов, в частности магистрам, изучающим дисциплины «Современная неорганическая химия» и «Современные проблемы неорганической химии», для актуализации полученных ранее знаний.
ГЛАВА 1. VIII-A ГРУППА
1.1.Простые вещества
1.1.1.Свойства элементов
Элементы VIII-A группы: гелий 2Не, неон 10Ne, аргон 18Аr, криптон 36Kr, ксенон 54Хе и радон 86Rn – называют благородными газами. Электрон-
3
ная конфигурация первого представителя группы, гелия – 1s2. Атомы остальных благородных газов на внешнем уровне имеют восемь валентных электронов (табл. 1), что отвечает устойчивой электронной конфигурации.
Таблица 1
Свойства элементов VIII-A группы [1]
Свойство |
Не |
Ne |
Ar |
Kr |
|
|
Xe |
|
|
Rn |
|
|
|
|
|
|
|
|
|
|
|
|
|
Заряд ядра Z |
2 |
10 |
18 |
36 |
|
|
54 |
|
|
86 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Электронная конфигу- |
|
2 |
2 |
[Ar]3d |
10 |
[Kr]4d |
10 |
[Xe]4f14 |
|||
рация восновном со- |
2 |
[Не]2s 2р |
[Ne]3s 3p |
|
|
10 |
2 |
||||
1s |
6 |
6 |
2 |
6 |
2 |
6 |
5d |
5s |
|||
стоянии |
|
|
|
4s 4p |
|
|
5s 5p |
|
|
5p6 |
|
Атомный радиус, нм |
0,12 |
0,16 |
0,19 |
0,2 |
|
|
0,22 |
|
|
0,22 |
|
|
|
|
|
|
|
|
|
|
|||
Первая энергия иони- |
2372 |
2080 |
1520 |
1351 |
|
1170 |
|
1037 |
|||
зации I1, кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
Энергия возбуждения |
|
|
|
|
|
|
|
|
|
|
|
ns2np6→ns2np5(n + 1)s1, |
– |
1601 |
1110 |
955 |
|
|
801 |
|
|
656 |
|
кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
Электроотрицатель- |
5,5 |
4,84 |
3,2 |
2,94 |
|
|
2,4 |
|
|
2,06 |
|
ность |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
Полностью завершенная конфигурация внешнего электронного слоя (в случае гелия и неона) или наличие октета электронов обусловливает высокие значения энергий ионизации атомов благородных газов и, как следствие, их низкую химическую активность. Способность атомов этих элементов вступать в химические реакции возрастает с ростом атомного радиуса вследствие ослабления притяжения валентных электронов к ядру. К настоящему времени получены химические соединения лишь тяжелых благородных газов: криптона, ксенона и радона.
1.1.2. Нахождение в природе, получение
Гелий – второй (после водорода) элемент по распространенности во Вселенной. В то же время масса «земного» гелия составляет лишь одну миллионную массы земной коры. На Солнце значительное количество ядер гелия образуется при ядерном «горении» водорода, поэтому содержание этого элемента во Вселенной постепенно возрастает. Гелий образуется также при α-распаде радионуклидов. Он заполняет пустоты в радиоактивных горных породах и минералах, а оттуда попадает в атмосферу. В виде примеси гелий сопутствует метану. Основным источником гелия является природный газ.
Все благородные газы содержатся в воздухе, являющемся сырьем для их промышленного получения.
4
Радон – радиоактивный элемент. Наиболее долгоживущий изотоп 222Rn, образующийся при α-распаде 226Ra, имеет период полураспада 3,82 дня. Один грамм радия-226 за сутки выделяет 6,6 · 10–4 мл радона. В минералах тория присутствует некоторое количество изотопа 220Rn.
1.1.3. Физические свойства
Все благородные газы не имеют цвета, вкуса и запаха, обладают низкими температурами плавления и кипения. Их молекулы одноатомные. Аргон, криптон и ксенон образуют клатраты на основе воды и гидрохинона, например Хе · 3С6Н4(ОН)2, в которых атомы благородного газа расположены в полостях структуры вещества-«хозяина». Меньшие по размерам атомы гелия и аргона не способны удерживаться в полостях. Основные физические свойства простых веществ приведены в табл. 2.
|
Свойства простых веществ[1] |
|
Таблица 2 |
||||
|
|
|
|||||
Свойство |
Не |
Ne |
Ar |
Kr |
Xe |
Rn |
|
|
|
|
|
|
|
|
|
Стандартная эн- |
|
|
|
|
|
|
|
тальпия испаре- |
0,08 |
1,74 |
6,52 |
9,05 |
12,65 |
18,1 |
|
ния, кДж/моль |
|||||||
|
|
|
|
|
|
||
(20 °С) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
tпл, °С |
–272,2 |
–248,6 |
–189,4 |
–157,4 |
–111,8 |
–71 |
|
tкип, °С |
–268,9 |
–246,1 |
–185,9 |
–153,4 |
–108,2 |
–62 |
|
Содержание |
5,2 · 10–4 |
1,8 · 10–3 |
0,93 |
1,1 · 10–3 |
8,7 · 10–6 |
6,0 ·10–18 |
|
в воздухе, % |
|
|
|
|
|
|
|
Растворимость в |
|
|
|
|
|
|
|
воде при 20 °С, |
8,6 |
10,5 |
33,6 |
59,4 |
108,1 |
230 |
|
мл/л |
|
|
|
|
|
|
|
1.2. Химические свойства
Истинные химические соединения получены лишь для криптона, ксенона и радона. Лучше всего изучена химия ксенона, так как соединения криптона крайне неустойчивы, а радон радиоактивен.
Взаимодействие ксенона со фтором приводит к образованию смеси фторидов. Удобным методом синтеза дифторида, позволяющим избежать прямого фторирования, является окисление ксенона фторидом серебра (II) в присутствии кислоты Льюиса:
2AgF2 + 2BF3 + Хе = XeF2 + 2AgBF4.
Фториды ксенона представляют собой бесцветные летучие кристаллические вещества, легко гидролизующиеся. Дифторид ксенона образует устойчивые растворы, которые в течение нескольких часов разлагаются:
5
2XeF2 + 2Н2O = 2Xe↑ + 4HF + O2↑.
Тетра- и гексафторид ксенона гораздо более чувствительны к влаге воздуха – при попадании в воду они мгновенно гидролизуются с образованием ХeO3:
6XeF4 + 12H2O = 2ХеO3 + 4Xe↑ + 3O2↑ + 24HF, XeF6 + 3H2O = XeO3 + 6HF.
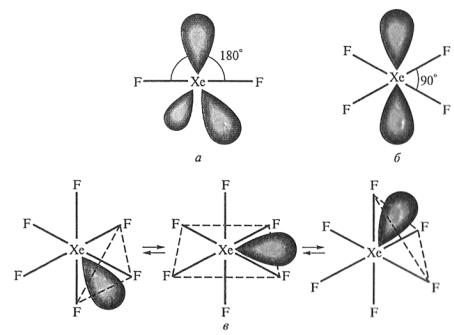
Фториды ксенона имеют молекулярное строение (рис. 1). XeF2 – линейная молекула с тремя неподелеными электронными парами, лежащими в экваториальной плоскости (тип АВ2Е3); XeF4 имеет форму квадрата с двумя неподелеными парами (тип АВ4Е2), a XeF6 – искаженного октаэдра с одной неподеленой парой электронов (тип АВ6Е). Свободные молекулы ХеF6 известны в паре.
Рис. 1. Строение молекул XeF2 (а), XeF4 (б), ХeF6 (динамическая модель с мигрирующей электронной парой) (в) [1]
Метод молекулярных орбиталей описывает образование фторидов ксенона с позиций трехцентровых четырехэлектронных связей. Например, в образовании молекулы XeF2 участвуют px-орбитали атома ксенона и двух атомов фтора (рис. 2). Их взаимодействие приводит к возникновению тpex молекулярных σ-орбиталей: связывающей, несвязывающей и разрыхляющей, первые две из которых заполнены электронами. Порядок связи, таким образом, оказывается равным единице. Соединения, содержащие трехцентровые четырехэлектронные связи, называют гипервалентными.
6

Рис. 2. Схема молекулярных орбиталей молекулы XeF2. Справа показаны комбинации атомных орбиталей, участвующих в формировании каждой из молекулярных орбиталей молекулы [1]
Фториды ксенона являются сильными окислителями. Они превращают броматы в перброматы, иодаты в периодаты, серу в гексафторид, соли марганца (II) в перманганаты:
3XeF2 + S = 3Хе + SF6,
5XeF2 + 2Mn(NO3)2 + 16КОН = 2KMnO4 + 10KF + 4KNO3 + 8H2O + 5Xe.
На этом основано использование фторидов ксенона в синтезе высших фторидов переходных металлов:
XeF2 + 2CeF3 → Xe↑ + 2CeF4.
Другим важным свойством фторидов ксенона является их способность выступать как донорами, так и акцепторами фторид-ионов. Донорные свойства убывают в ряду XeF2 > XeF6 > XeF4. С типичными кислотами Льюиса PF5, AsF5, SbF5, PtF5 и другими наиболее легко взаимодействует дифторид ксенона, образуя соли [XeF]+[MF6]–, [Xe2F3]+[MF6]–:
XeF2 + AsF5 = [XeF]+[AsF6]–.
Взаимодействием XeF2 с избытком пентафторида сурьмы при давлении 3 атм удалось получить темно-зеленые кристаллы, содержащие парамагнитный катион диксенона Хе2+:
4XeF2 + 8SbF5 = 2Xe2+[Sb4F21]– + 3F2.
Расстояние Хе–Хе в катионе составляет 0,309 нм, что свидетельствует лишь об очень слабом взаимодействии.
Акцепторные свойства убывают в ряду XeF6 > XeF4 > ХeF2. Они наиболее характерны для гексафторида ксенона, который легко вступает в реакции с фторидами тяжелых щелочных металлов (рубидия и цезия):
XeF6 + CsF = Cs+[XeF7]–.
Для криптона известны лишь соединения со фтором в степени окисления +2. Фторид KrF2 образуется из простых веществ при температуре жид-
7
кого азота. Его обычно получают, пропуская электрический разряд через смесь криптона с фтором в реакторе, охлаждаемом жидким азотом. По строению и свойствам KrF2 напоминает дифторид ксенона, являясь по сравнению с ним еще более сильным окислителем. KrF2 окисляет трифторид золота до пентафторида и пентафторид хлора до иона [ClF6]+, превращает металлическое золото в золото (V):
7KrF2 + 2Au = 2KrF+[AuF6]– + 5Kr↑.
Интересно, что свободный фтор в отличие от дифторида криптона не способен окислить золото доAuF5.
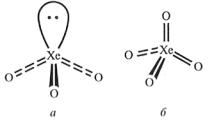
Кислородные соединения известны лишь для ксенона. Ксенон образует два оксида: ХеО3 и ХеO4 (рис. 3), оба чрезвычайно неустойчивы и легко взрываются от малейшего сотрясения. Оксид ХеO3 образуется при гидролизе тетра- и гексафторидов или при действии гексафторида на оксид кремния:
2XeF6 + 3SiO2 = 2ХеO3 + 3SiF4.
В свободном виде он представляет собой бесцветные кристаллы, хорошо растворимые в воде.
Рис. 3. Строение молекул XeO3 (а) и XeO4 (б) [1]
Удалось выделить лишь кислые ксенаты щелочных металлов (М) состава МНХеO4, которые при добавлении избытка щелочи диспропорционируют:
2NaHXeO4 + 2NaOH = Na4XeO6 + Хе + O2 + 2Н2O.
Так получают перксенаты – соли перксеноновой кислоты Н4ХеО6. Они содержат ион [ХеO6]4–, имеющий октаэдрическое строение.
Действием на перксенаты 100%-й серной кислоты получают высший оксид ксенона ХеO4:
Na4XeO6 + 2H2SO4 = 2Na2SO4 + XeO4↑ + 2H2O.
Он представляет собой бесцветный газ, самопроизвольно взрывающийся, более устойчивы его растворы в донорных растворителях (BrF5, HF), их можно хранить при температуре –33 °С. Тетраоксид ксенона и перксенаты – одни из самых сильных окислителей.
1.3. Применение
Первоначальное применение гелия как негорючего газа для наполнения аэростатов (его подъемная сила составляет приблизительно 1 кг/м3) потеря-
8
ло свое значение, хотя его все еще используют для метеорологических зондов. Гелий применяется в качестве криогенной жидкости для поддержания температур порядка 4,2 К и ниже (на эти цели идет 30 % получаемого Не); 2/3 расходуются на спектрометры и томографы ЯМР. Другие важные области применения – электродуговая сварка (21 %), герметизация и очистка (11 %). Выбор между Аr и Не для этих целей определяется стоимостью газа, и везде, кроме США, обычно предпочитают использовать аргон. Небольшие по объему, но важные области применения гелия таковы:
а) для замены N2 в искусственных газовых смесях при дыхании на большой глубине (низкая растворимость гелия в крови сводит к минимуму газовыделение, которое происходит в случае азота – когда водолаз проходит декомпрессию – и иногда приводит к смертельному исходу);
б) как рабочая среда в детекторах утечки газа; в) как теплоноситель в системе охлаждения высокотемпературных
ядерных реакторов; г) как газ-носитель в газожидкостной хроматографии;
д) для деаэрации растворов и вообще как инертный разбавитель или инертная атмосфера.
Аr применяют главным образом в качестве инертной газовой среды при высокотемпературных металлургических процессах и в меньшем количестве – для заполнения ламп накаливания. Вместе с Ne, Кr и Хе, которые получают в значительно меньших количествах, Аr также используют в разрядных трубках – получаемый цвет трубки зависит от того, какой состав имеет смесь газов. Благородные газы также используются в флуоресцентных трубках, хотя в этом случае цвет зависит не от газа, наполняющего трубку, а от фосфора, покрывающего изнутри стенки трубки. Еще одна важная область применения – лазеры, хотя по сравнению с другими областями применения количество газа, который здесь используется, незначительно.
Другие благородные газы существенно дороже, поэтому их применение ограничено только узкоспециальными областями. Радон использовали в лечении раковых заболеваний и в качестве источника радиоактивности в дефектоскопии металлического литья, однако из-за короткого периода полураспада (3,824 суток) его вытеснили другие материалы. То небольшое количество радона, которое требуется в практике, получают как продукт распада 226Ra (1 г которого в течение 30 суток дает 0,64 см3 радона).
9
ГЛАВА 2. VIII-B ГРУППА
2.1.Простые вещества
2.1.1.Электронное строение
VIII-B группа включает сразу девять элементов: железо 26Fe, рутений 44Ru, осмий 76Os, кобальт 27Со, родий 45Rh, иридий 77Ir, никель 28Ni, палладий 46Pd и платину 78Pt.
Свойства химических элементов VIII-B группы различаются не слишком сильно, что послужило причиной их объединения в триады. Сходство в свойствах обусловлено сохранением состава и строения наружной электронной оболочки атомов при последовательном увеличении атомного номера элемента и соответственно общего числа электронов в изолированном атоме. У элементов триад при неизменной структуре внешней электронной оболочки (главное квантовое число n = 4, 5, 6) достраивается (при росте атомного номера) соответствующий d-подуровень (электронный n – 1-слой), степень заполнения которого не оказывает определяющего влияния на размеры атомов и ионов, а также на свойства соединений – по крайней мере, если химическая связь в них имеет преимущественно ионный характер.
В то же время свойства соединений элементов триады железа отличаются от свойств аналогичных по составу соединений элементов триад палладия и платины (семейство платиновых элементов) очень существенно.
Одной из причин большего сходства между собой соединений платиновых элементов (ПЭ) по сравнению с соединениями триады железа является влияние лантанидного сжатия. Так, атомные радиусы элементов триад палладия и платины почти одинаковы, но значительно отличаются от радиусов атомов элементов триады железа.
При движении сверху вниз по группе возрастает устойчивость соединений, содержащих элемент в высшей степени окисления (см. схему ниже). Если для железа наиболее характерными являются степени окисления +2 и +3, а состояния +6 и особенно +8 неустойчивы, то для осмия вполне стабильны соединения, содержащие элемент в наиболее высокой из возможных степеней окисления +8. Аналогичная закономерность наблюдается при переходе от Со и Ni к их тяжелым аналогам. Так, для никеля наиболее устойчивы соединения, где он имеет степень окисления +2, а для палладия и особенно для платины характерна степень окисления +4.
10
