
8 группа
.pdf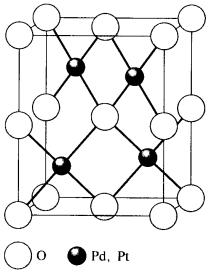
Нагревание мелкораздробленных палладия и платины при 500 °С в токе кислорода позволяет получить оксид палладия (II) PdO, нерастворимый в кислотах, и оксид платины (II) PtO, растворимый в царской водке. Строение этих оксидов приведено на рис. 13. Если платину нагревать при повышенном давлении кислорода, то, в соответствии с отмеченной выше закономерностью, образуется оксид платины (IV) PtO2, что не характерно для палладия – легкого аналога платины.
Рис. 13. Строение оксидов PdO, PtO [1]
При электролизе щелочных растворов с использованием Pt-электродов на аноде образуется оксид платины (VI) РtO3, который разлагается при комнатной температуре (2PtO3 = PtO2 + O2) и проявляет свойства сильного окислителя, в частности выделяет хлор из НСl:
РtO3 + 8НСl = H2[PtCl6] + Cl2↑ + 3H2O.
Взаимодействуя с КОН, триоксид платины образует платинат состава
K2Pt3O10. Известны также оксиды платины состава Pt3O4 и Pt2O3, но они недостаточно изучены.
2.7.2. Гидраты оксидов
Гидратированные оксиды ПЭ крайне неустойчивы, равновесие гидратации резко смещено влево:
(ПЭ)Ох + aq ↔ (ПЭ)Ox · aq ↔ (ПЭ)(ОН)x + yaq.
Неустойчивость гидратов оксидов и образующихся из них гидроксидов объясняется слабой полярностью связи ПЭ–О в оксидах, имеющих преимущественно ковалентный характер. Очевидно, кроме того, что если связь ПЭ–О в оксидах слаба, то в гидратированных оксидах и в гидроксидах она еще менее прочная. В связи с этим оксиды большинства ПЭ с водой практически не взаимодействуют и в ней не растворяются.
Только высшие оксиды ПЭ осмия и рутения способны растворяться в воде. При растворении OsO4 в воде образуется раствор, содержащий ком-
41
плекс H2[OsO4(OH)2], реакция которого близка к нейтральной из-за слабых кислотных и основных свойств. При действии на этот раствор концентрированных щелочей выделяется красный осадок кристаллических осматов (VIII) (или перосматов) состава (MI)2[OsO4(OН)2], содержащих октаэдрический анион.
Оксид RuO4 при действии щелочей отщепляет O2 и образует рутенаты (VII) (или перрутенаты) состава (MI)[RuO4]; при нагревании (200 °С) щелочных растворов – рутенаты (VI) (MI)2[RuO3(OН)2], содержащие анион тригонально-бипирамидального строения.
Низшие оксиды RuO2 и OsO2 в отличие от высших оксидов этих ПЭ не растворяются в воде, но соответствующие гидрат оксида RuO2 · nН2O и гидроксид Os(OH)4 можно получить гидролизом тетрахлоридов.
Хотя оксиды рутения и осмия в степени окисления +7 и +6 не удалось синтезировать, соли, содержащие соответствующие оксоанионы, известны.
Это рутенаты (VI и VII) и осматы (VI) состава транс-(MI)2[OsO2(OН)4] и
(MII)2[OsO3(OH)2]2, при нагревании переходящие в соли оксокислот
(MII)OsO4, а также осматы (VII) (MI)5[OsO6] и [R4As][OsO4].
Оксиды ПЭ Rh и Ir в воде, кислотах и щелочах не растворяются, поэтому соответствующие гидраты оксидов и гидроксиды получают косвенным путем. Действием щелочи на растворы солей родия (III) можно получить гидроксид Rh(OH)3 · nH2O желтого цвета, легко растворимый в кислотах и концентрированных щелочах. При его нагревании образуется оксогидроксид RhOOH (изоструктурен CrOОН), при дальнейшей дегидратации переходящий в Rh2O3.
Гидроксид иридия (IV) Ir(ОН)4 растворим в НСl за счет образования комплекса Н2[IrСl6], но нерастворим в щелочах. Его можно получить гидролизом галогенидов и иридатов (IV). Спеканием при высокой температуре с оксидами ЩЭ и ЩЗЭ получают иридаты (IV) различного состава: (MI)2IrO3,
(MI)8[IrO6] и др.
Гидроксиды (и оксиды) родия и иридия в более высоких, чем +4, степенях окисления не получены, за исключением IrO2,7, являющегося сильным окислителем.
Гидрат оксида палладия (II) Pd(OH)2 · nH2O образуется при действии щелочей на соли Pd2+ . Свежеосажденный, он легко растворяется в кислотах и щелочах.
Гидрат оксида палладия (IV) PdO2 · nH2O темно-красного цвета осаждают действием щелочей на растворы, содержащие соединения палладия (IV). Он растворим в кислотах и концентрированных щелочах. При нагревании до 200 °С PdO2 · nH2O теряет не только воду, но и кислород, переходя в PdO:
2PdO2 · nH2O = 2PdO + O2↑ + 2nН2O.
Гидрат оксида палладия (IV) является сильным окислителем.
42
Гидроксид Pt(OH)2 · nH2O красного цвета получают действием щелочи на соединения Pt (II) в отсутствие кислорода. При нагревании гидроксид платины (II) сначала теряет воду и диспропорционирует на Pt и РtO2. Затем образовавшийся РtO2 разлагается на простые вещества.
Гидрат оксида РtO2 · nH2O получают добавлением щелочи к водному раствору PtCl4. Это желтый амфотерный осадок, который при нагревании превращается в почти черный PtO2. Имеет несколько гидратных форм (различно окрашенных), растворяется в кислотах и щелочах (при кипячении) с образованием комплексных соединений:
РtO2 · nH2O + 6НСl = H2[PtCl6] + (n + 2)Н2O,
РtO2 · nH2O + 2КОН = K2[Pt(OH)6] + (n – 2)Н2O.
Гексагидроксоплатинат (IV) калия K2[Pt(OH)6] можно получить также кипячением раствора H2[PtCl6] со щелочью:
H2[PtCl6] + 8КОН = K2[Pt(OH)6] + 6КСl + 2Н2O.
При подкислении раствора K2[Pt(OH)6] минеральной кислотой выпада-
ет белый осадок гексагидроксоплатиновой (IV) кислоты: [Pt(OH)6]2– + 2Н+ = H2[Pt(OH)6]4.
В этом соединении соседствуют протоны и ионы гидроксила, но реакции нейтрализации не происходит – настолько прочно связывает Pt (IV) ионы ОН–, находящиеся во внутренней координационной сфере.
Сильнощелочная реакция водного раствора K2[Pt(OH)6] свидетельствует о слабости кислотных свойств H2[Pt(OH)6].
Оксиды платины состава Pt3O4 и Pt2O3 мало изучены, но известно, что последнему соответствует нерастворимый в воде гидрат оксида плати-
ны (III) Pt2O3 · nH2O.
2.7.3. Соли кислородсодержащих кислот
Соли кислородсодержащих кислот с ПЭ в катионной форме малочисленны из-за нестабильности для ПЭ катионного состояния.
Ru и Os практически не образуют солей, где эти элементы выполняют катионную функцию, так как для этих элементов наиболее характерны высокие степени окисления, нестабильные в катионной форме и реализующиеся только в ковалентных соединениях. Можно упомянуть лишь желтого
цвета нитрат рутения (III) Ru(NO3)3 · 6Н2O, оксоацетаты рутения
[Ru3II,IIIO(СН3СOO)6(Н2O)3]n и [Ru3O(CH3COO)6]CH3COO, а также черного цвета малорастворимый сульфит осмия (II) состава OsSO3.
Для Rh и Ir в степени окисления +3 из солей кислородсодержащих кислот синтезированы сульфаты Э2(SO4)3 · nН2O, а также квасцы (MI)Э(SO4)2 · 12Н2O. Кроме того, описан гигроскопичный нитрат родия Rh(NO3)3, фосфат RhPO4, арсенат RhAsO4. Для иридия и родия получены сульфиты Э2(SO3)3 · 6Н2O. Стабилизация многих солей Rh и Ir обусловлена образованием кристаллогидратов. Существует и ацетат родия (II) [Rh(CH3COO)2H2O]2, строение которого аналогично строению ацетата хрома (II).
43
Более многочисленны соли кислородсодержащих кислот, включающие в состав катионы Pd и Pt, главным образом Э2+. Так, для палладия получены перхлорат Pd(ClO4)2 · 4Н2O, сульфат PdSO4 · 2Н2O, селенат PdSeO4, нитрат Pd(NO3)2 · 2Н2O. Платина (II) и палладий (II) образуют ацетаты [Э(СН3СОО)2]3. Из солей Э (IV) удалось выделить лишь малоустойчивый
нитрат Pd(NO3)4, который количественно окисляет иодид-ион до иода, но не реагирует с Fe2+:
Pd(NO3)4 + 2KI = Pd(NO3)2 + I2 + 2KNO3.
Растворы катионных солей ПЭ в присутствии избытка аниона кислородсодержащей кислоты образуют комплексные соединения.
2.7.4. Комплексные соединения платиновых элементов в разных степенях окисления
По склонности к комплексообразованию платиновым элементам уступают даже элементы триады железа: валентные орбитали ПЭ имеют большую протяженность, что способствует донорно-акцепторному взаимодействию и увеличивает энергию расщепления d-орбиталей кристаллическим полем лигандов. Другими словами, электронные оболочки ПЭ обладают достаточной мягкостью для образования ковалентных связей с донорными атомами лигандов.
ПЭ образуют комплексные соединения различных типов:
–катионные с нейтральными монодентатными лигандами, такими как вода, аммиак, амины и др.;
–анионные с моноили бидентатными лигандами – анионами сильных
ислабых кислот (галогенидные, сульфатные, нитритные, оксалатные, цианидные, роданидные, ацетатные и др.);
–нейтральные с такими моноили полидентатными лигандами, как оксид углерода (II), триалкил- и трифенилфосфин и др.
Есть комплексы ПЭ с хелатообразующими полидентатными лигандами. Нулевую степень окисления ПЭ, как и элементы триады железа и других элементов-металлов ПС, имеют в карбонилах различного состава, причем карбонилы ПЭ данной группы ПС одинаковы по стехиометрическому
составу, свойствам и строению.
Так, карбонилы Ru(CO)5 и Os(CO)5 представляют собой летучие жидкости, состоящие из молекул тригонально-бипирамидального строения (аналогия с пентакарбонилом железа). Известны и термически более устой-
чивые полиядерные кластеры Э3(СО)12, а также кластеры более сложного состава, например Os6(CO)18. В отличие от никеля платина и палладий не образуют карбонилов состава Э(СО)4.
Комплексные соединения (КC), образованные ПЭ в степени окисления +2, наиболее характерны для палладия и платины, которые проявляют в них КЧ = 4 (координационный полиэдр – квадрат). Это очень устойчивые ком-
44
плексы с аммиаком [Э(NH3)4]2+ и галогенид-ионами [ЭХ4]2– (фторидные производные получены лишь для палладия). Еще более устойчивы тетрацианопалладат (II)- и тетрацианоплатинат (II)-анионы. Тетрацианоплатиновая кислота H2[Pt(CN)4] · 5Н2O выделена в кристаллическом состоянии: в водном растворе она проявляет свойства сильной кислоты. Для палладия (II) и платины (II) получены роданидные [Э(SCN)4]2– и оксалатные [Э(С2O4)2]2– комплексы.
Рутений (II) и осмий (II) образуют цианидные комплексы с КЧ = 6, аналогичные соединениям железа (II).
Степень окисления +3 в КС наиболее характерна для Ru, Rh, Os и Ir, проявляющих, как правило, КЧ = 6. В качестве лигандов выступают галогенидионы и аммиак (для ряда элементов получены смешанно-лигандные комплексы, содержащие во внутренней сфере как аммиак, так и ионы галогенов), оксалат- и роданид-ионы (для Ru, Rh, Ir), цианид-ионы (для Rh и Ir) и др.
Все платиновые элементы образуют КС, в которых они проявляют степень окисления +4, но наиболее характерны такие КС для платины. В основном это низкоспиновые комплексы октаэдрической координации – галогенидные, аммиачные и смешанно-лигандные комплексы. Действием окса- лат-иона эти комплексы восстанавливаются до производных платины (II).
Среди КС платины наиболее практически важным соединением является гексахлороплатиновая (платинохлористоводородная) кислота H2[PtCl6]. Этот комплекс обычно используют для приготовления других соединений платины. Твердая кислота H2[PtCl6] представляет собой красно-коричневые кристаллы. Ее растворы окрашены в желтый цвет. Хотя соли этой кислоты с многозарядными катионами растворимы, однозарядные катионы К+, Rb+, Cs+ и NH4+ образуют с анионом [PtCl6]2– малорастворимые соединения, поэтому гексахлороплатиновая кислота используется как реактив на тяжелые ЩЭ:
H2[PtCl6] + 2КСl = K2[PtCl6]↓ + 2НСl.
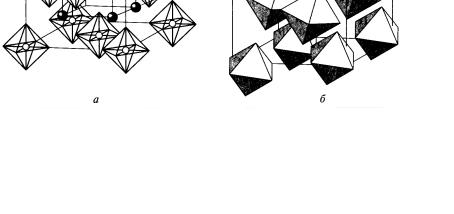
K2[PtCl6] кристаллизуется в структуре антифлюорита: положения Са2+ в структуре CaF2 занимают октаэдры [PtCl6]2–, а ионов F– – катионы К+ (рис. 14).
Рис. 14. Строение соединений платины(IV):
а – K2[PtCl6]; б – H2[Pt(OH)6] (атомы водорода не показаны) [1]
45
ПЭ в степени окисления +5 имеют только фторидные комплексные со-
единения [ЭF6]–, в том числе O2[PtF6] и [XeF][PtF6].
Степень окисления +6, как и следовало ожидать, наиболее характерна для комплексов рутения и осмия. Практически все они являются смешаннолигандными и содержат, наряду с галогенид-, цианид- и другими анионами,
атомы кислорода, например M4[OsO4F2], M2[OsO2F4], M2[OsO2(C2O4)2], т. е.
представляют собой оксокомплексы.
2.8. Применение платиновых элементов
Широкое применение в ювелирном деле находит «белое золото» – се- ребристо-белый сплав золота с палладием (90 % Au, 10 % Pd) или платиной (60 % Au, 40 % Pt). Интересно, что золото не смешивается с платиной в твердом виде, такой сплав представляет собой смесь твердых растворов платины в золоте и золота в платине.
Ежегодное мировое потребление платиновых металлов оценивается в 200 т. По цене платина примерно вдвое превосходит золото, а родий, иридий, рутений и осмий – в несколько раз дороже платины. Самый дешевый из платиновых металлов – палладий. Он стоит менее 4 долл. США за 1 г.
Среди потребителей платины, родия и палладия на первом месте стоит автомобильная промышленность, которая широко внедряет сделанные на их основе катализаторы для дожигания выхлопных газов двигателей. Эффективность использования катализаторов напрямую зависит от качества бензина – высокое содержание в нем органических соединений серы приводит
кбыстрому отравлению катализатора и его деградации.
Внастоящее время широкое распространение получили трехфункциональные катализаторы (вызывают полное окисление углеводородов, оксида углерода (II) и оксидов азота), разработанные в США в начале 1970-х гг.
Благодаря высокой термостойкости и большим значениям термоэлектродвижущей силы сплавы платиновых металлов используют при производстве термопар для измерения высоких температур: платинородиевые термопары работают при нагревании до 1300 °С, а родийиридиевые – 2300 °С.
Химическая инертность и тугоплавкость делает платину и платиноиды удобными материалами для изготовления электродов, лабораторной посуды, химических реакторов, например стеклоплавильных аппаратов. Палладий служит основным материалом для многослойных керамических конденсаторов, используемых в компьютерах, мобильных телефонах. В электротехнике платину и палладий используют для нанесения защитных покрытий на электрические контакты и сопротивления, поэтому их можно извлекать из отработанных электротехнических устройств.
46
ЛИТЕРАТУРА
1.Неорганическая химия : учебник для студ. вузов, обуч. по направлению 510500 «Химия» и специальности 011000 «Химия» : в 3 т. / под ред.
Ю.Д. Третьякова. – М. : Academia, 2004. – Т. 2. – 365 с. ; Т. 3, кн. 1. – 348 с. ; Т. 3, кн. 2. – 399 с.
2.Неорганическая химия. Химия элементов : учебник : в 2 т. / Ю.Д. Третьяков [ и др.]. – 2-е изд., перераб. и доп. – М. : Изд-во МГУ : Ака-
демкнига, 2007. – Т. 1. – 538 с.; Т. 2. – 670 с.
3.Гринвуд Н. Химия элементов : [учебник для вузов] : в 2 т. / Н. Грин-
вуд, А. Эрншо. – М. : БИНОМ. Лаб. знаний, 2008. – Т. 1. – 607 с. ; Т. 2. – 670 с.
4.Угай Я.А. Неорганическая химия : учебник для хим. спец. вузов /
Я.А. Угай. – М. : Высш. шк., 1989. – 463 с.
5.Угай Я.А. Общая и неорганическая химия : учебник для студ. вузов, обуч. по направлению и специальности «Химия» / Я.А. Угай. – Изд. 5-е,
стер. – М. : Высш. шк., 2007. – 526 с.
6.Шрайвер Д. Неорганическая химия : в 2 т. / Д. Шрайвер, П. Эт-
кинс. – М. : Мир, 2004. – Т. 1. – 679 с. ; Т. 2. – 486 с.
7.Лидин Р.А. Химические свойства неорганических веществ : учеб. пособие для вузов / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева ; под ред. Р.А. Лидина. – 4-е изд., стер. – М. : КолосС, 2003. – 480 с.
8.Льюис М. Химия в диаграммах / М. Люис ; пер. с англ. С.П. Торши-
на. – М. : АСТ : Астрель, 2004. – 159 с.
47
СОДЕРЖАНИЕ |
|
ПРЕДИСЛОВИЕ....................................................................................................... |
3 |
ГЛАВА 1. VIII-A ГРУППА ..................................................................................... |
3 |
1.1. Простые вещества..................................................................................... |
3 |
1.1.1. Свойства элементов....................................................................... |
3 |
1.1.2. Нахождение в природе, получение.............................................. |
4 |
1.1.3. Физические свойства..................................................................... |
5 |
1.2. Химические свойства................................................................................ |
5 |
1.3. Применение ............................................................................................... |
8 |
ГЛАВА 2. VIII-В ГРУППА.................................................................................... |
10 |
2.1. Простые вещества................................................................................... |
10 |
2.1.1. Электронное строение................................................................. |
10 |
2.1.2. Нахождение в природе, получение............................................ |
12 |
2.2. Элементы триады железа....................................................................... |
15 |
2.2.1. Физические свойства................................................................... |
15 |
2.2.2. Химические свойства.................................................................. |
16 |
2.2.3. Галогениды................................................................................... |
18 |
2.3. Кислородные соединения элементов триады железа.......................... |
20 |
2.3.1. Степень окисления +2 ................................................................. |
20 |
2.3.2. Степень окисления +3 ................................................................. |
23 |
2.3.3. Другие степени окисления.......................................................... |
25 |
2.3.4. Соли кислородсодержащих кислот ........................................... |
26 |
2.3.5. Халькогениды .............................................................................. |
28 |
2.4. Комплексные соединения элементов триады железа.......................... |
29 |
2.4.1. Степень окисления +2 ................................................................. |
29 |
2.4.2. Степень окисления +3 ................................................................. |
31 |
2.4.3. Соединения в низких степенях окисления................................ |
33 |
2.5. Применение элементов триады железа................................................. |
34 |
2.6. Платиновые элементы............................................................................ |
35 |
2.6.1. Простые вещества........................................................................ |
35 |
2.6.2. Галогениды................................................................................... |
37 |
2.6.3. Другие бинарные соединения .................................................... |
38 |
2.7. Кислородные соединения платиновых элементов.............................. |
38 |
2.7.1. Оксиды.......................................................................................... |
39 |
2.7.2. Гидраты оксидов.......................................................................... |
41 |
2.7.3. Соли кислородсодержащих кислот ........................................... |
43 |
2.7.4. Комплексные соединения платиновых элементов |
|
в разных степенях окисления............................................................... |
44 |
2.8. Применение платиновых элементов..................................................... |
46 |
ЛИТЕРАТУРА........................................................................................................ |
47 |
48
Учебное издание
ХИМИЯ ЭЛЕМЕНТОВ VIII ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Учебное пособие
Составители: Миттова Ирина Яковлевна, Томина Елена Викторовна,
Сладкопевцев Борис Владимирович, Солодухин Даниил Олегович
Корректор В.П. Бахметьев Компьютерная верстка О.В. Шкуратько
Подп. в печ. 16.05.2013. Формат 60×84/16.
Усл. печ. л. 2,8. Тираж 25 экз. Заказ 1247.
Издательско-полиграфический центр Воронежского государственного университета.
394000, г. Воронеж, пл. им. Ленина, 10. Тел. (факс): +7 (473) 259-80-26 http://www.ppc.vsu.ru; e-mail: pp_center@ppc.vsu.ru
Отпечатано в типографии Издательско-полиграфического центра Воронежского государственного университета.
394000, г. Воронеж, ул. Пушкинская, 3. Тел. +7 (473) 220-41-33
49
