
8 группа
.pdfблагоприятствуют тетраэдрической форме, поскольку для нейтрализации катионного заряда металла требуется меньшее их число.
Наиболее очевидное различие октаэдрических и тетраэдрических соединений состоит в том, что первые имеют цвет от розового до фиолетового, в то время как последние – синие. Это можно продемонстрировать хо-
рошо известным равновесием:
[Со(Н2O)6]2+ + 4Сl– ↔ [СоСl4]2– + 6Н2O
розовый синий
Существование квадратных комплексов также надежно установлено. Они не очень многочисленны и включают [Со(фталоцианин)] и [Co(CN)4]–.
Никель (II) образует соли практически со всеми анионами и демонстрирует разнообразную химию водных растворов; в отсутствие сильных
комплексообразующих лигандов в них всегда присутствует зеленый катион
[Ni(H2O)6]2+.
Координационное число Ni редко превышает 6, а его основные типы координационной геометрии – октаэдр и квадрат (КЧ 4); примеров тригональной бипирамиды (КЧ 5), квадратной пирамиды (КЧ 5) и тетраэдра (КЧ 4) немного.
Из комплексов Ni с КЧ 4 наиболее многочисленны плоско-квадратные, например желтый [Ni(CN)4]2–.
Встречаются также (хотя и реже, чем квадратные) тетраэдрические комплексы никеля (II). Простейшие из них – голубые ионы [NiX4]2– (Х = Сl, Вr, I), осаждаемые из этаноловых растворов.
2.4.2. Степень окисления +3
Железо (III) образует разнообразные катионные, нейтральные и анионные комплексы; интересная особенность его координационной химии состоит в явно выраженном предпочтении О-донорных лигандов перед N-до- норными. Аминные комплексы Fe (III) неустойчивы и диссоциируют в воде; хелатные лиганды образуют более устойчивые комплексы, но даже они менее устойчивы, чем их аналоги с Fe (II). Добавление фосфорной кислоты к желтому водному раствору FeCl3 приводит к его обесцвечиванию вследствие образования фосфатных комплексов [Fe(PO4)3]6– и [Fe(HPO4)3]3–. Темнокрасный [Fe(Ас)3] и зеленый [Fe(C2O4)3]3– – еще два примера комплексов с О-донорными лигандами, хотя последний, будучи очень устойчивым к диссоциации, чувствителен к свету из-за окисления оксалат-иона ионом Fe(III) и разлагается на Fe(C2O4) и СO2.
Стабильность галогенидных комплексов от F– к I– заметно уменьшается. Комплексы с фтором достаточно устойчивы, и в водных растворах преобладают частицы [Fe(H2O)F5]2–, тогда как выделение твердого вещества и сплавление с KHF2 приводит к образованию [FeF6]3–. Комплексы с хлором заметно менее устойчивы, и в них чаще наблюдается тетраэдрическая, а не
31
октаэдрическая координация. [FeCl4]– можно выделить в виде солей желтого цвета с крупными катионами, такими как [RN4]+, из растворов в этаноле или концентрированной НСl. Известны также [FeBr4]– и [FeI4]–, однако они легко восстанавливаются до Fe либо путем реакции внутреннего окислениявосстановления, либо при действии избытка лиганда.
Кроваво-красный цвет, получаемый при смешивании водных растворов Fe (III) и SCN– – хорошо известная качественная проба на Fe (III), в большей степени обусловлен присутствием иона [Fe(H2O)5SCN]2+. Однако по-
мимо него могут быть выделены простая соль Fe(SCN)3 и соли комплексов
[Fe(SCN)4]– и [Fe(SCN)6]3–.
Комплексные соединения Co (III) низкоспиновые и октаэдрические. [Со(Н2O)6]3+ настолько сильный окислитель, что неустойчив в водных растворах; можно выделить лишь несколько гидратов простых солей, таких как синий Co2(SO4)3 · 18Н2O и MCo(SO4)2 · 12Н2O (М = К, Rb, Cs, NH4), которые содержат гексаакваион, а также CoF3 · 3,5Н2O. Столь малое число простых солей кобальта (III) резко контрастирует с широкой распространенностью его комплексов, особенно c N-донорными лигандами.
Комплексы кобальта (III) кинетически инертны, поэтому предпочтительнее использовать непрямые методы получения. Чаще всего лиганд добавляют к водному раствору соответствующей соли кобальта (II) и получаемый при этом комплекс кобальта (II) окисляют каким-либо удобным окислителем, нередко (при использовании N-донорного лиганда) в присутствии катализатора типа активного древесного угля. Часто в качестве окислителя используют молекулярный кислород.
Аммиачные комплексы кобальта, число которых огромно, были среди первых систематически изученных координационных соединений. Процесс окисления водных смесей СоХ2, NH4X и NH3 (Х = Сl, Вr, NO3 и т.д.) можно, меняя условия и соотношение реагентов, применять для приготовления та-
ких комплексов, как [Co(NH3)6]3+, [Co(NH3)5X]2+ и [Co(NH3)4X2]+. Число та-
ких соединений дополнительно увеличивается благодаря замещению X на другие анионные или нейтральные лиганды.
Еще один N-донорный лиганд, образующий чрезвычайно устойчивые комплексы, – ион NO2; наиболее известный его комплекс – оранжевый гексанитритокобальтат (III) натрия Na3[Co(NO2)6]. При добавлении фторидионов получают K3[CoF6]; его анион весьма примечателен: это единственный гексагалогенокобальтат (III).
Комплексы кобальта (III) с О-донорными лигандами обычно менее устойчивы, чем комплексы с N-донорными лигандами, хотя темно-зеленые комплексы [Со(Ас)3] и МI3[Со(С2O4)3], образованные хелатными лигандами ацетилацетонатом и оксалатом, достаточно устойчивы. Однако другие карбоксилатные комплексы, например ацетатные, менее устойчивы.
32
2.4.3. Соединения в низких степенях окисления
Имея конфигурацию d6s2, элементы этой группы способны подчиняться правилу 18 электронов, образуя моноядерные карбонилы типа М(СО)5. Это летучие жидкости, которые можно приготовить прямой реакцией СО с порошком металла. В этом случае необходимы повышенные температура и давление.
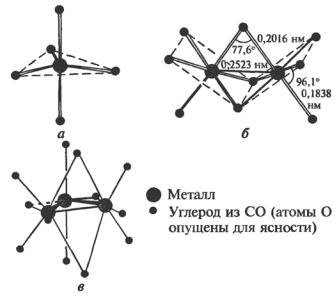
Fe(CO)5 – высокотоксичное вещество, открытое в 1891 г. До этого единственным известным карбонилом металла был Ni(CO)4. Подобно термически неустойчивым аналогам Ru и Os, он имеет структуру тригональной бипирамиды (рис. 10, а).
Рис. 10. Некоторые карбонилы Fe:
а– Fe(СО)5; б – Fe2(CO)9 Fe–Fe = 0,2523 нм;
в– Fe3(CO)12 Fe–Fe = 0,256 нм (одна) и 0,268 нм (две)[3]
Если Fe(CO)5 в органическом растворителе подвергается УФ-облу- чению, образуются летучие оранжевые кристаллы карбонила Fe2(CO)9. Его структура представляет собой два октаэдра с общей гранью (рис. 10, б). Fe3(CO)12 – темно-зеленое твердое вещество, которое удобнее всего получать окислением [FeH(CO)4]–. Оно имеет структуру треугольника, в котором два атома железа связаны парой карбонильных групп (рис. 10, в). Его можно рассматривать как производное Fe2(CO)9 в котором мостиковая группа СО замещена на Fe(CO)4.
Из-за нечетного числа валентных электронов у кобальта его карбонилы могут удовлетворять правилу 18 электронов только в том случае, если присутствуют связи М–М. Соответственно он не образуют моноядерных карбо-
нилов; главные карбонилы – [Co2(СО)8], [Co4(СО)12] и [Co6(СО)16]. Двухъядерные октакарбонилы получают нагреванием металла при вы-
соком давлении СО (200–300 атм). До сих пор лучше всего изучен Со2(СО)8,
33
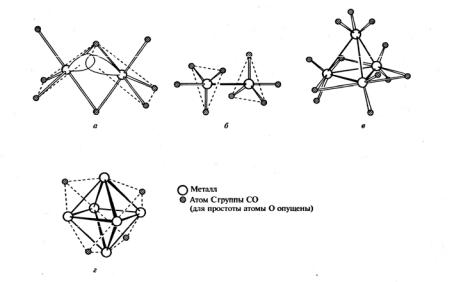
а два других карбонила описаны недостаточно полно; октакарбонил Со – это чувствительное к воздуху оранжево-красное твердое вещество, плавящееся при температуре 51 °С. Его структуру с двумя мостиковыми карбонильными группами (рис. 11, а), возможно, легче всего объяснить образованием «изогнутой» связи Со–Со при перекрывании орбиталей металла, расположенных под углом (гибриды d2sp3). Однако в растворе эта структура находится в равновесии со второй формой (рис. 11, б), у которой нет мостиковых карбонилов и которая не распадается только благодаря связи Со–Со.
Рис. 11. Структуры молекул некоторых бинарных карбонилов Со:
а– Со2(СО)8 втвердомсостоянии; показанообразование«изогнутой» связиСо–Со;
б– Со2(СО)8 в растворе; в – Co4(СО)12; г – Со6(СО)16 [3]
2.5.Применение элементов триады железа
Железо – один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов – важнейших конструкционных материалов, а также может входить в состав сплавов на основе других металлов – например, никелевых. Магнитная окись железа (магнетит) – важный материал в производстве устройств долговременной компьютерной памяти: жестких дисков, дискет и т. п. Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов, трансформаторов и электродвигателей.
Более половины производимых кобальта и никеля расходуется на производство сплавов. Магнитные сплавы на основе кобальта (Fe–Со–Mo, Fe– Ni–Со–Al, Sm–Со) способны сохранять магнитные свойства при высоких температурах. Металлокерамические сплавы, представляющие собой карбиды титана, вольфрама, молибдена, ванадия и тантала, цементированные кобальтом, идут на изготовление режущих инструментов. Стали с большим
34
содержанием никеля и хрома не корродируют на воздухе, из них делают хирургические инструменты, аппаратуру для химической промышленности. Жаростойкий хромоникелевый сплав нихром, содержащий 20–30 % хрома, обладает высоким электрическим сопротивлением, из него изготавливают спирали электронагревателей. В качестве нагревательных элементов также используют медно-никелевые сплавы константан (40 % Ni, 60 % Сu) и нике-
лин (30 % Ni, 56 % Сu, 14 % Zn); из монеля (68 % Ni, 28 % Сu, 2,5 % Fe, 1,5 % Мn) чеканят монету.
Важное значение имеют суперсплавы – материалы на основе железа, кобальта или никеля, специально разработанные для эксплуатации при высоких температурах. Они обладают высокой коррозионной стойкостью, сохраняют прочность в интервале температур, при которых работают газовые турбины, характеризуются высоким модулем упругости и низким коэффициентом термического расширения.
Мелкодисперсные кобальт и никель обладают высокой каталитической активностью. Тонкий порошок кобальта, осажденный на носителе, служит катализатором гидроформилирования по Фишеру – Тропшу. Никель часто заменяет платину в процессах гидрирования. Никель идет на производство щелочных аккумуляторов.
2.6.Платиновые элементы
2.6.1.Простые вещества
Платиновые элементы (ПЭ) в форме простых веществ – блестящие се- ребристо-белые (кроме синевато-серого осмия) металлы. Их металлические радиусы почти одинаковы, что обусловливает большое сходство химических свойств и, в частности, совместное присутствие ПЭ в рудах.
Рутений и осмий кристаллизуются в гексагональной структуре с плотнейшей упаковкой, остальные – в структуре ГЦК. Платиновые металлы (ПМ) тугоплавки и труднолетучи. В обеих триадах слева направо Tпл металла понижается (как и в триаде железа).
Самым тугоплавким является осмий. У него и самая высокая плотность (22,7 г/см3), причем не только среди ПМ, но и среди всех известных на Земле веществ, что объясняется, по-видимому, образованием большого числа связей металл–металл (характер их близок к ковалентному) и возникающей в результате очень плотной упаковкой атомов. Плотность остальных металлов триады платины также очень велика (около 22 г/см3, табл. 5), металлы триады палладия менее плотные (~12 г/см3).
При малом содержании примесей платиновые металлы обладают высокой пластичностью. Она максимальна у палладия и платины.
Малая склонность к вступлению в химическое взаимодействие платиновых элементов в металлическом состоянии иллюстрируется значениями
35
стандартных окислительно-восстановительных потенциалов Е0 (Э2+/Э0): во всех случаях равновесие ПЭ2+ ↔ ПЭ0 сдвинуто в сторону металла. Это соответствует их положению в ряду напряжения (правее водорода).
Таблица 5
Важнейшие свойства ПЭ в металлическом состоянии [2]
Элемент |
Тпл, |
о |
С |
Ткип, |
о |
С |
Структура |
Плотность, |
Е0 (Э2+/Э0), |
|
|
металла |
г/см3 |
В |
|||||
Ru |
2310 |
4100 |
ГПУ |
12,37 |
0,45 |
||||
|
|
|
|
|
|
||||
Rh |
1960 |
3670 |
ГЦК |
12,41 |
0,6 |
||||
|
|
|
|
|
|
||||
Pd |
1552 |
2900 |
ГЦК |
12,02 |
0,99 |
||||
|
|
|
|
|
|
||||
Os |
3050 |
5000 |
ГПУ |
22,7 |
0,85 |
||||
|
|
|
|
|
|
||||
Ir |
2443 |
4500 |
ГЦК |
22,63 |
> + 1,1 |
||||
|
|
|
|
|
|
||||
Pt |
1796 |
3800 |
ГЦК |
21,46 |
1,2 |
||||
|
|
|
|
|
|
|
|
|
|
Металлические рутений и осмий при нагревании на воздухе окисляются с образованием оксидов состава RuO2 и OsO4. Наиболее реакционноспособен осмий, он окисляется кислородом уже при комнатной температуре. Вероятно, этому способствует удаление продукта окисления с поверхности осмия в форме летучего OsO4. Родий и иридий в тех же условиях окисляются до Rh2O3 и IrO2. Палладий под действием О2 переходит в оксид PdO. Платина при нагревании в атмосфере O2 окисляется только с поверхности, и можно считать, что лишь она стабильна в кислородной атмосфере.
По отношению к другим неметаллам ПМ мало реакционноспособны. Однако при нагревании они реагируют практически со всеми неметаллами, образуя галогениды, халькогениды, фосфиды, силициды, бориды, но не взаимодействуют с азотом.
Платиновые металлы образуют непрерывные твердые растворы между собой, с металлами триады железа, а также с изоструктурными металлами с близкими значениями атомных радиусов и сходным строением валентных электронных оболочек. Для ПМ характерны нестехиометрические интерметаллические соединения с широкими областями гомогенности.
По отношению к кислотам наиболее реакционноспособны металлические платина и палладий. Палладий растворяется в HNO3, платина – в царской водке:
Pd + 4HNO3 = Pd(NO3)2 + 2NO2↑ + 2H2O,
3Pt + 4HNO3 + 18HCl = 3H2[PtCl6] + 4NO↑ + 8H2O.
Металлические Ru, Rh, Os и Ir, если они находятся в компактном (слиток), а не мелкораздробленном состоянии, не растворяются даже в царской водке. Однако рутений и осмий можно перевести в растворимые соединения сплавлением со щелочами в присутствии окислителей:
36
Э + 3KNO3 + 2КОН = К2ЭO4 + 3KNO2 + Н2O.
При сплавлении Rh и Ir с пероксидом бария образуются оксиды различного состава:
2Rh + 3ВаO2 = Rh2O3 + 3BaО,
Ir + 2ВаO2 = IrO2 + 2ВаО.
Можно перевести ПЭ из металлического состояния в водорастворимые комплексы хлорированием при температуре красного каления смеси мелкораздробленных металлов и NaCl. Например, родий и иридий (а также палладий и платина) образуют в этих условиях гексахлорокомплексы Э (IV):
2Rh + 3Сl2 + 6NaCl = 2Na3[ RhCl6],
Ir(губка) + 2Сl2 + NaCl = Na2[IrCl6].
2.6.2.Галогениды
Всоответствии с общими закономерностями фтор и хлор как сильные окислители способствуют образованию галогенидов, в которых ПЭ находятся в наиболее высоких степенях окисления. Максимальное число атомов галогенов в галогенидах ПЭ уменьшается от фторидов к иодидам, напри-
мер: OsF7, OsCl5, OsBr4, OsI3.
У низших галогенидов ПЭ (ЭХ2, ЭХ3, ЭХ4) достаточно выражен солеобразный характер, а у высших растет ковалентная составляющая связи ПЭ
сгалогеном, что обусловливает молекулярный характер галогенидов и их склонность к гидролизу.
Все ПЭ, кроме Pd, образуют гексафториды. Например, нагревание пла-
тины электрическим током в атмосфере F2 приводит к образованию PtF6, сопровождающемуся экзоэффектом. Кроме гексафторидов, существуют пента-, тетра-, три- и дифториды ПЭ. Описаны также оксофториды, напри-
мер RuOF4, OsOF5, OsO3F2, OsO2F4. В частности, оксофторид рутения образуется при обработке металлического рутения таким сильным фторирую-
щим агентом, как BrF3. Кислород при этом поступает в оксофторид рутения из стенок стеклянного или кварцевого сосуда, в котором проводится фторирование (обмен атомов О и F).
Гексафторид PtF6 – сильнейший окислитель, по-видимому, превосходящий по действию молекулярный фтор, так как связь Pt–F в PtF6 менее прочна, чем связь F–F в F2. Это делает PtF6 источником атомарного фтора, вероятно, самого сильного из существующих химических окислителей и действующего в более мягких условиях (при более низкой температуре),
чем F2 и многие другие фторокислители.
Высшие фториды ПЭ – типичные молекулярные соединения, Тпл которых уменьшается по мере роста степени окисления, что свидетельствует о нарастании ковалентного внутримолекулярного и ослаблении межмолекулярного взаимодействия.
Низшие хлориды ПЭ, как правило, имеют мостиковое строение.
37

Рис. 12. Структура дихлорида палладия, образующегося при действии Сl2 на металлический палладий [2]
Безводный PdCl2 хорошо растворим в воде и выделяется из водного раствора в виде кристаллогидрата PdCl2 · 2Н2O, имеющего мономерное строение. То же относится и к тетрахлориду PtCl4, который, гидратируясь, растворяется в воде, ацетоне и др.
В растворе PdCl2 при обычной температуре легко восстанавливается до металла, например монооксидом углерода:
PdCl2 + Н2O + СО = Pd↓ + СO2 + 2НСl.
Хлориды платины можно получить прямым синтезом: Pt + Cl2 → PtCl2,
Pt + 2Сl2 → PtCl4.
Бромиды и иодиды ПЭ, как правило, термически менее устойчивы, чем фториды и хлориды. Многие бромиды и иодиды при нагревании распадаются сразу на простые вещества. Исключением является PtI4, нагревание которого ведет к постепенному отщеплению иода.
2.6.3. Другие бинарные соединения
ПЭ, реагируя с неметаллами, образуют соответствующие бинарные соединения различного состава.
Среди халькогенидов наиболее типичны соединения типа ЭZ и ЭZ2, где
Z = S, Se, Te. Ru и Os образуют только RuZ2 и OsZ2, а Pd и Pt – моно- и ди-
халькогениды. У палладия существуют и халькогениды Pd2Z. Для Rh и Ir синтезировано больше халькогенидов, чем для Os и Ru, и меньше, чем для Pd и Pt. Ru и Os ярче проявляют сродство к кислороду, а Pd и Pt – к халькогенам. Такая закономерность обусловлена увеличением мягкости валентных электронных оболочек по мере приближения d-уровня к завершению.
Монохалькогениды ЭZ кристаллизуются в структурном типе куперита PtS, имеющем тетрагональную структуру (близкую к сфалериту), в которой каждый атом Pt образует квадрат из атомов S, а каждый атом S – тетраэдр из атомов Pt (реальные валентные углы отличаются от 90° для PtS4 и 109,5° для SPt4). Все ЭZ2, за исключением PtS2 и PdS2, которые построены по типу CdI2, кристаллизуются в структурном типе пирита.
Черно-коричневый осадок сульфида PdS выпадает при действии H2S на растворы солей Pd (II). Он не растворяется в разбавленной НСl и растворе (NH4)2S. При действии H2S на раствор H2[PtCl4] осаждается черный сульфид
38
PtS, который можно получить также нагреванием смеси очень тонких порошков простых веществ при температуре около 1000 °С. Кристаллический PtS устойчив по отношению к щелочам и кислотам, почти не растворяется даже в царской водке.
Дихалькогениды ЭZ2 получают при нагревании простых веществ. Сульфид PtS2 может быть выделен в мелкораздробленном состоянии действием H2S на раствор H2[PtCl6].
Для фосфидов характерны соединения типа ЭР3 (Rh, Pd, Ir), ЭР2 (Ru, Rh, Pd, Os, Pt), ЭР (Ru), Э2Р (Ru, Rh, lr), Э3Р (Pd, Pt), для силицидов – ЭSi2 (Os), Э2Si3 (Ru, Rh, Os, lr), ЭSi (Ru, Rh, Pd, Os, Ir, Pt), Э3Si2 (Ru, Rh, Ir), Э3Si (Pd, Pt), для боридов – Э2B5 (Ru, Os), ЭВ2 (Ru, Rh, Os, Ir), Э2B3 (Ru), ЭВ (Ru, Rh, Os, Ir, Pt), Э3B2 (Pd, Ir, Pt), Э2В (Ru, Rh). Из карбидов получены OsC и RuC. Последний – самое твердое соединение среди карбидов, образуемых элементами-металлами.
Многие бинарные соединения ПЭ являются фазами переменного состава с областями гомогенности различной протяженности.
2.7. Кислородные соединения платиновых элементов
Спецификой ПЭ является неустойчивость их гетероатомных, в частности кислородных, соединений, что обусловлено стремлением ПЭ завершить заполнение d-подуровня электронами. По этой причине ПЭ не образуют устойчивых ионных соединений, содержащих катионы Э2+, Э3+, Э4+. Образование же ковалентных связей, напротив, характерно для ПЭ, но кислород слишком электроотрицательный элемент, чтобы ПЭ могли эффективно образовать прочную ковалентную связь.
2.7.1. Оксиды
Непрочность связи Э–О делает оксиды ПЭ трудными объектами для синтеза, идентификации и исследования. Во многих случаях при синтезе образуются смеси оксидов различного состава, которые трудно разделить, очистить и охарактеризовать.
Только OsO4 бесцветен, а RuO4 окрашен в оранжевый цвет, остальные оксиды черные или черно-коричневые, что указывает на дефектность образуемой ими кристаллической структуры и нестехиометричность соединения. Установлено, что RuO2, OsO2 и IrO2 имеют структуру рутила, Rh2O3 – структуру корунда.
Главным методом синтеза оксидов ПЭ является прямое взаимодействие кислорода с соответствующим ПМ. В зависимости от температуры синтеза, давления кислорода, природы ПЭ состав оксидов изменяется. Для синтеза оксидов ПЭ используют и косвенные методы.
Хотя сведения об оксидах ПЭ неполны, все же – согласно известной
39
закономерности – устойчивость оксидов, содержащих ПЭ в высшей степени окисления, растет сверху вниз по группе, как и в случае других переходных элементов, а в низких степенях окисления – в обратном направлении. Например, у рутения термически более устойчив диоксид RuO2, а у осмия тетраоксид OsO4, высшие оксиды иридия и платины ЭO2 более устойчивы, чем низшие (Ir2O3 и PtO), а у родия и палладия, напротив, более устойчивы низшие оксиды (Rh2O3 и PdO).
При нагревании оксидов, как правило, происходит постепенное отщепление кислорода и последующее разложение на простые вещества. С этой реакцией конкурирует процесс диспропорционирования, при котором низший оксид переходит в высший и выделяется «лишний» металл. Это характерно, например, для рутения. При температуре выше 1300 °С происходит диспропорционирование низшего оксида:
2RuO2 = RuO4 + Ru.
Образовавшийся при этом тетраоксид рутения в результате дальнейшего нагревания разлагается на простые вещества:
RuO4 = Ru + 2O2.
Под действием водорода оксиды ПЭ восстанавливаются до металла, проявляя тем самым окислительные свойства. Так, RuO4 реагирует с разбавленной соляной кислотой, образуя RuCl3, а на OsO4 действует только концентрированная соляная кислота:
2RuO4 + 16НСl = 2RuCl3 + 5Сl2↑ + 8Н2O, OsO4 + 8НСlконц = OsCl4 + 2Cl2↑ + 4Н2O.
Тетраоксид осмия OsO4 медленно восстанавливается спиртом, a RuO4 взаимодействует со спиртом со взрывом. Оксид осмия (VIII) используется как окислитель в органическом синтезе.
Ru и Os при нагревании в атмосфере кислорода проявляют максимальную для элементов ПС степень окисления +8, образуя летучие оксиды RuO4 и OsO4, молекулы которых имеют тетраэдрическое строение (на воздухе образуются RuO2 и OsO4). Наиболее устойчивый для рутения оксид RuO2 образуется при окислении металла кислородом при более низкой температуре, чем RuO4.
Оксид осмия OsO2 образуется при осторожном восстановлении OsO4 водородом при комнатной температуре или металлом.
При нагревании на воздухе родия или его нитрата Rh(NO3)3 можно получить темно-серый оксид родия (III) Rh2O3, изоструктурный корунду и нерастворимый в кислотах и щелочах. Мелкодисперсный иридий реагирует с кислородом при температуре > 1000 °С, образуя черный оксид иридия (IV) IrO2, который при более высокой температуре диссоциирует на простые вещества. Оксид IrO2 относится к структурному типу рутила, растворяется в НСl. Оксид иридия (III) Ir2O3 при нагревании диспропорционирует на металл и IrO2.
40
