
8 группа
.pdf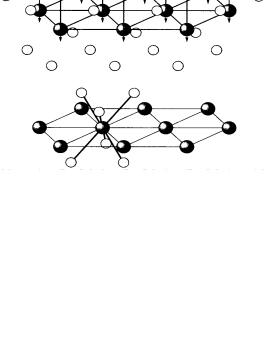
При нагревании до 390–900 °С оксид кобальта (II) превращается в Со3O4, который при 905–925 °С теряет часть кислорода и переходит опять в СоО:
6СоО + O2 ↔ 2Со3O4.
Оксиды кобальта (II) и никеля (II) получают термическим разложением солей кобальта и никеля, образованных летучими кислотами (в отсутствие воздуха):
ЭСO3 → ЭO + CO2,
2Э(NO3)2 · 6Н2O → 2ЭО + 4NO2 + O2 + 12Н2O.
Гидроксиды Э(ОН)2 можно получить только косвенным путем, так как оксиды ЭО не растворяются в воде. Например, гидратированные гидроксиды Э(ОН)2 · nH2O образуются при взаимодействии растворов солей Э (II) со
щелочами:
Э2+ + 2OН– = Э(ОН)2↓.
Гидроксиды Э(ОН)2 кристаллизуются в структурном типе CdI2. Гидроксид железа (II) (рис. 8) – соединение белого цвета, на воздухе бы-
стро изменяет окраску, превращаясь вследствие окисления сначала в синезеленый смешанно-валентный гидратированный оксид примерного состава Fe3O4 · nН2O, азатемвчастичнообезвоженныйгидроксидFe (III) бурогоцвета:
4Fe(OH)2 + O2 + 2Н2O = 4Fe(OH)3.
Будучи основанием средней силы и средней растворимости, гидроксид железа (II) растворяется не только в кислотах, но и в концентрированных растворах солей аммония, как и Mg(OH)2.
Около 150 °С гидроксид железа (II) разлагается: 3Fe(OH)2 = Fe3O4 + Н2 + 2Н2O.
Рис. 8. Строение гидроксида железа (II) (структурный тип CdI2) [1]
21
Гидроксид кобальта (II) – вещество розово-красного цвета. При его получении действием щелочи на розовато-малиновый водный раствор соли кобальта сначала образуется осадок малорастворимых основных солей Со(ОН)nХ2–n · mН2O синего цвета, характерного для кобальта (II) в тетраэдрическом окружении, затем переходящий в розовый гидроксид Со(ОН)2 (розовая окраска свойственна соединениям Со (II), имеющим октаэдрическую симметрию). Образовавшийся гидроксид медленно окисляется кислородом воздуха, изменяя окраску до коричневой:
4Со(ОН)2 + O2 + 2Н2O = 4Со(ОН)3.
Появление синего окрашивания при первоначальном добавлении щелочи к соли кобальта можно объяснить не только образованием основных солей, но и гидроксида кобальта состава 3Со(ОН)2 · 2Н2O, который при дальнейшем добавлении щелочи претерпевает структурную перестройку вследствие дегидратации и старения, меняя при этом окраску от синей до розовой.
Со(ОН)2 растворим как в кислотах – с образованием солей Со (II), так и в концентрированных растворах щелочей и аммиака, т. е. является амфотерным соединением. При избытке щелочи в растворе образуются синий гидроксокомплекс [Со(ОН)4]2– тетраэдрического строения, при избытке аммиа-
ка – аммиачный комплекс [Co(NH3)6]2+, легко окисляющийся на воздухе до
[Co(NH3)6]3+.
Синюю окраску имеют растворы, полученные при добавлении концентрированной соляной кислоты к хлориду кобальта. При этом образуется хлоридный комплекс тетраэдрической симметрии [СоСl4]2–:
СоСl2 + 2НСl = Н2[СоСl4].
Со(ОН)2 разлагается при нагревании в вакууме (168 °С) с образованием СоО и Н2O.
Гидроксид никеля (II) яблочно-зеленого цвета получают действием щелочи на водные растворы солей никеля (II). При этом образуется осадок гидрата гидроксида никеля Ni(OH)2 · 2Н2O, который обезвоживается при нагревании до 200 °С. Как в случае кобальта, можно выделить в твердом виде гидрат 3Ni(OH)2 · 2Н2O. Гидроксид Ni(OH)2 не окисляется кислородом воздуха, практически не растворяется в щелочах, но под действием кислот образует соли Ni (II), а в концентрированном растворе аммиака – аммиачные комплексы [Ni(NH3)6]2+. При 230 °С гидроксид никеля дегидратируется, переходя в NiO.
Значения произведений растворимости и констант диссоциации (по основному типу) убывают от Fe к Ni, что может быть связано с некоторым уменьшением радиусов ионов Э2+ в этом ряду.
При хранении гидроксидов их растворимость уменьшается из-за старения вследствие оляции и оксоляции.
Восстановительные свойства становятся менее выраженными при переходе от Fe(OH)2 к Ni(OH)2. Так, на воздухе Fe(OH)2 окисляется практиче-
22
ски мгновенно, а Со(ОН)2 – лишь медленно, в то время как Ni(OH)2 в тех же условиях остается неизменным. Гидроксид Со(ОН)2 легко окисляется пероксидом водорода:
2Со(ОН)2 + Н2O2 = 2Со(ОН)3.
В то же время Ni(OH)2 можно окислить лишь более сильными окислителями в сильнощелочной среде, например бромат-ионами (бромом в щелочной среде):
6Ni(OH)2 + NaBrO3 + 3H2O = 6Ni(OH)3 + NaBr.
2.3.2. Степень окисления +3
Оксид железа (III) Fe2O3 – красно-коричневое кристаллическое вещество, существующее в нескольких полиморфных модификациях.
При атмосферном давлении Fe2O3 устойчив до 1455 °С, при более высокой температуре он теряет часть кислорода и переходит в Fe3O4:
6Fe2O3 = 4Fe3O4 + O2.
Расплавить Fe2O3 без разложения (1562 °С) можно только при повышенном давлении кислорода.
При нагревании Fe2O3 восстанавливается водородом или оксидом угле-
рода (II):
Fe2O3 + Н2 = 2FeO + Н2O, Fe2O3 + СО = 2FeO + СO2.
В воде оксид железа (III) нерастворим, но растворяется в кислотах и проявляет амфотерные свойства, образуя при сплавлении со щелочами или карбонатами ЩЭ ферраты (III):
Fe2O3 + 2NaOH = 2NaFeO2 + Н2O,
Fe2O3 + Na2CO3 = 2NaFeO2 + CO2.
При взаимодействии Fe2O3 с оксидами элементов-металлов также получаются ферриты. Это большая группа соединений: шпинели MFe2O4, где М = Fe, Со, Ni, Mg, Mn, Сu; гранаты M3Fe5O12, где М = некоторые РЗЭ; ортоферриты MFeO3, где М = РЗЭ; гексаферриты, например ВаО · 6Fe2O3. В промышленности ферриты получают спеканием при высокой температуре оксидов, карбонатов, сухих остатков совместно упаренных растворов двух солей (нитратов, сульфатов) или совместно осажденных гидроксидов, оксалатов или карбонатов.
Смешанно-валентный оксид железа (II, III) Fe3O4 известен под на-
званием «магнетит» – черное кристаллическое вещество.
Магнетит имеет структуру обращенной шпинели FeIII[FeIIFeIII]O4: половина катионов Fe3+ занимает тетраэдрические пустоты в кубической плотнейшей упаковке ионов O2–, а равные количества катионов Fe2+ и Fe3+ располагаются в октаэдрических пустотах.
Fe3O4 не растворяется в воде, кислотах и щелочах. При нагревании может быть окислен до Fe2O3 и восстановлен до FeO:
23
4Fe3O4 + O2 → 6Fe2O3,
Fe3O4 + Н2 → 3FeO + Н2O.
Магнетит Fe3O4 образуется при прокаливании Fe2O3 до t > 1400 °С или выдерживании при 250 °С в вакууме. Кроме этого, Fe3O4 получают действием водорода на Fe2O3 при 400 °С.
Гидроксид железа (III) Fe(OH)3 – бурое аморфное вещество; образу-
ется при действии щелочей на растворы солей железа (III): Fe3+ + 3ОН– = Fe(OH)3↓.
Суждения о том, существуют ли гидроксид железа (III) в форме Fe(OH)3 или в виде Fe2O3 · nН2O, противоречивы. По-видимому, чрезвычай-
но низкая растворимость (ПРFe(OH)3 = 6 · 10–39) гидроксида железа (III), связана с быстро протекающей полимеризацией nFe(OH)3 → [Fe(OH)3]n и с одно-
временным обезвоживанием из-за превращения оловых мостиков в оксоловые.
Гидроксид железа (III) – амфотерное вещество с преобладанием основных свойств, легко растворяющееся в кислотах с образованием солей Fe (III) и плохо растворимое даже в горячих концентрированных растворах щелочей с образованием гидроксоферратов (III) различного состава, напри-
мер, Na4[Fe(OH)7] · 2Н2O и Na5[Fe(OH)8] · 5Н2O, выделенных в кристалли-
ческом состоянии.
Существование оксида кобальта (III) Со2O3 (коричневого цвета) в некоторых источниках ставится под сомнение. Более устойчивым считается его нерастворимый в воде гидрат Со(ОН)3, или Со2O3 · 3Н2O, частично теряющий при 100 °С воду и переходящий в СоО(ОН) – коричневое вещество, при температуре >150 °С превращающееся в Со3O4:
12СоО(ОН) = 4Со3O4 + O2 + 6Н2O.
Смешанно-валентный оксид кобальта (II, III) Со3O4 – вещество се-
ро-черного цвета, имеет структуру нормальной шпинели: СоII[Со2III]O4. Оксид Со3O4 и гидроксид Со(ОН)3 проявляют окислительные свойства,
выделяя кислород в отсутствие способных окисляться веществ:
2Со3O4 + 6H2SO4 = 6CoSO4 + O2↑ + 6Н2O, 2Со3O4 + 12HNO3 = 6Co(NO3)2 + O2↑ + 6Н2O, Со3O4 + 8НСl = 3СоСl2 + С12↑ + 4Н2O.
Образование гидроксида никеля (III) Ni(OH)3, или Ni2O3 · nН2O, происходит при окислении гидроксида никеля (II) в щелочной среде сильными окислителями. Это нерастворимое соединение черного цвета, которое, теряя воду, переходит в оксид-гидроксид NiO(OH). При нагревании, отщепляя кислород, NiO(OH) превращается в смешанно-валентный оксид-гидроксид никеля (II, III) состава Ni2O2(OH).
Как и в случае Со2O3, литературные данные о существовании оксида никеля (III) противоречивы.
Гидроксид никеля (III) является очень сильным окислителем:
24
4Ni(OH)3 + 4H2SO4 = 4NiSO4 + O2↑ + 10Н2O,
4Ni(OH)3 + 8HNO3 = 4Ni(NO3)2 + O2↑ + 10H2O,
2Ni(OH)3 + 6HCl = 2NiCl2 + Cl2↑ + 6H2O.
2.3.3. Другие степени окисления
Для железа характерна степень окисления +6, которую оно проявляет в ферратах (VI) состава (MI)2FeO4 и (MII)FeO4. Существует несколько способов получения ферратов (VI), например прокаливанием твердых реагентов:
Fe2O3 + 3KNO3 + 4КОН → 2K2FeO4 + 3KNO2 + 2Н2O.
Ферраты (VI) проявляют свойства сильных окислителей. Для пары FeVI/FeIII значение Е0 = 2,1 В. Особенно неустойчивы соединения железа (VI) в кислой среде:
4K2FeO4 + 10H2SO4 = 2Fe2(SO4)3 + 3O2↑ + 4K2SO4 + 10H2O, 2K2FeO4 + 16HCl = 2FeCl3 + 3Cl2↑ + 4KCl + 8H2O,
2K2FeO4 + 2NH3 + 2H2O = 2Fe(OH)3↓ + N2↑ + 4KOH, 2K2FeO4 + 3H2S + 2H2O = 2Fe(OH)3↓ + 3S↓ + 4KOH.
Кроме ферратов (VI) существуют очень неустойчивые ферраты (IV)
состава (MII)FeO3, Na4FeO4, (MII)2FeO4, Ba3FeO5 и ферраты (V) – (MI)3FeO4. Феррат (IV) состава Ba2FeO4 изоструктурен Ba2TiO4, атом железа (IV) в нем имеет тетраэдрическую координацию.
В последнее время удалось доказать существование производных железа (VIII), а именно FeO4, аналогичного OsO4. Оксид FeO4 удалось получить по реакции диспропорционирования в сильнощелочных растворах при
нагревании:
2FeVI = FeIV + FeVIII.
Из неустойчивых соединений кобальта и никеля в степенях окисления
+4 получены кобальтаты (IV) состава (MI)4СоO4, Ва2СоO4, ВаСоO3 и ни-
келаты (IV) состава (MI)2NiO3 и BaNiO3.
Устойчивость элементов триады железа в высоких степенях окисления уменьшается от Fe к Ni, причем окислительная способность их очень высока.
Обсуждая свойства гидратов оксидов Fe, Со, Ni, следует отметить увеличение устойчивости к отщеплению воды и ослабление основных свойств при повышении степени окисления. Например, Fe(OH)2 проявляет более основные свойства, чем Fe(OH)3, a H2FeO4 является кислотой, что объясняется усилением ковалентного характера связи железа с кислородом в гидратах оксидов. При понижении степени окисления окислительные свойства гидратов оксидов ослабевают. Так, если для H2FeO4 характерны только окислительные свойства, то для Fe(OH)3 – и окислительные, и восстановительные, а для Fe(OH)2 – практически только восстановительные свойства. Аналогичные закономерности характерны для оксидов и гидроксидов кобальта и
25
никеля, хотя спектр валентных состояний у этих элементов более узкий, чем у железа.
2.3.4. Соли кислородсодержащих кислот
Элементы триады железа образуют соли со всеми известными оксокислотами.
Соли железа (III), кобальта (II) и никеля (II) достаточно устойчивы в окислительно-восстановительном отношении, тогда как соли железа (II) проявляют восстановительные свойства, например:
4FeSO4 + O2 + 2H2SO4 = 2Fe2(SO4)3 + 2Н2O.
Поскольку гидроксиды Э(ОН)2 и Э(ОН)3 не являются сильными основаниями, то соответствующие им соли подвергаются гидролизу. При этом соли Fe (III) гидролизуются в гораздо большей степени, чем соли Fe (II).
Вследствие гидролиза водные растворы солей Fe (III) имеют сильнокислую реакцию; в зависимости от концентрации их pH составляет ~2–3.
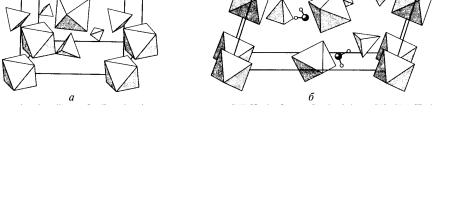
Сульфаты ЭSO4 (бесцветный FeSO4, розовый CoSO4 и желтый NiSO4) хорошо растворяются в воде, образуют несколько кристаллогидратов, из которых наиболее известны «купоросы» (голубовато-зеленый FeSO4 · 7H2O, карминово-красный CoSO4 · 7H7O и темно-зеленый NiSO4 · 7Н2O). На рис. 9 приведено строение сульфатов железа.
Рис. 9. Строение сульфатов железа (II):
а– соль Мора, б – железный купорос [1]
Вэтих кристаллогидратах координационный полиэдр катиона Э2+
представляет собой октаэдр, состоящий из атомов кислорода шести молекул воды; седьмая молекула воды не связана с Э2+. Эту внешнесферную молекулу воды окружают три молекулы внутрисферной воды из [Э(Н2O)6]2+ и один атом кислорода сульфат-иона, поэтому строение «купоросов» отражает
формула [Э(Н2O)6]Н2O · SO4.
Безводные сульфаты разлагаются при температуре выше 640 °С. Так, распад FeSO4 идет при 700 °С в соответствии с уравнением
2FeSO4 = Fe2O3 + SO2 + SO3.
26
С сульфатами ЩЭ и аммония ЭSO4 образуют двойные соли (MI)2Э(SO4)2 · 6Н2O, в частности наиболее устойчивую на воздухе из солей железа (II) соль Мора (NH4)2Fe(SO4)2 · 6Н2O. Ее используют в аналитической химии для приготовления стандартных растворов Fe (II), например в перманганатометрии:
10FeSO4 + 2КМnO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O.
Бесцветный безводный сульфат железа (III) Fe2(SO4)3 образует кристаллогидраты Fe2(SO4)3 · 10Н2O и Fe2(SO4)3 · 9Н2O (желтого цвета). Безводная соль выше 600 °С разлагается с выделением SO3, что использовали в прежние времена для получения концентрированной серной кислоты («купоросного масла»).
Сульфат железа (III) проявляет окислительные свойства, например по отношению к иодид- и сульфид-ионам:
Fe2(SO4)3 + 6KI = 2FeI2 + I2↓ + 3K2SO4,
Fe2(SO4)3 + H2S = 2FeSO4 + S↓ + H2SO4.
С сульфатами ЩЭ и аммония он образует двойные соли типа квасцов
MIFe(SO4)2 · 12Н2O.
Кобальт (III) образует кристаллический гидратированный сульфат Co2(SO4)3 · 18Н2O, который получают путем окисления (электролиз, действие F2 и т. д.) раствора сульфата Со (II) в 8 н H2SO4 при 0 °С. Повышение содержания воды в сульфатной системе приводит к восстановлению Со (III) водой с выделением кислорода:
2Co2(SO4)3 + 2Н2O = 4CoSO4 + 2H2SO4 + O2↑.
В то же время в твердом состоянии Co2(SO4)3 · 18Н2O вполне стабилен. Для Со (III) известны также квасцы (MI)Co(SO4)2 · 12Н2O. Это темноголубые вещества с диамагнитными свойствами. При растворении в воде
Со (III) немедленно восстанавливается до Со (II). Сульфат никеля (III) не описан.
Нитраты Э(NO3)2 – хорошо растворимые в воде соединения, выделяются из растворов в виде гексагидратов зеленого (Fe, Ni) или красного (Со) цвета. Растворы Э(NO3)2 получают на холоду действием разбавленной HNO3 на соответствующие металлы, оксиды, гидроксиды или карбонаты.
Безводные нитраты известны только для Со (II) и Ni (II). Это нелетучие соединения, окрашенные в бледно-пурпурный (Со) или бледно-зеленый (Ni) цвет. Их можно синтезировать взаимодействием N2O5 с раствором кристаллогидратов в азотной кислоте.
Нитрат железа (III) получают растворением металла в 20–30% азотной кислоте. Fe(NO3)3 выделяется из раствора в виде кристаллогидратов с шестью или девятью молекулами воды. Растворы нитрата железа (III) окрашены в бурый цвет вследствие гидролиза.
Нитрат кобальта (III) образуется при взаимодействии фторида кобальта (III) с N2O5 при комнатной температуре:
27
CoF3 + 3N2O5 = Co(NO3)3 + 3NO2F↑.
Нитрат никеля (III) не описан.
Среди хорошо растворимых в воде солей, образуемых элементами триады железа, следует отметить роданиды, которые выделяются из растворов в виде зеленого Fe(NCS)2 · 3Н2O, фиолетового Co(NCS)2 · 3Н2O, желтого Ni(NCS)2 · 0,5Н2O и кроваво-красного Fe(NCS)3 · 3Н2O.
Карбонаты ЭСO3 практически нерастворимы в воде. При нагревании до 400 °С происходит их термическое разложение:
3FeCO3 = Fe3O4 + 2СО↑ + СО.
FeCO3 выпадает в виде белого осадка при действии на растворы солей Fe (II) карбонатов ЩЭ:
FeSO4 + Na2CO3 = FeCO3↓ + Na2SO4.
Во влажном состоянии осадок быстро зеленеет, а затем буреет на воздухе вследствие окисления и гидролиза с образованием Fe(OH)3. Карбонат железа (II) заметно растворяется в воде, содержащей СO2, с образованием существующего только в растворе гидрокарбоната Fe(HCO3)2.
Гидроксиды кобальта (II) и никеля (II) проявляют менее основные свойства, чем гидроксид железа (II), поэтому при действии на соли Со (II) и Ni (II) карбонатов ЩЭ в осадок выпадают не средние, а основные карбонаты xЭСO3 · yЭ(ОН)2 · zН2O, состав которых зависит от порядка смешения реагентов, концентрации растворов и даже скорости перемешивания и времени установления равновесия.
Средние карбонаты кобальта (II) и никеля (II) можно получить в менее щелочной среде – они осаждаются при действии гидрокарбонатов ЩЭ:
CoSO4 + NaHCO3 + 6Н2O = СоСO3 · 6H2O↓ + NaHSO4.
Карбонаты железа (III), кобальта (III) и никеля (III) не существуют изза окислительно-восстановительной и гидролитической нестабильности.
Среди других плохо растворимых солей, образуемых элементами триады железа, надо отметить различного состава фосфаты, причем средние соли наименее растворимы. Также малорастворимы оксалаты, которые выделяются в виде кристаллогидратов ЭС2O4 · 2Н2O и Fe2(C2O4)3 · 5Н2O.
2.3.5. Халькогениды
ЭZ и ЭZ2, где Z = S, Se, Te, представляют собой фазы переменного состава, причем область гомогенности у фаз ЭZ шире, чем у ЭZ2. Состав и свойства халькогенидов сильно зависят от условий получения.
Структура пирита FeS2 геометрически подобна структуре NaCl: центры групп S2 и атомы Fe занимают соответственно позиции Na+ и Сl–. Каждый атом железа расположен в центре октаэдра из шести атомов серы, а координация последней тетраэдрическая (один атом S и три атома Fe). В ряду FeS2 – NiS2 уменьшается расстояние S–S и увеличивается расстояние Э–S.
28
Халькогениды образуются при взаимодействии металлических железа, кобальта и никеля с халькогенами при нагревании. Моносульфиды можно получить и в растворах солей Э (II) – действием сульфида аммония.
При этом образуются черные осадки ЭS, малорастворимые в воде. Свежеосажденные сульфиды ЭS (ПР > 10–24) растворяются в разбавленных кислотах НСl и H2SO4, переходя соответственно в хлориды и сульфаты Э (II), например:
3S + H2SO4 = ЭSO4 + H2S↑.
При длительном контакте с маточным раствором происходит перестройка сульфидов кобальта и никеля в менее растворимые модификации, которые растворяются уже только в кислотах-окислителях, например:
3ЭS + 8HNO3 = 3Э(NO3)2 + 3S↓ + 2NO↓ + 4Н2O.
Кислородом воздуха влажный сульфид железа (II) окисляется до FeSO4 – окисляется сульфидная сера, а не железо (II).
При барботировании H2S через раствор солей железа (III) происходит окислительно-восстановительное взаимодействие:
2FeCl3 + H2S = 2FeCl2 + S↓ + 2НСl.
Сульфид аммония осаждает из растворов солей железа (III) сульфид FeS (тоже в результате окислительно-восстановительной реакции):
2FeCl3 + 3(NH4)2S = 2FeS↓ + S↓ + 6NH4Cl.
Известны сульфиды элементов триады железа и другого состава (Э3S4,
Fe2S3 и др.).
Для железа, кобальта и никеля получены нитриды, фосфиды, арсениды и антимониды с соотношением компонентов в них от 3 : 1 до 1 : 3. Они склонны к термической диссоциации с отщеплением атомов неметалла, например:
4Fe2N → 2Fe4N + N2.
Нитрид Fe2N получают взаимодействием при нагревании свежевосстановленного железа с газообразным аммиаком:
4Fe + 2NH3 = 2Fe2N + 3Н2.
2.4. Комплексные соединения элементов триады железа
Железо, кобальт, никель, будучи переходными элементами, являются типичными комплексообразователями. Комплексообразование стабилизирует соединения в малоустойчивых степенях окисления (+2 для железа, +3 для кобальта и никеля).
2.4.1. Степень окисления +2
Для комплексов с Э (II) характерны, как правило, координационные числа 4 и 6. При КЧ = 6 координационным полиэдром является октаэдр или тетрагональная бипирамида (искаженный октаэдр).
29
Железо (II) образует соли практически со всеми обычными анионами. Их обычно получают в водном растворе либо из металла, либо восстановлением соответствующей соли Fe (III). В отсутствие других лигандов эти растворы содержат бледно-зеленый ион [Fe(H2O)6]2+, который также присутствует в твердых веществах, таких как Fe(ClO4)2 · 6Н2O, FeSO4 · 7Н2O и хорошо известная «соль Мора» (NH4)2SO4FeSO4 · 6Н2O. Склонность Fe (II) к окислению зависит от природы присоединенных лигандов и в водных растворах от pH. Так, твердый гидроксид и щелочные растворы очень легко окисляются, в то время как кислые растворы гораздо более устойчивы.
Комплексы Fe (II) обычно менее устойчивы, чем комплексы Fe (III), однако у Fe (II) в меньшей степени выражена несовместимость с N-донорными лигандами. Так, [Fe(NH3)6]2+ известен, а его аналог с Fe (III) – нет; с другой стороны, у Fe (II) меньше комплексов с О-донорными лигандами, такими как ацетилацетонат и оксалат, и они менее устойчивы, чем у Fe (III).
Большинство комплексов Fe (II) октаэдрические, хотя известны и другие варианты геометрии. Ионы [FeX4]2– (X = Cl, Br, I, NCS) тетраэдрические.
Хорошо известны гексацианоферраты (II), содержащие октаэдрический анион [Fe(CN)6]4–, в том числе желтая кровяная соль K4[Fe(CN)6] · 3Н2O и гексацианожелезная (II) кислота H4[Fe(CN)6].
Желтая кровяная соль K4[Fe(CN)6] · 3Н2O – хорошо растворимое в воде желтое кристаллическое вещество, разлагающееся при прокаливании.
K4[Fe(CN)6] = 4KCN + FeC2 + N2↑.
Гексацианожелезная (II) кислота H4[Fe(CN)6] – бесцветное кристалли-
ческое вещество, в водном растворе проявляющее свойства достаточно сильной кислоты: К3 ≈ 10–2 , К4 ≈ 10–4.
Анион [Fe(CN)6]4– с различными катионами образует малорастворимые соединения, например Ba2[Fe(CN)6], K2Ca[Fe(CN)6] и др. В растворах при взаимодействии с ионами Fe2+ выпадает белый осадок K2Fe[Fe(CN)6], с ионами Fe3+ – синий осадок «берлинской лазури». Под действием окислителей желтая кровяная соль превращается в красную кровяную соль K3[Fe(CN)6]:
2K4[Fe(CN)6] + Cl2 = 2K3[Fe(CN)6] + 2КСl.
Кобальт (II) образует простые соли со всеми обычными анионами. В виде гидратов их легко получают из водных растворов.
В водных растворах, содержащих ионы [Со(Н2O)6]2+, в равновесии присутствует также небольшое количество тетраэдрических [Со(Н2O)4]2+, а в уксусной кислоте встречается тетраэдрический [Со(O2СМе)4]2–. Анионные комплексы [СоХ4]2– образуются с монодентатными лигандами (Х = Сl, Вr, I, SCN и ОН). Получен целый ряд комплексов [CoL2X2] (L – лиганд с донорным атомом из 15-й группы; X = Hal, NCS), в которых были найдены оба варианта координационной геометрии. Важным фактором, определяющим геометрию, является поляризуемость лиганда: более поляризуемые лиганды
30
