
- •Введение
- •Хроматография. Общая информация
- •Тонкослойная хроматография. Достоинства и недостатки
- •Достоинства метода тонкослойной хроматографии
- •Недостатки метода тонкослойной хроматографии
- •Тсх и вэжх – конкуренты или соратники?
- •Эффективность разделения.
- •Количественное определение.
- •Качественный анализ
- •Хроматографическая подвижность веществ
- •Общие теоретические закономерности
- •Влияиние стркуктуры вещества на его хроматографические свойства
- •Техника тсх
- •Основные “участники” хроматографического процесса
- •Подложка
- •Сорбент
- •Растворители в тсх
- •Камеры для тсх
- •Методы нанесения пробы анализируемого вещества на пластинку
- •Методы проявления
- •Практика тсх
- •Формирование тонкого слоя
- •Незакрепленный слой и его особенности
- •Техника нанесения
- •Нанесение образца
- •Особенности качественного и количественного тсх-анализа
- •Качественный анализ
- •Количественный анализ
- •Ошибки и проблемы в тонкослойной хроматографии
- •“Ложно-отрицательные” ошибки в тсх
- •“Ложно-положительные” ошибки в тсх
- •Ошибки, связанные с каталитическими свойствами сорбентов
- •Тезаурус
- •Где об этом прочитать
- •Предметный указатель Список рекомендуемой литературы Справочные материалы
Хроматографическая подвижность веществ
Общие теоретические закономерности
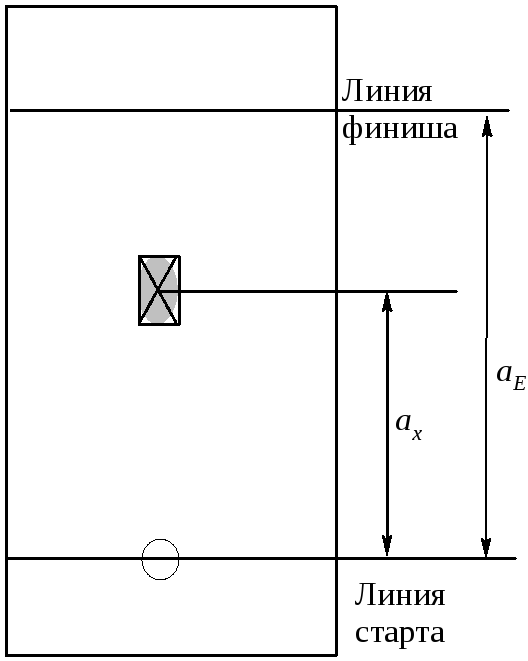
Основной характеристикой хроматографической подвижности вещества, используемой в ТСХ, является величина Rf, характеризующая подвижность вещества относительно подвижности элюентав данных условиях проведения анализа. Определяется эта величина (уравнение 1 .1), как отношение расстояния, пройденного пятном вещества от линии старта (ax) к расстоянию между линией старта и линией финиша (aE). Метод определения этих величин представлен на рисунке 3 .1
|
|
( |
1.1 |
) |
|
Рисунок |
3.1 |
– Определение хроматографической подвижности вещества |
Если величина aEпроизвольно задается условиями проведения анализа, то величинаaxзависит от большого количества факторов, значения которых в большинстве случаев контролировать сложно, поэтому для надежной характеристики подвижности вещества, воспроизводимой от эксперимента к эксперименту вне зависимости от условий, лаборатории и времени проведения анализа следует пользоваться величиной, характеризующей подвижность изучаемого вещества относительно подвижности стандартного вещества в этих условиях –RS(уравнение 1 .2).
|
|
( |
1.2 |
) |
где Rf(X) иRf(S) – хроматографическая подвижность изучаемого и стандартного веществ, соответственно.
К сожалению, до настоящего времени нет общепринятого набора стандартов, позволяющего “привязать” большинство органических веществ.
Для описания способности вещества адсорбироваться на неподвижной фазе в хроматографии часто используетсявеличинаk'–коэффициент удержания– отношение количества вещества в подвижной фазе к его количеству в неподвижной, рассчитываемый в ТСХ по формуле 1 .3
|
|
( |
1.3 |
) |
Однако, гораздо удобнее использовать величину, обратную k', которую часто обозначают как Rm(уравнение 1 .4):
|
|
( |
1.4 |
) |
Предпочтительность такого описания связана с тем, что величина Rmсимбатна величинеRf(Rmизменяется в том же направлении, что иRf). Еще одним достоинством этой величины является то, что она в отличии отRfаддитивна по струкутрным фрагментам веществаи позволяет априорно приблизительно оценивать хроматографические свойства вещества в ряду однотипных.
Следует иметь в виду, что сказанное выше имеет смысл только в том случае, если вещество наносится на пластинку в минимальных количества – его должно быть не больше, чем может быть растворено в том количестве элеюнта, которое находится в объеме “над пятном” и так мало, чтобы на сорбенте “в пятне” степень заполнения центров адсорбции данным веществом стремилась к 0 (была как можно меньше). Критерием выбора количества наносимого вещества для этих целей должен служить предел обнаружения.
Другими словами эти (и последующие) соображения справедливы, только тогда, когда элюция проводится в условиях ненасыщенности сорбента сорбатом, и, следовательно, величинаRf численно равна степени десорбции вещества с сорбента в элюент.
Если кроме равновесия
![]()
одновременно имеет место ассоциация вещества в супрамолекулярные комплексы
![]()
или его кристаллизация
![]() ,
,
то наблюдаемое значение Rfбудет отличаться от “истинного”, т.е. будет характеризовать не свойства вещества, а особенности процесса.
Исходя из основных законов адсорбции и расматривая хроматографический процесс как дискретный (непрерывный поток элюента можно с определенной долей надежности описать как набор большого количества циклов – бесконечно быстрый скачок элюента на расстояние одной “зоны” и установление в течение определенного интервала времени равновесия между подвижной и неподвижной фазами), можно вывести уравнение 1 .5 (его вывод являтся несложным, но громоздким, в связи с чем здесь мы его пропустим; при выводе используется допущение о том, что вся поверхность сорбента однородна1и полностью насыщена элюентом), описывающегоRfвещества как функцию от способности вещества и элюента к адорбции на сорбенте (XиS, соответственно), состояние поверхности которого можно описать эмпирическим безразмерным параметром.
|
|
( |
1.5 |
) |
Зная Rfвещества на сорбенте
с параметромв
одном элюенте (![]() ),
можно рассчитать его способность к
адсорбцииX,
а затем –Rfв любом другом
элюенте (
),
можно рассчитать его способность к
адсорбцииX,
а затем –Rfв любом другом
элюенте (![]() )
на том же сорбенте (=const). Для многих растворителей
значенияSизвестны (см. ниже – раздел 4.1.3).
)
на том же сорбенте (=const). Для многих растворителей
значенияSизвестны (см. ниже – раздел 4.1.3).
При желании можно вывести свой собственный ряд элюотропных параметров растворителей ('S). Для этого выбирают некоторую группу веществ и некоторый набор растворителей. Для произвольного из выбранных веществ полагаютX = 1, аполагают равной 1 (вообще говоря, можно задать любые действительные числа). Тогда, получив из результатов хроматографического эксперимента величинуRf, можно рассчитать величину'S для использованного растворителя. Для остальных отобранных веществ значенияXрассчитывают из их величинRf, полученных на том же сорбенте (= 1) в том же растворителе. Далее, проводя элюцию этого набора веществ на том же сорбенте с использованием в качестве элюентов остальных растворителей можно рассчитать параметры'Sэтих растворителей.
Иллюстрацией эффективности такого подхода могут служить результаты изучения подвижности 2,7-диалкоксифлуоренонов на пластинках Silufol в малополярных элюентах.
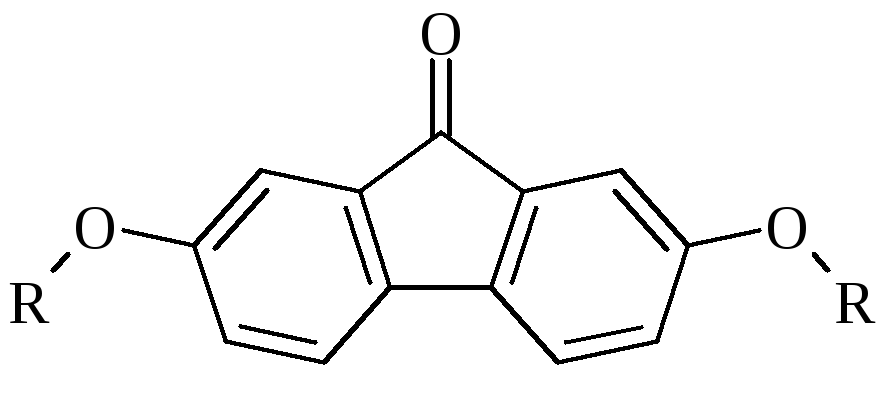 R
= CnH2n+1; n = 1, 2, 3, 4, 5, 6, 7, 8, 9, 11,
12.
R
= CnH2n+1; n = 1, 2, 3, 4, 5, 6, 7, 8, 9, 11,
12.
Для этих веществ были получены значения Rfв четыреххлористом углероде, хлороформе, хлористом метилене, бензоле, ксилоле, хлорбензоле,и смесях этих растворителей. Полученные значения приведены отображены на рисунке 3 .2.
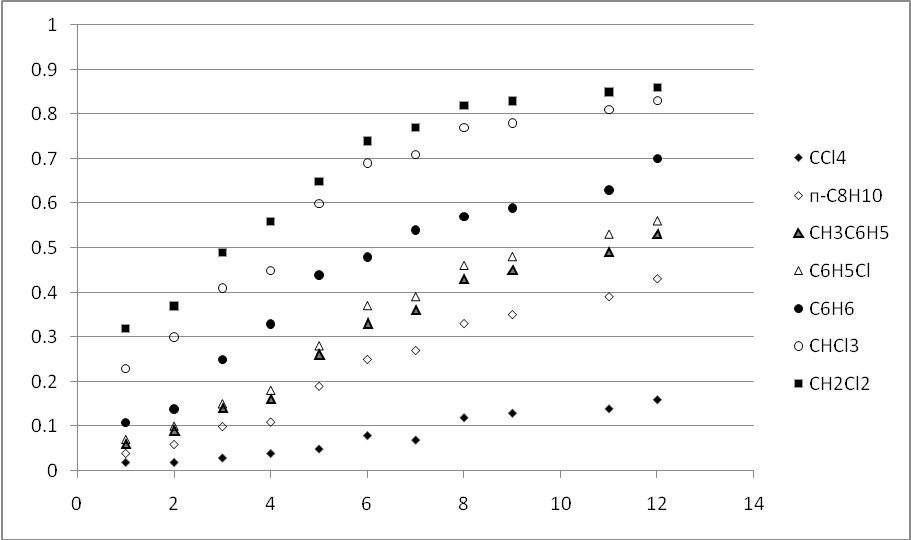
|
Рисунок |
3.2 |
– Значения Rf для 2,7-диалкоксифлуоренонов на пластинках |
Silufol UV-254 в различных элюентах. На линию старта пластинок наносили по (8–10) 10-9моль (2–5g) вещества в 5l раствора в четыреххлористом углероде.
