
- •Предисловие
- •Введение
- •Спектральные методы.
- •Почему вещество способно поглощать электромагнитное излучение
- •Частота, длина волны и энергия электромагнитных колебаний
- •Спектральные диапазоны
- •Ультрафиолетовая спектроскопия.
- •Закон Бугера – Ламберта – Бера.
- •Инфракрасная спектроскопия и спектроскопия комбинационного рассеяния
- •Спектроскопия ядерного магнитного резонанса
- •Масс-спектрометрия
- •Хроматография
- •Газовая хроматография (гх и гжх)
- •Формальные аспекты газовой хроматографии
- •Составные части газового хроматографа
- •Газы, применяемые в хроматографии
- •Ввод пробы
- •Колонки,применяемые в газовой хроматографии
- •Неподвижная фаза
- •Детекторы применямые в газовой хроматографии
- •Детектор электронного захвата (дэз)
- •Пламенно-ионизационный детектор (пид)
- •Детектор по теплопроводности (дтп)
- •Качественный анализ
- •Количественный анализ
- •Тонкослойная хроматография
- •Формальные аспекты тонкослойной хроматографии
- •Преимущества и недостатки тсх
- •Экспрессность
- •Расход анализируемого вещества
- •Простота техники тсх
- •Наглядность и информативность
- •Простота протоколирования результатов
- •Простота оборудования
- •Стоимость
- •Характеристика основных “участников” тсх
- •Подложка
- •Сорбент
- •Растворители в тсх
- •Камеры для тсх
- •Методы проявления хроматограмм
- •Особенности качественного и количественного тсх-анализа
- •Качественный анализ
- •Количественный анализ
Закон Бугера – Ламберта – Бера.
Рис. 10.
I=I0e-kl
Lg(I0/I)=kl
I=I0e-klc
Lg(I0/I)=klc
D=klc
Если l (см), а с (моль/л), то k - молярный коэффициент поглощения.
Является строго индивидуальной характеристикой каждого вещества и приводится в справочниках.
Спектры в УФ-спектроскопии записываются координатах x – λ (нм) и y – D (оптическая плотность). Спектры записываются на приборах – спектрофотометрах
СВЯЗЬ ЭЛЕКТРОННЫХ СПЕКТРОВ ПОГЛОЩЕНИЯ СО СТРОЕНИЕМ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Поглощение в области 1000—10 000 Ǻ обусловливается изменением в электронном состоянии молекулы. Согласно этому спектры поглощения в ультрафиолетовой и видимой областях получили название электронных.
В органических соединениях такое поглощение связано с переходами валентных электронов одинарных и кратных связей (σ-ия-электроны) и электронов неподеленных пар гетероатомов (n-элект-роны)1. Эти электроны имеют различную энергию и поэтому возбуждаются излучением с различной длиной волны. Последовательность энергетических уровней электронов в молекуле органического соединения следующая:

Как видно из приведенной схемы, энергия связывающих π-орбит выше энергии связывающихσ-орбит. Для разрыхляющих орбит соотношение обратное - энергияσ*-орбит больше энергииπ*-ор-бит.
Электронные переходы со связывающих орбит на соответствующие разрыхляющие обозначаются N->V; к ним относятся переходыσ—σ* иπ—π*.
Переходы σ→σ* требуют большой энергии и поэтому соответствующие полосы поглощения лежат в области вакуумного ультрафиолета (<170нм). Возбуждениеπ-электронов требует меньших энергий, и поглощение, отвечающее переходамπ—π*, находится в более длинноволновой части спектра. Электроныn-уровней способны переходить на разрыхляющиеπ*- иσ*-орбиты. Переходыn—>σ* иn—π* обозначаютсяN—>Q. Интенсивность полос переходаn—>π*, как правило, значительно меньше интенсивности полос, отвечающих другим переходам.
В органических соединениях, не содержащих π- иn-электроны, единственными электронными переходами будутσ—σ*. Присутствие в насыщенных соединениях атомас неподеленными электронами вызывает появление переходовn—*, лежащих в более длинноволновой области, чем переходыσ—*. Переходыη—кг* наблюдаются в соединениях, у которых гетероатом связан кратной связью с другим атомом. В простых несопряженных системах эти переходы являются наиболее длинноволновыми. При сопряжении высшая связывающаяπ-орбиталь может иметь большую энергию, чем несвязывающая n-орбиталь, и тогда наиболее длинноволновой полосой будет полоса переходаπ→π*.
В многоатомной молекуле, содержащей электроны в различных состояниях, под действием излучения могут происходить многочисленные переходы из основного состояния в различные возбужденные состояния. По частоте поглощения в электронных спектрах могут быть оценены только относительные энергии двух уровней.
Смещение полос поглощения, происходящее под влиянием внутримолекулярных и межмолекулярных взаимодействий, осуществляется в результате изменения разности между энергиями основного и возбужденного состояний, причем это может происходить либо за счет изменения энергии основного состояния, либо за счет изменения энергии обоих состояний. Если при изменении энергии основного и возбужденного состояний разность между ними не меняется, то соответствующая полоса в спектре не смещается, хотя в молекуле при этом могут произойти существенные изменения в распределении электронной плотности.
Полосы поглощения в электронном спектре характеризуются длиной волны и интенсивностью поглощения. Длина волны полосы поглощения, отвечающая данному электронному переходу, соответствует энергии этого перехода. Интенсивность полос поглощения определяется вероятностью перехода.
В электронной спектроскопии интенсивность полос поглощения измеряется обычно значением молярного коэффициента поглощения в максимуме полосы (емаксилиlgемакс). Полосы поглощения могут быть охарактеризованы также и интегральной интенсивностьюА
![]()
где εν— коэффициент молярного поглощения при частотеν;νιиV2 — волновые числа, ограничивающие рассматриваемую полосу поглощения.
Интегральная интенсивность определяется как площадь под кривой поглощения, вычерченной в координатах ε—v.
Иногда интенсивность полос поглощения выражается силой осциллятора, которая связана с интегральной интенсивностью следующим выражением:
![]()
где т ие — массаи заряд электрона;с—скорость света в вакууме;N — число Авогадро.
![]()
Здесь Μ— оператор дипольного момента:
![]()
Вероятность перехода между двумя состояниями т и я, т. е. интенсивность полосы поглощения, определяется моментом перехода
\\\п и\£п — волновые функции состояниит и я, между которыми
совершается переход; г{ — векторί-того электрона;гг — вектор /-того ядра с атомным номеромΖ7.
Интегрирование проводится по всем переменным элементам объема многомерного пространства.
Интенсивность, выраженная силой осциллятора, связана с моментом перехода следующим выражением:
![]()
Когда момент перехода Mmn равен нулю, то интенсивность соответствующего поглощения также равна нулю и переход запрещен. Переход бывает разрешен только приШтпфО.
Существуют правила, определяющие условия запрещения поглощения в спектре (правила отбора).
1. Правило отбора по спину. Запрещены переходы, при которых происходит изменение спина электрона. Однако вследствие спин-спинового и спин-орбитального взаимодействия полосы поглощения, отвечающие таким переходам, появляются в спектрах, хотя и с малой интенсивностью (/^10_6). В молекулах, содержащих тяжелые атомы, спин-орбитальное взаимодействие приобретает большое значение и для них соответствующие полосы поглощения появляются с заметной интенсивностью.
Переходы, происходящие без изменения спина электрона, называются синглет-синглетыми. Синглет-триплетными называются переходы, происходящие с изменением спина.
2. Правило отбора по симметрии. Момент перехода как вектор- пая величина может быть разложен наХ-, Y- иZ-компоненты:
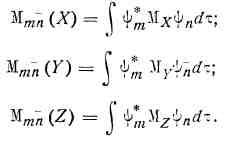
Если симметрия основного и возбужденного состояний молекулы такова, что 'все эти интегралы равны нулю, то переход запрещен по симметрии. В том случае, когда хотя бы один из интегралов будет отличаться от нуля, переход разрешен.
Правило запрета по симметрии выведено без учета колебательных взаимодействий. Поскольку при колебаниях симметрия может изменяться, то и соответствующие запрещенные по симметрии переходы могут проявляться в спектре в виде полос, имеющих невысокую интенсивность.
Правило отбора по локальной симметрии. Соединения, содержащие такие ненасыщенные группы, как С = 0,C=S,C=N,N=N, N = 0 и подобные им, имеют полосы поглощения, вызванные синг-лет-синглетными η—кгг*-переходами. Интенсивность этих полос поглощения невелика. Если я-электроны находятся на чистой орбите р, то момент перехода равен нулю и переходη—нх* запрещен. В этом случае говорят, что переход запрещен по локальной симметрии. Если ^-Электрой расположен на гибридных орбитах, которые имеют некоторый вклад атомнойs-орбиты, то момент перехода не будет равен нулю и величина его будет определяться вкладом атомной 5-орбиты гетероатома в гибридную орбиту. Гибридные м5р-орбиты лежат по энергии ниже тгр-орбиты, и, следовательно, полосы поглощения, отвечающие переходамην—мх*, находятся вболее длинноволновой части спектра, чем полосы поглощения, соответствующие переходамnsp—^π*.
Запрещены переходы, при которых происходит возбуждение более чем одного электрона. Этот запрет также может частично сниматься.
Квантово-механические методы позволяют приближенно рассчитать спектры сложных молекул и провести в ряде случаев отнесение полос поглощения к отдельным переходам. Относительно прост такой расчет только для π-электронов. Точные расчеты всего набора энергетических уровней многоатомной системы в настоящее время невозможны.
Отнесение полос поглощения к определенным электронным переходам хорошо иллюстрируется на примере простой молекулы формальдегида, содержащейσ-,π- и я-электроны.
Молекула формальдегида в основном состоянии имеет плоское строение, и двенадцать валентных электронов распределяются по следующим шести орбитам:
а)симметричная и антисимметричная связывающиеσ-орбиты группы С—Н,
б)связывающаяσ-орбита группы С = 0,
в)связывающаяπ-орбита группы С = 0,
г)несвязывающие орбиты неподеленных пар атомов кислорода.
Одна из неподеленных пар электронов атома кислорода находится на /?-орбите (яр), вторая занимает гибриднуюsp-орбиту
(Пзр).
