
- •Введение
- •Глава 1. Общая характеристика биоплёнок. Основные принципы строения биоплёнок.
- •1.1. Биоплёнки как форма существования микроорганизмов и их сообществ
- •1.2. История исследования биоплёнок
- •1.3. Составные компоненты биоплёнки
- •1.4. Матрикс
- •1.4.1. Полисахариды матрикса биоплёнки.
- •1.4.2. Белки матрикса биоплёнки.
- •1.4.3. Нуклеиновые кислоты в матрикса биоплёнки
- •1.4.4. Липиды и сурфоктанты матрикса биоплёнки.
- •1.4.5. Вода, как компонент матрикса биоплёнки
- •1.4.6. Матрикс и механические свойства биоплёнки.
- •Глава 2. Процесс формирования биоплёнки.
- •2.1. Основные стадии процесса формирования биоплёнки.
- •1) Адгезия; 2) Монослой; 3) Микроколонии; 4) Зрелая биоплёнка; 5) Распад биоплёнки.
- •2.2. Адгезия
- •Механизмы клеточной коаггрегации
- •2.4. Зрелые биоплёнки.
- •2.5. Распад биоплёнок
- •Глава 3. Биохимия и физиология биоплёнок
- •Глава 4. Регуляция процесса формирования биоплёнки. Межклеточная коммуникация
- •4.1. Система quorum sensing
- •4.2. Сигнальные молекулы системы quorum sensing
- •4.3. Типы систем quorum sensing
- •4.4. Система мессенджеров
- •Фоторецептор бактерий
- •Глава 5. Экология биоплёнок.
4.2. Сигнальные молекулы системы quorum sensing
Основу системы QS составляют сигнальные молекулы. Это вещества обладают различной химической структурой и физико-химическими свойствами [12, 19]. Сигнальных молекул, которые используются в системе QS у микроорганизмов относятся к следующим группам соединений (рис. 13):
Аминокислоты – ацилированные гомосерин лактоны грамотрицательных бактерий
Пептиды – линейные и циклические сигнальные пептиды грамположительных бактерий
Гетероциклические соединения – 2-гептил-3-гидрокси-4-хинолон P. aeruginosa, сигнальные фураноны, γ-бутиролактон бактерий рода Streptomyces.
Алифатические соединения – фарнезол Candida albicans.
Некоторые из представленных соединений синтезируются только одной определённой группой или видами, тогда как другие, например сигнальные фураноны, встречаются у широкого спектра микроорганизмов и, по-видимому, играют роль молекул межвидовой коммуникации [2]. Так же, некоторые виды микроорганизмов синтезирует только один тип сигнальных молекул системы QS, тогда как другие могут использовать в этих целях несколько групп соединений.

Рис. 13. Структура основных сигнальных молекул системы quorum sensing.
У грамотрицательных бактерий наиболее распространенной группой сигнальных молекул являются ацилированные гомосерин лактоны (АГЛ). АГЛ представляют собой производные гомосерина замещённый по NH2-группе ацильным радикалом различной длинны (рис. 14). Минимальное количество углеродных атомов у известных сегодня АГЛ равняется 4, таким образом, самым коротким сигнальным гомосерин лактоном является N-бутирил гомосерин лактон P. aeruginosa [83]. АГЛ грамотрицательных бактерий делятся на две группы – нормальные АГЛ и 3-оксо или 3-гидрокси производные. Последние имеют дополнительный заместитель по третьему углеродному атому ацильной цепи в виде О= в случае 3-оксо или ОН- в случае 3-гидрокси производных. Все АГЛ представлены L-стериоизомерами. Все природные АГЛ имеют четное количество атомов углерода в ацильной цепи, обычно от 4 до 14. Существуют и синтетические АГЛ с нечётным числом атомов углерода. Такие производные являются сильными ингибиторами АГЛ-зависимой системы QS [64]. АГЛ с ненасыщенной ацильной цепью, например N-C14 и 3-гидрокси-С14-АГЛ могут подвергаться цис-транс изомерии.
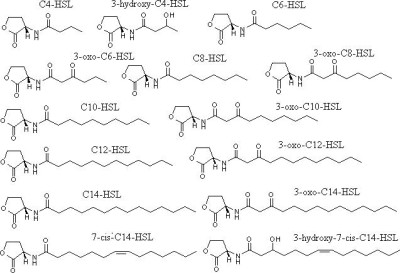
Рис. 14. Структурные формулы некоторых АГЛ.
Предшественниками АГЛ является S-аденозилметионин (предшественник гомосеринлактона) и ацетил-ацетат (предшественник ацильной цепи). Биосинтез гомосеринлактона (рис. 15) происходит путём отщепления остатка метионина от предшественника по сульфидной связи, и дальнейшего его превращения в гомосерин. В результате реакции образуется гомосеринлактон и высокотоксичное соединение метилтиоаденозин. Оно инактивируется путём гидролиза с помощью фермента Pfs (метилтиоаденозин\S-аденозилгомоцестеин нуклеазы) с образованием менее токсичной метилтиорибозы и аденина [51].

Рис. 15. Биосинтез сигнальных молекул микроорганизмов.
Биосинтез ацильной цепи происходит в цикле элонгации жирных кислот с помощью ферментов семейства Fab [34]. В результате работы цикла элонгации образуется группа интермедиатов – 3-оксо\гидрокси-С(n)-ацетилфосфаты и N-C(n)-ацетилфосфаты (где n – количество атомов углерода). Эти интермедиаты переносятся с помощью специальных I-белков (ацетилфосфаттрансферазами\АГЛ-синтетазами) на молекулу гомосеринлактона. В результате получаются АГЛ с различной длиной ацильной цепи. Катаболизм АГЛ осуществляется путём гидролиза (рис. 16). У микроорганизмов имеются в наличии две группы ферментов разрушающие АГЛ – лактоназы и ацилазы [36, 73]. В первом случае гидролиз молекулы АГЛ идёт по лактонному кольцу с образованием ацил-гомосерина, во втором, с восстановлением NH2- группы гомосеринлактона и отделением соответствующей жирной кислоты.
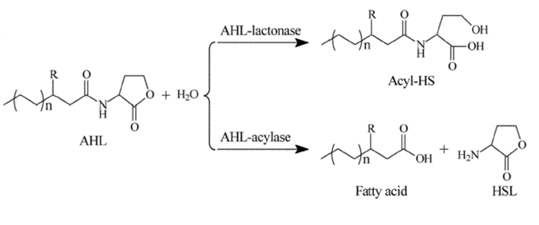
Рис. 16. Пути инактивации молекул АГЛ
Молекулы АГЛ обладают цитотоксичностью по отношению к клеткам эукариот. Так, показано, что 3-оксо-додеканоил-гомосеринлактон P. aeruginosa вызывает апоптозоподобную клеточную смерть нейтрофилов человека, а так же способен влиять на уровень синтеза провосполительных цитокинов [72].
Сигнальные молекулы грамположительных бактерий представлены сигнальными пептидами. Сигнальные пептиды в зависимости от вида микроорганизмов могут находиться в линейной или циклической форме (обычно в виде пептид-тиолактона). К циклическим сигнальным пептидам относятся, например AgrD1 и AgrD2 Staphylococcus aureus. К линейным – низин Lactococcus lactis. Сигнальные пептиды состоят из небольшого числа аминокислотных остатков. Так, упомянутый выше низин состоит из 34 аминокислот (рис. 17). Молекула низина стабилизируется за счёт –S- связей между 3 и 7, 8 и 11, 13 и 19, 23 и 26, 25 и 28 аминокислотными остатками. Низин является одним из самых крупных сигнальных пептидов. Для сравнения AgrD1 состоит всего лишь из 7 аминокислот, СomX Bacillus subtilis – 6 аминокислот, и т. д [47, 50]. Особенностью B. subtilis является наличие второго сигнального пептида – субтилина. Он состоит из 32 аминокислотных остатков и относится к линейным пептидам.
Биосинтез сигнальных пептидов осуществляется с единой ДНК матрицы (рис. 14). В ходе трансляции образуется полипептид, состоящий из повторяющихся аминокислотных последовательностей, соответствующих структуре того или иного сигнального пептида. Далее, получившейся полипептид нарезается на отдельные сигнальные молекулы. Такая нарезка может осуществляться или в цитоплазме клеток с участием специфических пептидаз, или в момент выхода полепептидной последовательности из клетки. Во втором случае пептидазный домен входит в состав специфического транспортёра [65].
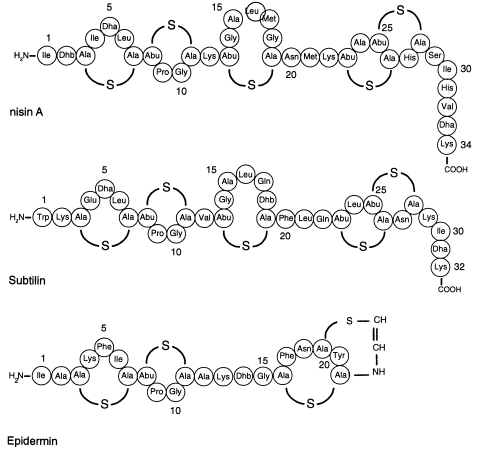
Рис. 17. Строение некоторых сигнальных пептидов грамположительных бактерий.
Многие линейные сигнальные пептиды обладают значительной антимикробной активностью. Такие сигнальные пептиды получили название лантибиотики или не фаговые бактериоцины [50]. Примерами лантибиотиков могут служить названные выше низин и субтилин, а так же эпидермин S. epidermidis. Наиболее изученным среди них является низин, чей механизм действия основан на нарушении синтеза клеточной стенки за счёт связывания с липидом ІІ а так же формировании пор в клеточной стенки мишеней [23].
Сигнальные фураноны, как указывалось выше, встречаются как у грамотрицательных так и у грамположительных бактерий. Эти соединения получили название аутииндуктор-2 (АИ-2). АИ-2 был впервые описан у V. harveyi при изучении работы системы QS у этого микроорганизма [13]. Дальнейшие исследования показали, что АИ-2 имеет очень широкое распространение в природе. Под АИ-2 сегодня понимаются два родственных соединения – 2,2,6,6а-тетрагидрокси-3а-фуранон и его борированное производное 2,2,6,6а-тетрагидрокси-3а-фурано[3,2-d][1,3,2]дигидроксоборолан-2-уид (фуранозил борат диэстер). Второе соединение уникально тем что, оно входит в небольшое число биологически активных природных веществ содержащих бор. Фуранозил борат диэстер встречается практически исключительно у представителей рода Vibrio, тогда как не борированый АИ-2 у многих микроорганизмов [74].
Биосинтез АИ-2 осуществляется тем же путём что и АГЛ, однако в процессе синтеза наблюдается ряд существенных отличий (рис. 18.).
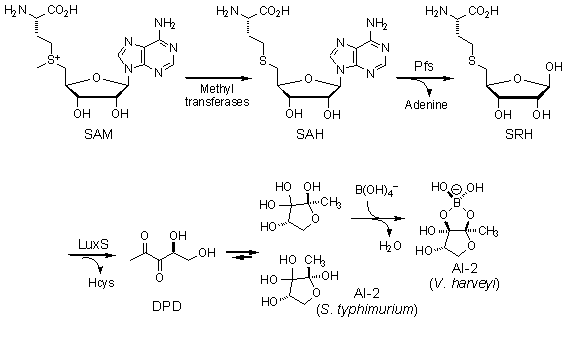
Рис. 18. Биосинтез аутоиндуктора-2.
Предшественником АИ-2, так же как и АГЛ, является S-аденозилметионин. Однако в отличие от последних гидролиз этого соединения происходит не сразу. В начале от предшественника с помощью метилтрансферазы отщепляется метил и образуется S-аденозилгомоцистеин. Затем, фермент Pfs отщепляет аденин с образованием S-рибозилгомоцистеина. С помощью фермента LuxS от интермедиата отщепляется гомоцистеин и образуется 4,5-дигидрокси-2,3-пентандион (ДПД), который является непосредственным предшественником АИ-2. Не содержащий бор АИ-2 образуется из ДПД в ходе обратимой реакции, тогда как фуранозил борат диэстер образуется из не борированного АИ-2 в присутствии B(OH)4-, с выделением воды. Последняя реакция является не обратимой, и, скорее всего, носит не ферментативный характер [74].
Для P. aeruginosa важнейшей сигнальной молекулой является 2-гептил-3-гидрокси-4-хинолон (PQS – Pseudomonas Quinolon Signal). Это соединение представляет собой хинолон, замещённый по второму положению ацильным остатком, содержащим семь атомов углерода. Биосинтез этого соединения (рис. 19) осуществляется двумя путями [8]. Предшественником PQS в обоих случаях является антраниловая кислота. В ходе основного пути биосинтеза две молекулы антраниловой кислоты конденсируются с образованием хинолона, к которому затем присоединяется активированная энантовая кислота. В случае альтернативного пути биосинтеза, антраниловая кислота реагирует с оротиевой кислотой. При этом образуется промежуточный продукт – киннуриновая кислота, к которой затем присоединяется активированная капроновая. Реакция конденсации антраниловой и оротиевой кислоты идёт с выделением мочевины. Все реакции основного и альтернативного пути
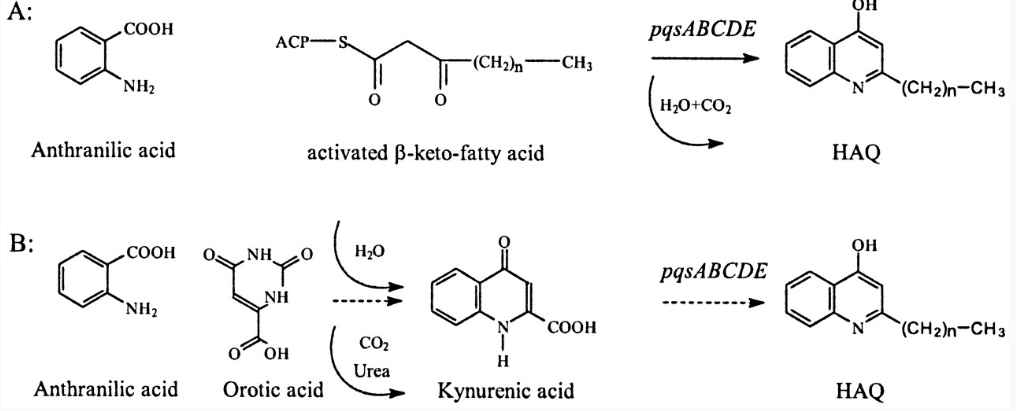
Рис. 19. Основной и альтернативный пути биосинтеза ацил-хинолонов [8].
биосинтеза PQSосуществляются ферментами кодируемыми генамиpqsABCDE[8]. В связи с высокой алкалифильностью и размерамиPQSне способен диффундировать через мембрану клеток, а выделяется в составе мембранных везикул[39].
PQS выполняет ряд важнейших функций в поддержании работы системы межклеточной коммуникации у P. aeruginosa. В частности он является переключателем между двумя основными звеньями QS синегнойной палочки, а так же дополнительно регулируют биосинтез ряда продуктов контролируемых системой [21]. Так же как и АГЛ, PQS характеризуется определённой степенью цитотоксичности для клеток эукариот, а так же обладает иммуномодулирующей активностью [35].
Алифатические сигнальные молекулы в основном распространенны среди низших эукариот. Характерным примером такой сигнальной молекулы является фарнезол Candida albicans. Фарнезол представляет полиненасыщенный моноатомный спирт, имеющий во 2,6 и 10 положении метильные заместители. Это соединение синтезируется в пути биосинтеза эргостерола (рис. 20).
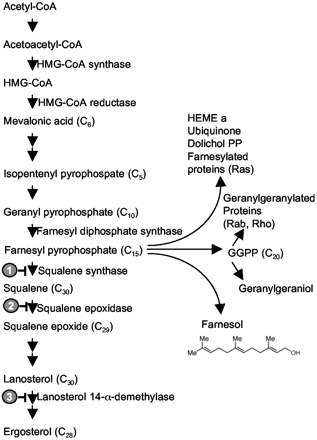
Рис. 20. Биосинтез фарнезола у Candida albicans.
В ходе биосинтеза из ацетил-СоА впоследствии ряда превращений образуется геранил пирофосфат. Из этого продукта под действием фермента фарнезил пирофосфат синтетазы образует интермедиат фарнезил пирофосфат. Часть интермедиата через сквалин и ланостерол превращается в эргостерол, а часть выводится из метаболического пути и уходит на биосинтез ряда метаболитов, в том числе и фарнезола [71]. Фарнезол регулирует образование псевдогифов у C. albicans, а так же способен инактивировать некоторые звенья QS бактерий. Существуют так же данные о способности фарнезола подавлять рост раковых клеток [10].
