
- •21. Основной закон релятивистской динамики.
- •23. Частицы с нулевой массой.
- •24. Модель идеального газа. Уравнение состояния.
- •25. Основное уравнение мкт газов.
- •28. Распределение Максвелла. Виды скоростей молекул и их физический смысл. Распределение Максвелла
- •32. Работа газа при изменении его объёма.
- •34. Применение первого начала к изопроцессам.
- •35. Адиабатический процесс. Уравнение адиабаты (Пуассона). Коэффициент Пуассона.
- •Адиабата Пуассона
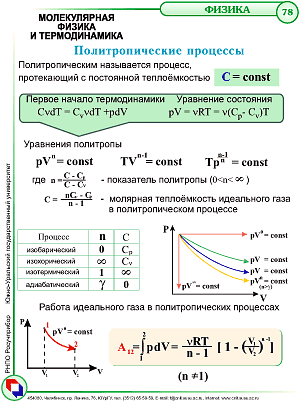
- •36. Политропические процессы. Уравнение политропы.
- •37. Понятие энтропии. Свойства энтропии. Второе начало термодинамики.
- •38. Изменение энтропии при обратимых и необратимых процессах.
- •39. Третье начало термодинамики (теорема Нернста).
- •40. Принцип работы тепловой машины. Кпд.
- •46. Физические типы кристаллических решёток.
- •51. Теплопроводность. Внутреннее трение (вязкость).
- •52. Диффузия, теплопроводность и вязкость газов.
- •53. Закон Кулона. Напряженность электрического поля. Принцип суперпозиции.
- •54. Поток вектора. Теорема Гаусса. Расчёт электростатических полей.
- •55. Работа сил электростатического поля.
- •56. Потенциал. Градиент потенциала. Циркуляция вектора. Эквипотенциальные поверхности.
36. Политропические процессы. Уравнение политропы.
37. Понятие энтропии. Свойства энтропии. Второе начало термодинамики.
Состояние макроскопической системы, описанное с помощью объёма, давления и температуры, внутренней энергии определяет макро-состояние системы. Рассмотрим изолированную систему, состоящую из двух тел. В такой системе будет протекать процесс теплопередачи, приводящий к выравниванию температуры. Этот процесс является необратимым. Для того, чтобы знать, какие процессы могут протекать в изолированной термодинамической системе, нужно знать вероятность различных состояний этой системы. Величина, которая служит для характеристики вероятности состояний, получила название энтропии. Эта величина является функцией состояния, аналогично внутренней энергии. Если система находится в равновесии, то макро-состояние не изменяется. Однако, частицы системы всё время перемещаются и изменяют свой импульс в результате соударения. В результате, состояние системы всё время изменяется.
Свойства энтропии: 1.Энтропия изолированной системы при протекании необратимого процесса возрастает.2.Энтропия системы, находящейся в равновесии, максимальна.
Утверждение о том, что энтропия изолированной системы может только возрастать, носит название закона возрастания энтропии, или вторым началом термодинамики.
38. Изменение энтропии при обратимых и необратимых процессах.
Изменение энтропии в результате обратимого процесса записывается:
∆S
=
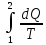 ,
где
,
где
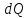 – теплота, передаваемая системе при
температуре Т.
– теплота, передаваемая системе при
температуре Т.
Изменение энтропии в результате необратимого процесса записывается:
dS
>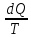
39. Третье начало термодинамики (теорема Нернста).
Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при приближении температуры к абсолютному нулю.
Теорема
Нернста утверждает, что всякий
термодинамический процесс, протекающий
при фиксированной температуре T в сколь
угодно близкой к нулю, ![]() ,
не должен сопровождаться
изменением энтропии S,
то есть изотерма
,
не должен сопровождаться
изменением энтропии S,
то есть изотерма ![]() совпадает
с предельной адиабатой
совпадает
с предельной адиабатой ![]() .
.
40. Принцип работы тепловой машины. Кпд.
Всякий двигатель можно представить как систему, совершающую многократно круговой процесс (цикл). Пусть в ходе цикла рабочее вещество сначала расширяется до объёма V2, а потом сжимается до объёма V1. Чтобы работа за цикл была положительной, давление в процессе расширения должно быть больше, чем при сжатии. Для этого рабочему веществу в ходе расширения нужно сообщать дополнительное количество энергии Q1. А при сжатии забирается энергия Q2. Совершая цикл, рабочее вещество возвращается в исходное состояние. Изменение внутренней энергии dU=0. Работа, совершаемая за цикл: А=Q1-Q2.
Периодически
действующий двигатель, совершающий
работу за счёт получаемого из вне тепла,
называется тепловой машиной. КПД такой
машины определяется, как отношение
работы к полученному из вне количеству
теплоты. ŋ=
41.
Цикл Карно. Теорема Карно.
Для
работы теплового двигателя необходимо
наличие двух тепловых резервуаров
нагревателя с температурой Т1 и охладителя
с температурой Т2, где Т1>Т2. Будем
считать. Что теплоёмкость резервуаров
бесконечна. Это значит, что отдача или
забор теплоты не меняет его температуры.
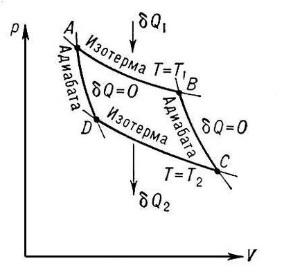
Диаграмма
цикла Карно.
Найдём КПД
цикла: совершив цикл, система возвращается
в исходное состояние. Значит, полное
изменение энтропии за цикл равно нулю.
На участке АВ изменение энтропии равно
Q1/T1.
На участке CD
–Q2/T2.
На участке AD
и ВС изменение энтропии равно нулю.
Полное изменение: ∆S
=
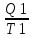 -
-
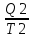 = 0 ==>
= 0 ==>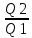 =
=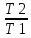 КПД тепловой
машины ŋ =
КПД тепловой
машины ŋ =
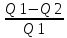
ŋ = 1-
ŋ = 1-
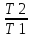 Это
и есть запись КПД цикла Карно, откуда
следует теорема Карно: КПД тепловой
машины, работающей по циклу Карно, не
зависит от состояния рабочего вещества
и определяется только температурой
нагревателя и охладителя.
Это
и есть запись КПД цикла Карно, откуда
следует теорема Карно: КПД тепловой
машины, работающей по циклу Карно, не
зависит от состояния рабочего вещества
и определяется только температурой
нагревателя и охладителя.
42.
Реальные газы. Уравнение Ван-дер-Ваальса.
Поведение
реальных газов хорошо удовлетворяет
модели идеального газа при уравнении
Менделеева-Клапейрона только при малых
плотностях. Малые плотности газа
реализуются только при малых давлениях
и высоких температурах. С ростом давления
при постоянной температуре левая часть
уравнения должна оставаться постоянной,
однако при давлениях порядка в 100
атмосфер наблюдается заметное отклонение
от равенства. Для описания поведения
газа в широком интервале давлений и
температур записывается уравнение
Ван-дер-Ваальса:
![]() где
где
![]() — давление,
— давление,![]() —молярный
объём
—молярный
объём![]() , —
абсолютная температура,
, —
абсолютная температура,![]() —универсальная
газовая постоянная.
Коэффициенты
a
и b
- есть константы Ван-дер-Ваальса, имеющие
разные значения для различных газов.
Анализ
формулы показывает, что
—универсальная
газовая постоянная.
Коэффициенты
a
и b
- есть константы Ван-дер-Ваальса, имеющие
разные значения для различных газов.
Анализ
формулы показывает, что
 - есть добавка к внешнему давлению,
которое обусловлено взаимным притяжением
молекул друг к другу. Их взаимодействие
существенно на небольших расстояниях,
определяемых R
молекулярного действия.
- есть добавка к внешнему давлению,
которое обусловлено взаимным притяжением
молекул друг к другу. Их взаимодействие
существенно на небольших расстояниях,
определяемых R
молекулярного действия.
 =
= .
Коэффициент
«b»
определяет объём молекул в сосуде.
Внутренняя
энергия 1 моля газа: U
=
.
Коэффициент
«b»
определяет объём молекул в сосуде.
Внутренняя
энергия 1 моля газа: U
=
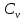 T
+
T
+
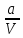 Уравнение
Ван-дер-Ваальса представляет собой
уравнение третьей степени относительно
объёма. Это уравнение имеет три
вещественных корня.
Уравнение
Ван-дер-Ваальса представляет собой
уравнение третьей степени относительно
объёма. Это уравнение имеет три
вещественных корня.
43. Экспериментальные изотермы. Реальные газы отличаются от идеальных тем, что молекулы этих газов имеют конечные собственные объемы и связаны между собой сложными силами взаимодействия. При высоких давлениях и достаточно низких температурах реальные газы конденсируются, т. е. переходят в жидкое состояние, чего принципиально не может быть с идеальными газами.
44. Фазовые переходы. Переход от одной фазы к другой обычно сопровождается поглощением или выделением некоторого количества тепла. Такие переходы называют фазовыми переходами первого рода. Фазовые переходы первого рода характеризуются постоянством температуры и изменением объёма
45. Строение твёрдых тел. Классификация кристаллов. Твердые тела в обычных условиях сохраняют и объем, и форму. Это объясняется тем, что притяжение между их частицами еще больше, чем у жидкостей. Частицы (молекулы или атомы) большинства твердых тел, таких, как лед, соль, алмаз, металлы, расположены в определенном порядке. Такие твердые тела называют кристаллическими. Хотя частицы этих тел и находятся в движении, но движение это представляет собой колебания около определенных точек (положений равновесия). Частицы не могут уйти далеко от этих точек, поэтому твердое тело сохраняет свою форму и объем. Классификация кристаллов, основанная на типах связи, является полезной в понимании соотношений структура — свойства в твердых телах. В зависимости от типа связи легко определяются пять типов твердых тел: ионные, ковалентные, металлические, молекулярные и соединения с водородными связями
