
- •21. Основной закон релятивистской динамики.
- •23. Частицы с нулевой массой.
- •24. Модель идеального газа. Уравнение состояния.
- •25. Основное уравнение мкт газов.
- •28. Распределение Максвелла. Виды скоростей молекул и их физический смысл. Распределение Максвелла
- •32. Работа газа при изменении его объёма.
- •34. Применение первого начала к изопроцессам.
- •35. Адиабатический процесс. Уравнение адиабаты (Пуассона). Коэффициент Пуассона.
- •Адиабата Пуассона
- •36. Политропические процессы. Уравнение политропы.
- •37. Понятие энтропии. Свойства энтропии. Второе начало термодинамики.
- •38. Изменение энтропии при обратимых и необратимых процессах.
- •39. Третье начало термодинамики (теорема Нернста).
- •40. Принцип работы тепловой машины. Кпд.
- •46. Физические типы кристаллических решёток.
- •51. Теплопроводность. Внутреннее трение (вязкость).
- •52. Диффузия, теплопроводность и вязкость газов.
- •53. Закон Кулона. Напряженность электрического поля. Принцип суперпозиции.
- •54. Поток вектора. Теорема Гаусса. Расчёт электростатических полей.
- •55. Работа сил электростатического поля.
- •56. Потенциал. Градиент потенциала. Циркуляция вектора. Эквипотенциальные поверхности.
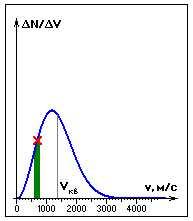
28. Распределение Максвелла. Виды скоростей молекул и их физический смысл. Распределение Максвелла
Молекулы
газа вследствие теплового движения
испытывают многочисленные соударения
друг с другом. При каждом соударении
скорости молекул изменяются как по
величине, так и по направлению. В
результате в сосуде, содержащем большое
число молекул, устанавливается некоторое
статистическое распределение молекул
по скоростям, зависящее от абсолютной
температуры Т. При этом все направления
векторов скоростей молекул оказываются
равноправными (равновероятными), а
величины скоростей подчиняются
определенной закономерности. Распределение
молекул газа по величине скоростей
называется распределением Максвелла.
Если одновременно
измерить скорости большого числа N
молекул газа и выделить некоторый малый
интервал скоростей от v до v+![]() v,
то в выделенный интервал
v,
то в выделенный интервал![]() v
попадает некоторое число
v
попадает некоторое число![]() N
молекул. На графике удобно изображать
зависимость величины
N
молекул. На графике удобно изображать
зависимость величины![]() от
скорости v. При достаточно большом числе
N эта зависимость изображается плавной
кривой, имеющей максимум при
от
скорости v. При достаточно большом числе
N эта зависимость изображается плавной
кривой, имеющей максимум при![]() (наиболее
вероятная скорость). Здесь m - масса
молекулы,
(наиболее
вероятная скорость). Здесь m - масса
молекулы,![]() -
постоянная Больцмана.
Характерным
параметром распределения Максвелла
является так называемая среднеквадратичная
скорость
-
постоянная Больцмана.
Характерным
параметром распределения Максвелла
является так называемая среднеквадратичная
скорость![]() означает
среднее значение квадрата скорости. В
молекулярной физике доказывается,
что
означает
среднее значение квадрата скорости. В
молекулярной физике доказывается,
что![]() где
где![]() -
молярная масса.
Из выражения для
среднеквадратичной скорости следует,
что средняя кинетическая энергия
поступательного движения молекул газа
есть
-
молярная масса.
Из выражения для
среднеквадратичной скорости следует,
что средняя кинетическая энергия
поступательного движения молекул газа
есть![]() Распределение
Максвелла является одной из важнейших
статистических закономерностей
молекулярной физики.
Скорости
молекул подразделяются на:1)
наиболее вероятную
Распределение
Максвелла является одной из важнейших
статистических закономерностей
молекулярной физики.
Скорости
молекул подразделяются на:1)
наиболее вероятную ![]() ,
2) среднюю
,
2) среднюю ![]() ,
3) среднюю
квадратичную
,
3) среднюю
квадратичную ![]()
29.
Распределение Больцмана. Барометрическая
формула.
Барометрическая
формула.
Если
температура не зависит от высоты, то
давление газа меняется с высотой по
закону:
![]() ,
где
,
где![]() —
высота,
—
высота,![]() —
молярная газовая постоянная,
—
молярная газовая постоянная,![]() —
постоянная Больцмана,
—
постоянная Больцмана,![]() —
ускорение свободного падения вблизи
поверхности земли,
—
ускорение свободного падения вблизи
поверхности земли,![]() —
молярная масса газа,
—
молярная масса газа,![]() —
масса одной молекулы,
—
масса одной молекулы,![]() —
абсолютная температура.
Поделив барометрическую
формулу на
—
абсолютная температура.
Поделив барометрическую
формулу на ![]() ,
с учетом уравнения состояния идеального
газа, получим распределение Больцмана
— зависимость концентрации молекул
от потенциальной энергии:
,
с учетом уравнения состояния идеального
газа, получим распределение Больцмана
— зависимость концентрации молекул
от потенциальной энергии:
![]() ,где
,где ![]() —
потенциальная энергия молекулы. В
однородном поле силы тяжести
—
потенциальная энергия молекулы. В
однородном поле силы тяжести ![]() .
.
30. Закон равного распределения энергии по степеням свободы. Внутренняя энергия. Закон равного распределения энергии по степеням свободы гласит, что на каждую поступательную степень приходится энергия E=1/2kT. На колебательную степень свободы приходится E=kT. Важнейшей характеристикой молекул газа является его внутренняя энергия, которая представляет собой энергию хаотического движения молекул системы и энергию их взаимодействия. Внутренняя энергия есть однозначная функция термодинамического состояния системы. Состояние, в котором внутренняя энергия равна нулю. Важно знать изменение внутренней энергии при переходе из одного состояния в другое. Величина внутренней энергии для моля газа: U = CVT (CV – теплоёмкость при V=const). U=m/Ɲ * CVT
31. Первое начало термодинамики. Рассмотрим термодинамическую систему, для которой механическая энергия не меняется, а изменяется лишь внутренняя энергия. Внутренняя энергия системы может меняться в результате совершения на системой работы или сообщения ей тепла. Говорят о двух формах передачи энергии: форме работы и форме теплоты. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этом выполняется закон сохранения и превращения энергии. Допустим, что некоторая система, обладая внутренней энергией U, получила некоторое количество теплоты Q и перешла в состояние с энергией U2, совершая работу А над внешними телами. Определение: кол-во теплоты считается положительным, если оно подводится к телу. И работа положительной, если система совершает её над внешними телами. Из опыта известно, что при переходе из 1-го во 2-е состояние изменение энергии записывается как ∆U=U2-U1, и эта величина будет равна разности между полученной теплотой Q и работой, совершаемой системой. Отсюда получаем: ∆Q = ∆U + ∆A. Это Уравнение представляет собой первое начало термодинамики, которое гласит, что теплота, получаемая системой, затрачивается на изменение его внутренней энергии ∆U и совершение работы над внешними телами. (измеряется в ДЖ). Если система возвращается в исходное состояние, то изменение внутренней энергии равно нулю => Q=A. Отсюда следует, что система не может произвести работы больше, чем кол-во теплоты, полученное системой (то есть вечный двигатель не возможен)
