
21-03-2015
.docxЛекция №3
Литература
-
Ибрагимов И.М., Ковшров А.Н., Назаров Ю.Ф. Основы компьютероного моделирования наносистем, СПб.: «Ланъ», 2010
-
Минкин В.И., Симкин Б.Я., Миняев Р.М. Теория строения молекул, РнД: Феникс, 1997
1-й учебный вопрос: Расчетные методы квантовой химии
Все расчеты многоатомных систем основаны на приближенных решениях уравнения Шредингера.
Практика предъявляет два основных требования к уровню приближения и выбору расчетной схемы:
-
Сопоставимость с экспериментальными данными (данными РСА, микроволновой спектроскопии)
-
Разумные затраты времени
Метод молекулярных орбиталей имеет значительные преимущества для реализации на ЭВМ. Поэтому все основные расчетные методы используют приближение МО ЛКАО Хартри-Фока-Рутаана (HF).
В рамках этой схемы возможны дополнительные усовершенствования расчетной модели( учет электронной корреляции), так и значительные упрощения, позволяющие снижать затраты времени на несколько порядков.
Вопрос о том, какой уровень приближения следует выбрать для решения задачи, решается в зависимости от характера последней.
Одни группы задач требуют лишь качественной оценки и задачи требующие точной количественной оценки структурных и физических параметров.
Обе группы задач удобно решать полуэмпирическими методами в которых точные вычисления ряда интегралов в уравнениях Рутаана заменяются подстановкой эмпирических параметров, а большей частью интегралов пренебрегают вовсе.
Некоторые современные полуэмпирические методы (AM1, PM3) позволяют с приемлемой точностью предсказывать основные свойства молекул в основном и возбужденных электронных состояниях при достаточно малых затратах машинного времени.
2-й учебный вопрос: Неэмпирические методы (ab initio)
При использовании метода Хартри-Фока-Рутаана главной характеристикой расчетной модели является выбор базиса орбиталей: чем полнее базис, тем точнее воспроизводится полная энергия системы.
Но, способность расчета предсказывать другие молекулярные свойства не всегда монотонно зависит от выбранного базиса и учета корреляционных эффектов. Важно знать какие минимальные базисные ряды дают достаточную степень точности в определении молекулярных характеристик.
Простейший уровень неэмпирических расчетов - использование минимального базиса АО. Существенное увеличение точности достигается при переходе к базису DZ. В тоже время, переход от минимального базиса STO-3G к расширенному базису с включением поляризационной функции 6-31G* приводит к 10кратному увеличению затрат машинного времени.
Минимальный базис STO-3G достаточно удовлетворителен для воспроизведения молекулярной геометрии (ошибка в длинах связей ~0.003 нм) большинства структур с замкнутыми оболочками.
Для реакций, в которых продукты не сохраняют все типы связей исходных реагентов требуется использовать уже как минимум DZ базис (6-31G).
Такой же базис необходим для хорошего воспроизведения спектра.
Для описания барьеров вращения относительно связей где один из центров -гетероатом, а также для изучения инверсии требуется добавление поляризационных функций(6-31G* или 6-31G**).
Все рекомендации обобщены в таблице 1.
Таблица 1.
|
Свойство |
Наименьший базис |
Комментарии |
|
Геометрия системы |
минимальный |
Исключение -пирамидальные структуры |
|
Силовые постоянные |
DZ |
Уровень HF/3-21G приемлем. Расширение базиса не всегда дает заметные улучшения |
|
Вращательный барьер |
Минимальный |
Исключения – ось вращения включает два гетероатома (H2O2) для которых DZ+P (HF/6-31G*) |
|
Инверсионные барьеры |
DZ+P |
HF/6-31G*. Учет электронной корреляции практически не улучшает результат(MP2/6-31G*) |
|
Энергия реакций |
DZ, DZ+P |
|
|
Взаимодействие ионов и диполей, водородная связь |
Минимальный, DZ |
HF/STO-3G. Для расчетов анионов обязательно влючение поляризацинной добавки |
|
Слабые межмолекулярные-ван-дер-ваальсовы взаимодействия |
расширенный |
Должны быть включены поляризационные диффузные функции. Необходим учет энергии корреляции электронов (DFT, MP(N), CC): MP2/6-31+G**, B3LYP/6-31+G**, CCD/6-31+G** |
2-й учебный вопрос: Иерархия неэмпирических методов
Как мы видим из рисунка, представленного на нобелевской лекции одним из основоположников современной квантовой химии Поплом, точность расчета растет с увеличением базиса и с ростом учета энергии корреляции увеличением учета. Как мы видим из рисунков 1-2, что без учета корреляционной энергии рост базиса упирается в некоторый предел точности (HF предел точности). На рисунке 2 такой предел соответствует базису CBS. Дальнейший рост точности исследования невозможен без использования учета корреляционной энергии.
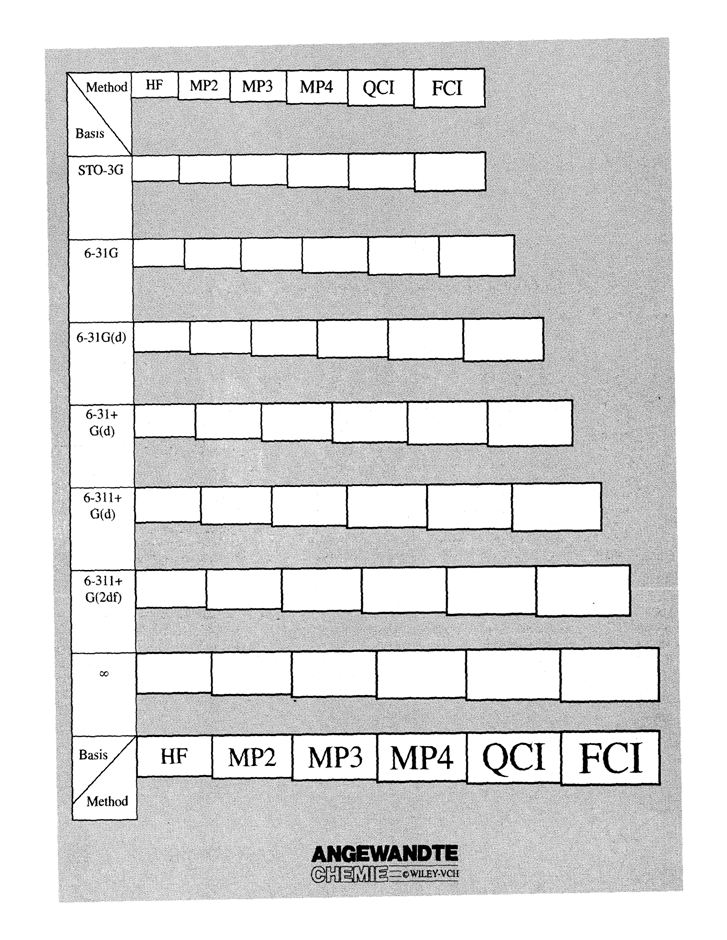
Рисунок 1. J.A. Pople – Nobel Lecture, Angew. Chem. Int. Ed.,1999, 38, 1894
Как мы видим из рисунка 1, в дальнейшем точность расчета увеличивается при переходе от уровня HF к методу теории возмущений Меллера-Плессета. При этом, точность возрастает в ряду MP2-MP3-MP4. Следующим шагом на пути увеличения точности расчетов это использование теории связанных кластеров. Так, точность расчета возрастает в ряду CCSD – CCSD(T). Самым точным методом расчета на данный момент является использование полного конфигурационного взаимодействия CI (FCI).
3-й учебный вопрос: Современные базисы для неэмпирических расчетов
В таблице 3 приведены современные базисы для неэмпирических расчетов.
Таблица 3. Современные базисы для проведеия неэмпирических расчетов
|
Базис |
Применимость |
Polarization Functions |
Diffuse Functions |
|
STO-3G |
H-Xe |
* |
|
|
3-21G |
H-Xe |
* or ** |
+ |
|
6-21G |
H-Cl |
(d) |
|
|
4-31G |
H-Ne |
(d) or (d,p) |
|
|
6-31G |
H-Kr |
(3df,3pd) |
++ |
|
6-311G |
H-Kr |
(3df,3pd) |
++ |
|
D95 |
H-Cl except Na and Mg |
(3df,3pd) |
++ |
|
D95V |
H-Ne |
(d) or (d,p) |
++ |
|
SHC |
H-Cl |
* |
|
|
CEP-4G |
H-Rn |
* (Li-Ar only) |
|
|
CEP-31G |
H-Rn |
* (Li-Ar only) |
|
|
CEP-121G |
H-Rn |
* (Li-Ar only) |
|
|
LanL2MB |
H-Ba, La-Bi |
|
|
|
LanL2DZ |
H, Li-Ba, La-Bi |
|
|
|
SDD, SDDAll |
all but Fr and Ra |
|
|
|
cc-pV(DTQ5)Z |
H-He, B-Ne, Al-Ar, Ga-Kr |
included in definition |
added via AUG- prefix |
|
cc-pV6Z |
H, B-Ne |
included in definition |
added via AUG- prefix |
|
SV |
H-Kr |
|
|
|
SVP |
H-Kr |
included in definition |
|
|
TZV and TZVP |
H-Kr |
included in definition |
|
|
MidiX |
H, C-F, S-Cl, I, Br |
included in definition |
|
|
EPR-II, EPR-III |
H, B, C, N, O, F |
included in definition |
|
|
UGBS |
H-Lr |
UGBS(1,2,3)P |
|
|
MTSmall |
H-Ar |
|
|
|
DGDZVP |
H-Xe |
|
|
|
DGDZVP2 |
H-F, Al-Ar, Sc-Zn |
|
|
|
DGTZVP |
H, C-F, Al-Ar |
|
|
4-й учебный вопрос: Идея метода. Модель Томаса-Ферми
Теория функционала плотности (DFT, density functional theory) — один из основных методов расчета электронной структуры сложных систем. DFT является методом приближенного решения уравнения Шредингера для системы многих частиц. Так же как и метод Хартри-Фока (HF), DFT метод использует приближение Борна—Оппенгеймера. Благодаря своей универсальности и относительно небольшим затратам на проведение расчетов данный метод широко используется не только в вычислительной химии и физике, но и в минералогии и биологии.
Универсальность метода связана с тем, что в его основе весьма общие предположения. Как и метод HF, DFT пытается свести задачу многих частиц, которая требует вычисления функции, зависящей от очень большого числа переменных, к задаче, описывающей поведение только одной частицы. Центральная идея метода: использование наблюдаемой величины, называемой электронной плотностью, в качестве основной вычисляемой функции:
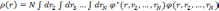
 (3.1).
(3.1).
Методу DFT предшествовала модель Томаса — Ферми, развитая. В рамках данной теории энергию атома рассчитывали как сумму его кинетической энергии, представленной в виде функционала электронной плотности, и потенциальной энергии взаимодействия электронов с ядром и друг с другом, при этом энергия взаимодействия также была выражена через электронную плотность.
Теория основана на предположении о том, что все электроны занимают одинаковый объем в фазовом пространстве, при этом каждый элементарный объем h3 занят двумя электронами. Тогда можно записать, что:
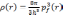
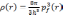 (3.2)
(3.2)
где
pf
— импульс Ферми. Это уравнение
можно разрешить относительно импульса
и записать выражение для максимальной
кинетической энергии электрона в месте,
где электронная плотность равна 
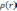 :
:
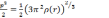
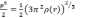 (3.3)
(3.3)
Если (r) — электрический потенциал в данной точке пространства(при r, φ0), то полная энергия электрона запишется в виде
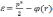
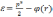 (3.4)
(3.4)
Полная энергия электрона в атоме должна быть отрицательной, причем максимальному импульсу соответствует отрицательная энергия, которую мы обозначим ,
то есть
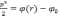
 .
(3.5)
.
(3.5)
Теперь, комбинируя (3.3) и (3.5), получаем уравнение, связывающее локальную электронную плотность и локальный потенциал:
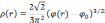
При
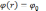
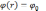 электронная
плотность нулевая
электронная
плотность нулевая 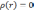
 — это значение r
определяет границу атома. Электрическое
поле вне нейтрального атома также
отсутствует (по теореме Гаусса), поэтому
нулевое значение потенциала простирается
от бесконечности
до границы атома r:
— это значение r
определяет границу атома. Электрическое
поле вне нейтрального атома также
отсутствует (по теореме Гаусса), поэтому
нулевое значение потенциала простирается
от бесконечности
до границы атома r:
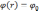
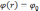 .
.
Поэтому мы приходим к выводу о том, что константа для нейтральных атомов
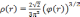

Подставив (3.7) в уравнение Пуассона, мы получим окончательное уравнение, описывающее поведение потенциала в атоме:
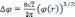
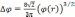
с граничными условиями
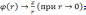
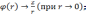
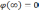
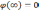
Это уравнение может быть численно проинтегрировано, причем распределение электронной плотности в атомах с разным порядковым номером оказывается подобным. На самом деле это, конечно же, не так. Применимость метода Томаса-Ферми ограничена квазиклассическим приближением, согласно которому в каждой клетке фазового пространства объемом находится по 2 электрона.
Поль Дирак уточнил функционал энергии в модели Томаса — Ферми, добавив к нему слагаемое, описывающее обменное взаимодействие (это слагаемое также имело вид функционала электронной плотности), но, несмотря на это, для ряда применений модель Томаса — Ферми — Дирака не давала удовлетворительного результата. Основным источником погрешности являлось выражение кинетической энергии, приводящее к погрешности в вычислении обменной энергии. Кроме того, не учитывалась энергия электронной корреляции.
5-й учебный вопрос: теоремы Хоэнберга-Кона
DFТ базируется на модели Томаса-Ферми, но обоснование для нее было подведено только в теоремах Хоэнберга-Кона. Эти теоремы - основа DFT метода. Первая теорема - теорема существования. Вторая теорема– вариационный принцип квантовой механики сформулированный для функционала плотности.
Теорема 1: Существует взаимно однозначное соответствие между плотностью основного состояния электронной подсистемы, находящемся во внешнем потенциале атомных ядер, и самим потенциалом ядер.
Теорема 2: Энергия электронной подсистемы, записанная как функционал электронной плотности, имеет минимум, равный энергии основного состояния.
Традиционные методы определения электронной структуры, в частности, метод HF и производные от него, описывают систему многоэлектронной волновой функцией. Основная цель теории функционала плотности — при описании электронной подсистемы заменить многоэлектронную волновую функцию электронной плотностью. Это ведет к существенному упрощению задачи, поскольку многоэлектронная волновая функция зависит от 3N переменных — по 3 пространственных координаты на каждый из N электронов, в то время как плотность — функция лишь трёх пространственных координат.
Как правило, метод DFT используется с формализмом Кона — Шэма, в рамках которого задача об описании нескольких взаимодействующих электронов в статическом внешнем поле (атомных ядер) сводится к более простой задаче о независимых электронах, которые движутся в некотором эффективном потенциале. Этот эффективный потенциал включает в себя статический потенциал атомных ядер, а также учитывает кулоновские эффекты, в частности, обменное взаимодействие и электронную корреляцию.
Описание двух последних взаимодействий и представляет собой основную сложность метода теории функционала плотности в формулировке Кона — Шэма.
Простейшим приближением здесь является приближение локальной плотности, основанное на точном расчёте обменной энергии для пространственно однородного электронного газа, который может быть выполнен в рамках модели Томаса — Ферми и из которого можно получить также и корреляционную энергию электронного газа. В ряде случаев использование простого приближения локальной плотности дает результаты, соответствующие экспериментальным данным, причём вычислительная сложность метода невысока относительно других подходов к проблеме многих частиц в квантовой механике. В тоже время, метод был недостаточно точен для расчётов в области квантовой химии, пока в 1990-х годах не произошёл сдвиг в описании обменного и корреляционного взаимодействий.
В настоящее время DFT метод является одним из основных подходов в квантовой химии. Но, все ещё имеются проблемы в приложении метода к описанию межмолекулярных сил, в особенности ван-дер-ваальсовых сил и дисперсионного взаимодействия, а также в расчётах ширины запрещённой зоны в полупроводниках.
Сложности с учетом дисперсионного взаимодействия в рамках DFT (когда этот метод не дополняется другими) делают метод теории функционала плотности малопригодным для систем, где дисперсионные силы являются преобладающими (взаимодействия между атомами благородных газов) или сопоставимыми с другими взаимодействиями (в ряде органических структур). Решение этой проблемы является предметом современных исследований.
Рассмотрим уравнение Шредингера для системы электронов:
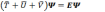
где оператор кинетической энергии электронов:
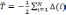
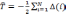
оператор, описывающий энергию взаимодействия электронов:
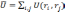

а оператор потенциальной энергии, описывающий взаимодействие электронов с ядрами:

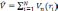
Очевидно,
что первые два оператора универсальны
для всех систем и каждая конкретная
система отличается от остальных только
оператором 
 .
.
Фактически, теорема Хоэнберга—Кона означает, что выражение может быть обращено, то есть по заданной плотности частиц в основном состоянии, можно найти соответствующую волновую функцию основного состояния. Можно записать, что:
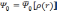
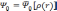 ,
,
Благодаря
этому можно утверждать, что все наблюдаемые
физические величины также являются
функционалами. Если 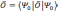
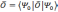

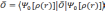 .
.
Тогда,
согласно теореме Хоэнберга—Кона, для
основного состояния электронной системы,
находящейся в ядерном потенциале
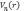
 существует
универсальный функционал
существует
универсальный функционал 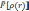
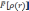 ,
не зависящий от системы, действующий
на электронную плотность, который
определяет полную энергию системы как
,
не зависящий от системы, действующий
на электронную плотность, который
определяет полную энергию системы как
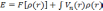
 .
.
Используя
это выражение, можно было бы найти 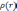
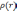 ,
используя вариационный принцип. В тоже
время, так как форма функционала
,
используя вариационный принцип. В тоже
время, так как форма функционала 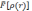
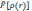 точно
не известна, необходимы дальнейшие
предположения.
точно
не известна, необходимы дальнейшие
предположения.
6-й учебный вопрос: Приближение локальной электронной плотности(LDA)
Наиболее часто используемой аппроксимацией является приближение локальной электронной плотности (local density approximation, LDA). Впервые оно было сформулировано Коном и Шэмом в 1965 году. В этом приближении функционал записывается в виде:
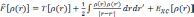
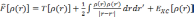
где
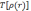
 —
электронная кинетическая энергия, а
—
электронная кинетическая энергия, а
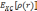
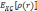 —
функционал обменно-корреляционной
энергии, выражающийся как:
—
функционал обменно-корреляционной
энергии, выражающийся как:

 ,
,
где

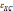 —
обменная и корреляционная энергия на
одну частицу электронного газа. Именно
потому, что в этом приближении
обменно-корреляционная энергия зависит
от локальной плотности заряда в точке,
приближение носит такое название.
—
обменная и корреляционная энергия на
одну частицу электронного газа. Именно
потому, что в этом приближении
обменно-корреляционная энергия зависит
от локальной плотности заряда в точке,
приближение носит такое название.
Корреляционный функционал вообще говоря является суммой корреляционного и обменного вкладов:
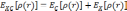
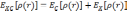 .
.
В LDA приближении обмен вычисляется как для однородного газа с плотностью, равной плотности в точке (LDA подходит для медленно меняющихся плотностей):
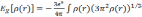
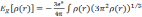 .
.
Применяя
к (3.17) вариационный принцип и учитывая,
что электронная плотность 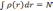
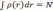 нормирована на число частиц, получим
уравнение:
нормирована на число частиц, получим
уравнение:
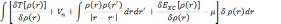
где — множитель Лагранжа. Можно определить электронную
плотность с помощью волновых функций уровней:
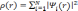
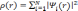 ,
(3.23)
,
(3.23)
тогда кинетическую энергию можно определить следующим образом:

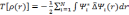
Тогда решение уравнения (3.22) является решением одноэлектронного уравнения Шредингера:
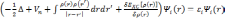
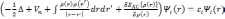 .
.
Эти уравнения называются уравнениями Кона-Шэма. Соответственно их решения являются одноэлектронными волновыми функциями, а собственные значения — энергиями соответствующих состояний.
Уравнение вообще говоря, нелинейно, так как оператор Гамильтона сам зависит от решения, поэтому для получения решения необходимо применять самосогласованный итерационный метод.
Стоит
отметить, что 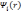
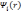 не
являются спин-орбиталями в приближении
HF, поэтому детерминант
Слэтера, составленный из них, не будет
волновой функцией системы в приближении
HF. Несмотря на это, плотность
заряда, выражаемая через
не
являются спин-орбиталями в приближении
HF, поэтому детерминант
Слэтера, составленный из них, не будет
волновой функцией системы в приближении
HF. Несмотря на это, плотность
заряда, выражаемая через 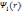
 ,
является правильной.
,
является правильной.
Для
того чтобы рассчитать полную энергию
и электронную плотность методом DFT,
необходимо вычислить орбитали 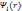
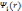 ,
которые являются решением уравнения.
Для того, чтобы записать это уравнение
необходимо знать ядерный потенциал
,
которые являются решением уравнения.
Для того, чтобы записать это уравнение
необходимо знать ядерный потенциал

 (который мы задаем при формулировке
задачи), электронный потенциал
(который мы задаем при формулировке
задачи), электронный потенциал 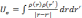
 и
корреляционный вклад.
и
корреляционный вклад. 
 можно определить, решив уравнение
Пуассона:
можно определить, решив уравнение
Пуассона:

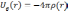 .
.
Также необходимо уравнение для вычисления корреляционного вклада. Таким образом, мы получим систему уравнений, решив которую, мы получим электронную плотность.
Поскольку система является нелинейной, основным методом ее решения является итерационный. На первом шаге каким-либо образом выбирается и фиксируется начальная электронная плотность 0(r).
После
этого для нее решается система уравнений,
что дает набор 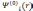
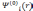 .
Затем, используя (3.23), можно вычислить
новую электронную плотность и повторить
процесс. Эти итерации необходимо
повторять до тех пор, пока
.
Затем, используя (3.23), можно вычислить
новую электронную плотность и повторить
процесс. Эти итерации необходимо
повторять до тех пор, пока 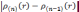
 будет меньше выбранной погрешности.
Полученная электронная плотность будет
искомой. После этого можно вычислить
полную энергию по формуле:
будет меньше выбранной погрешности.
Полученная электронная плотность будет
искомой. После этого можно вычислить
полную энергию по формуле:
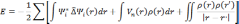
Используя вычисленные величины можно применить процедуры для вычисления различных свойств. Как было сказано выше, приближение LDA рассчитано на системы с медленно меняющейся электронной плотностью. Несмотря на это, она довольно точна и для систем с быстро меняющейся плотностью, например, твердых тел. К сожалению, для задач квантовой химии LDA оказывается недостаточно точной. К тому же она не учитывает спиновые корреляции.
