
- •«Утверждаю»
- •Краткая теория.
- •Сериальные закономерности в спектре водорода
- •1. Электрон в атоме может вращаться только по строго определенным орбитам, радиусы которых определяются из условия:
- •2. Вращаясь по стационарным орбитам, электрон не излучает и не поглощает электромагнитных волн.
- •Порядок выполнения работы.
- •1. Допуск к выполнению работы.
Тверской государственный университет
Кафедра общей физики Учебная лаборатория «Атомной физики
«Утверждаю»
Заведующий кафедрой общей физики
профессор Орлов Ю.Д.
« » 200 г.
Лабораторная работа № 1
СПЕКТРАЛЬНЫЕ ЗАКОНОМЕРНОСТИ АТОМА ВОДОРОДА ОПРЕДЕЛЕНИЕ ПОСТОЯННОЙ РИДБЕРГА.
ТВЕРЬ 200
Цель работы: Изучение спектра атома водорода. Определение постоянной Ридберга.
Оборудование: Спектрограф ИСП-30, источники света- ртутная лампа и водородная газовая трубка.
Краткая теория.
Атомы и ионы, находящиеся в свободном состоянии, испускают характерные линейчатые спектры, состоящие из большого числа дискретных спектральных линий. Условия для возбуждения таких спектров создаются во многих источниках света, в которых вещество находится в достаточно разреженном (газообразном или парообразном) состоянии, например в пламенах, электрической дуге или искре, а также в различных типах газового разряда.
Излучаемые спектры тесно связаны с внутренним строением атомов и несут информацию о строении их электронных оболочек, а также о ряде свойств атомных ядер.
Каждая линия в спектре атома характеризуется длиной волны, обычно
измеряемой
в ангстремах (1А0
= 10-8
см), или волновым числом
![]()
, а также интенсивностью. Длина волны спектральной линии и вероятность излучения определяются свойствами атомной системы.
При изменении энергии атома происходит излучение или поглощение фотона, частота которого определяется фундаментальным соотношением Бора:
![]() ,где
Е1
и Е2 — энергии
двух различных состояний атомной
системы.
,где
Е1
и Е2 — энергии
двух различных состояний атомной
системы.
Энергетические состояния атома систематизируются в соответствии с законами квантовой механики. Если на атом или молекулу не воздействуют внешние поля или частицы, то состояния, в которых могут находиться электроны, определяются потенциальным полем, создаваемым зарядами, образующими атом. Поле остается неизменным во времени, поэтому такие состояния называются стационарными. Стационарным состояниям электрона соответствуют значения энергии Е1,Е2., Е3, ..., Еn.
Энергия стационарных состояний непосредственно связана с квантово-механическими параметрами, характеризующими строение электронной оболочки атома — квантовыми числами. Для полного определения стационарного состояния электрона необходимо столько квантовых чисел, сколько степеней свободы имеет электрон в атоме. Используют пять квантовых чисел, из которых независимыми являются четыре: n, l, т, т,.
Главное квантовое число п определяет энергию данного стационарного состояния или номер оболочки, к которой принадлежит электрон (энергетический уровень):
![]() (1)
(1)
где т и е - масса и заряд электрона, h - постоянная Планка.
Главное квантовое число может принимать любые целые положительные значения: п= 1,2,3, — Все возможные состояния электрона, характеризуемые одним и тем же главным квантовым числом, образуют так называемый электронный слой (оболочку). На каждой электронной оболочке может находиться не более 2n2 электронов. Оболочку, содержащую предельно возможное число электронов, называют заполненной.
Выражение
(1) справедливо для точечного неподвижного
ядра. Учет движения ядра сводится к
замене величины т
в
(1) на приведенную массу электрона
 где
М- масса ядра.
где
М- масса ядра.
Орбитальное или азимутальное квантовое число l определяет абсолютную величину момента количества движения электрона на орбите:
![]() (2)
(2)
Для каждой электронной оболочки, определяемой главным квантовым числом п, возможно несколько электронов с различными орбитальными числами l = 0, 1,2, ..., (n-1). Состояния электронов со значениями l = 0, 1,2, 3, ... принято обозначать символически буквами s, р, d, l, .... Эти состояния соответственно называются s-состояниями, p-состояниями и т.д.
Энергетические уровни, которым соответствует несколько различных состояний, называются вырожденными (кратными). Такой энергетический уровень можно представить состоящим из нескольких простых уровней. Число, показывающее, какому количеству различных состояний соответствует одинаковая энергия, указывает кратность вырождения и называется статистическим весом уровня g.
Орбитальное магнитное квантовое число т определяет пространственную ориентацию орбит, иными словами, определяет проекцию орбитального момента количества движения вектора l на выбранное направление (направление внешнего магнитного поля). Оно может принимать при заданном l целочисленные значения т = 0, ±1, ±2, ..., ±l, т.е. для каждого заданного значения l возможны 2l + 1 значений т и, следовательно, столько же различных состояний электрона.
Величина
проекции орбитального момента электрона
на выбранное направление (совпадающее,
например, с осью z)
определяется
выражением:
![]()
Спиновое квантовое число s определяет абсолютную величину собственного момента количества движения электрона (спина):
![]() (3)
(3)
и принимает единственное значение , s =1/2.
Проекция спинового момента электрона на направление внешнего магнитного поля определяется квантовым числом ms!, которое принимает два значения: +1/2 и -1/2 , то есть
![]() что
соответствует расположению спина
электрона во внешнем поле по направлению
этого поля или против.
что
соответствует расположению спина
электрона во внешнем поле по направлению
этого поля или против.
В ряде случаев, в частности для описания тонкой структуры энергетических уровней, удобнее пользоваться другой четверкой квантовых чисел п, l, j и mj.
Квантовое
число j
характеризует абсолютную величину
полного момента количества движения
электрона
![]() и
определяется соотношением
и
определяется соотношением
![]() (4)
(4)
Оно может принимать значения j=l+1/2, j=l-1/2.
Квантовое число mj характеризует проекцию на ось z.
Согласно принципу Паули у атома не может быть двух или более электронов, все квантовые числа которых одинаковы. Отсюда следует определенный закон распределения электронов по квантовым состояниям (Таблица 1).

Совокупности электронных состояний с заданным значением п и любыми возможными значениями 1, m, ms образуют конкретный слой (оболочку).
Различные оболочки часто идентифицируются не квантовым числом п, а специальными обозначениями согласно следующему правилу:
Обозначение К L M N О
Состояния с одинаковыми квантовыми числами n и l принадлежат одной подоболочке. Подоболочки обычно обозначаются сочетанием числа и буквенного символа. Так, 3р обозначает n=3, l=1.
Для атома с одним валентным электроном состояние электрона одновременно определяет и состояние атома. Поэтому состояние такого атома может быть обозначено тем же символом, что и состояние электрона.
Конфигурация электронов в многоэлектронных атомах фиксируется путем последовательного написания символов для всех электронов.
Например, одиннадцать электронов натрия составляют конфигурацию Is22s22p63s. Числа справа сверху от l обозначают число электронов, имеющих данные значения п и l.
Атомы большинства веществ — многоэлектронные системы. Электроны в них находятся в усредненном электрическом поле, создаваемом ядром и остальными электронами. Поэтому электронная конфигурация в многоэлектронных атомах и ионах определяется суммарными квантовыми числами L , S и j, которые зависят от типа взаимодействия между электронами.
Для атомов с небольшим числом валентных электронов справедлива схема сложения моментов по Расселу-Саундерсу (электростатическое взаимодействие).
В этом
случае общий орбитальный момент
количества движения всей электронной
оболочки определяется правилом
![]()
Суммарный
спиновый момент электронной оболочки
определяется правилом
![]()
Моменты L и S складываются векторно в полный момент атома (рис. 1).
 Такой тип связи носит название нормальной
илиLS
связи. В частности этот
Такой тип связи носит название нормальной
илиLS
связи. В частности этот
тип связи справедлив для всех конфигураций, в которых есть два электрона в дополнение к заполненным подоболочкам.
Взаимодействие магнитных моментов электронов, которое в случае
нормальной связи является слабым, приводит к прецессии векторов L и S вокруг j — полного момента количества движения атома.
Численные значения результирующих моментов находятся через квантовые числа L, S ,j следующим образом:
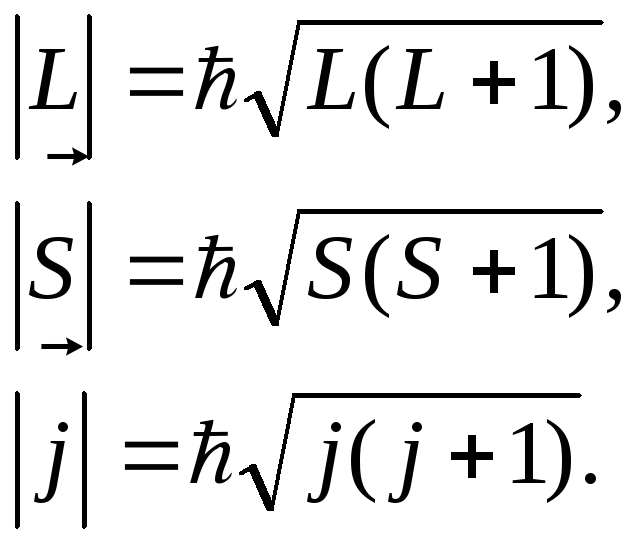 (5)
(5)
Квантовое
число L
принимает
значения, отличающиеся друг от друга
на единицу в пределах между![]()
Аналогичным
образом квантовое число S
может
принимать значения, отличающиеся на
единицу в пределах между максимальным
и минимальным значением суммы![]()
Внутреннее квантовое число j, определяющее результирующий полный момент j, в силу различной возможной ориентации векторов L и S принимает значения
j = L + S, L + S-1, L + S-2, ...,L-S.
Уровни с одинаковыми значениями L и S, но разными j обычно находятся очень близко друг к другу, как говорят, они образуют мультиплет. Число уровней в мультиплете равно меньшему из чисел 2S+1 и 2L+1. Мультиплет называется синглетом, дублетом, триплетом, квартетом и т.д., даже если число 1L+1 меньше 2S+1. Так, единственный уровень с S=1 и L=0 называется триплетом.
Энергетические уровни и собственные состояния энергии, идентифицируемые квантовыми числами L, S и j, принято обозначать спектроскопическими символами. «Главным» символом является прописная буква, символизирующая значение L согласно следующей таблице:
![]()
Значение S указывается левым верхним индексом, численно равным мультиплетности 2S+1 уровня. Справа внизу записывается значение j.
В заполненных оболочках моменты отдельных электронов компенсируют друг друга. Поэтому для них L = 0, S = 0 и, следовательно, j = 0 . В силу этого заполненные оболочки не участвуют в образовании термов путем сложения орбитальных и спиновых моментов электронов. Если электроны заполненных оболочек не совершают переходов на другие уровни, то в обозначении состояния атома они могут быть опущены. Например, обозначение резонансного терма атома магния с полной записью электронной конфигурации имеет вид:
1s22s22p63s23p.
Опуская обозначения заполненных оболочек, данный терм записывают как 32p 1/2, то есть сохраняют лишь символ оптического электрона, если это не может привести к неоднозначности обозначения.
Квантовые числа L и S полностью определяют состояние атома (спектроскопический терм Рассела-Саундерса).
Оптические переходы между мультиплетными термами нормальной связи подчиняются правилам отбора, которые разрешают переходы со следующим изменением квантовых чисел:
![]()
Второе
из этих правил носит название
интеркомбинационного запрета. Оно
запрещает переходы между термами
различной мультиплетности. Разрешенные
переходы с испусканием или поглощением
излучения происходят между состояниями
с одинаковыми значениями 2S+1.
Кроме рассмотренной LS-связи
электронов
существуют и другие типы взаимодействий.
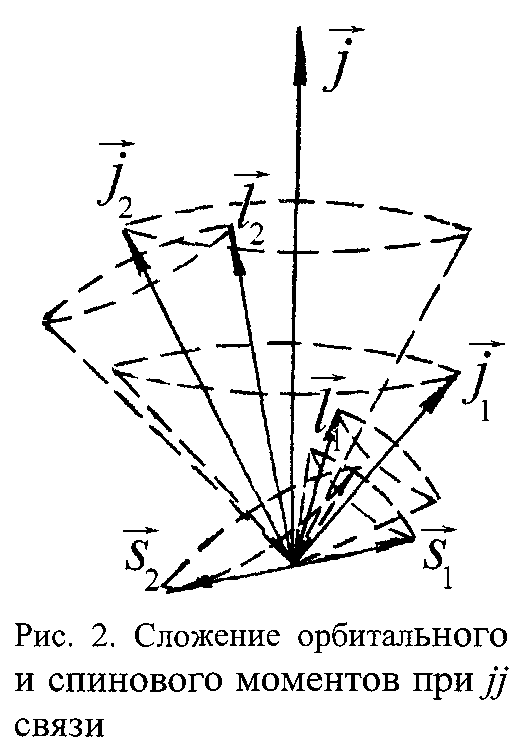
Для атомов с большим числом валентных
электронов справедлив такой тип
взаимодействия между электронами, когда
моменты каждого электрона
![]() складываются в результирующий полный
момент (рис. 2):
складываются в результирующий полный
момент (рис. 2):
![]() .
Полный момент атома в целом определяется
векторным соотношением
.
Полный момент атома в целом определяется
векторным соотношением
![]() Тип
взаимодействия, отвечающий такой схеме
сложения моментов, называется jj-связью.
Он характерен для возбужденных состояний
атомов с большим числом электронов.
Тип
взаимодействия, отвечающий такой схеме
сложения моментов, называется jj-связью.
Он характерен для возбужденных состояний
атомов с большим числом электронов.
 КромеLS-
и
jj-связей
электронов в атомах существуют еще
промежуточные связи, соответствующие
промежуточным схемам сложения
моментов.
КромеLS-
и
jj-связей
электронов в атомах существуют еще
промежуточные связи, соответствующие
промежуточным схемам сложения
моментов.
Совокупность возможных стационарных состояний атома иона и молекулы принято изображать графически в виде диаграмм энергетических уровней. Это рисунок, на котором в определенном масштабе по вертикали раздельными горизонтальными линиями показаны значения энергии, которыми может обладать атом. Каждый из энергетических уровней маркируется специальным символом, который позволяет установить важнейшие параметры энергетических состояний атома. Эти уровни и расстояния между ними различны для различных химических элементов, но одинаковы для всех атомов данного элемента, хотя уровни изотопов одного элемента несколько смещены.
Диаграмма энергетических уровней является индивидуальной характеристикой данного типа квантовой системы. Линии, соединяющие отдельные уровни, дают наглядное представление о спектральных переходах издумающих атомов при скачкообразном изменении энергии атома от состояния, характеризуемого энергией верхнего уровня, до состояния, характеризуемого энергией нижнего уровня.
На рис. 3 представлена диаграмма энергетических уровней атома водорода.
Среди состояний атома имеется такое, в котором его энергия минимальна. Это состояние устойчивого равновесия. Система, выведенная из подобного состояния, стремится вернуться в исходное состояние равновесия. Квантово-механическое состояние с наименьшей энергией называется основным или нормальным. На диаграммах энергетических уровней вещества энергия основного состояния обычно принимается за начало отсчета.
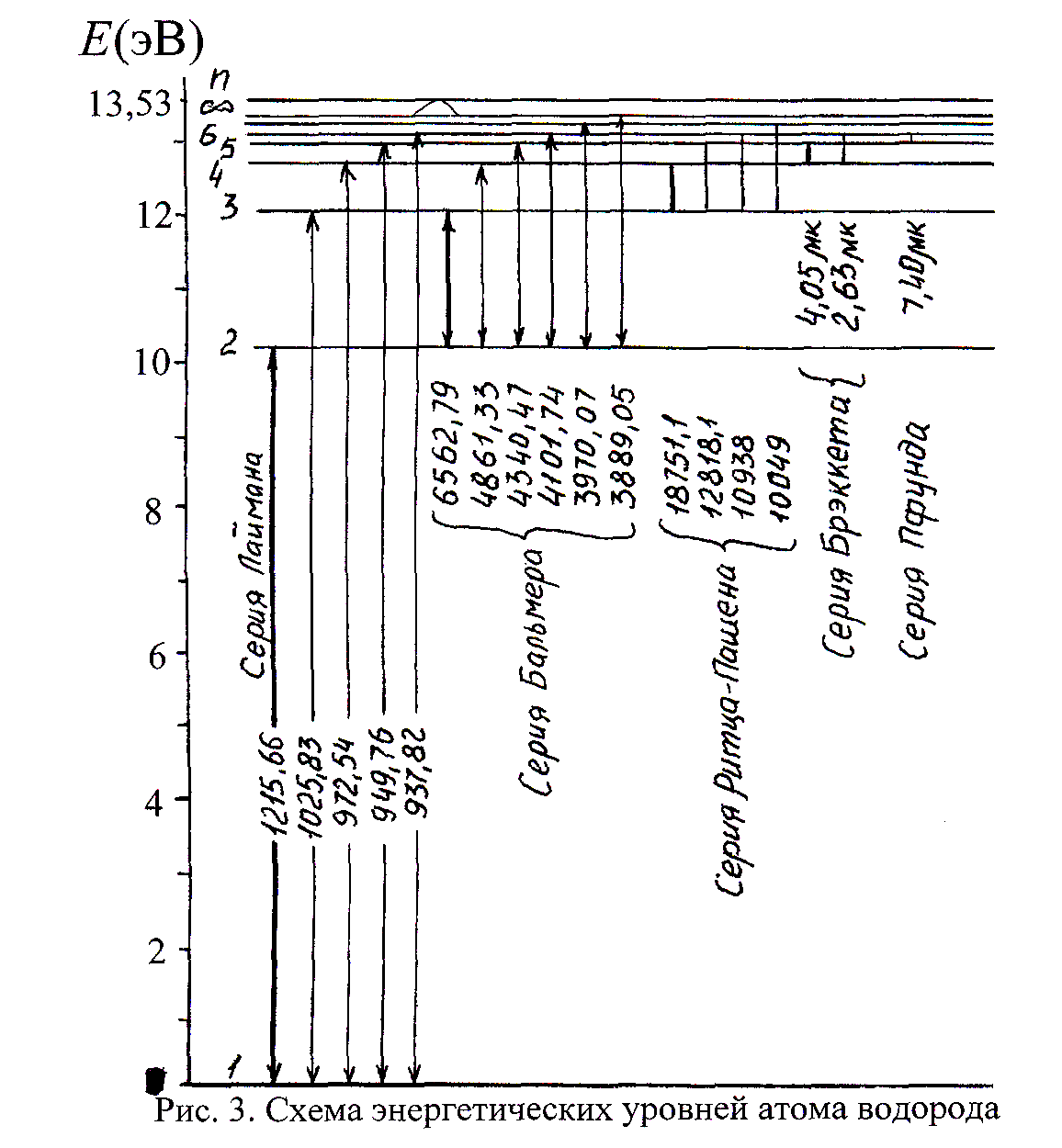
Остальные состояния считаются возбужденными. Возбужденные состояния неустойчивы. Под действием возмущения квантовая система из возбужденного состояния стремится в основное состояние.
