
- •Реферат
- •Влияние концентраций веществ на скорость химической реакции.
- •Влияние давления на скорость химической реакции.
- •Влияние давления на скорость химической реакции. (Дополнительный материал).
- •Влияние поверхности соприкосновения реагентов на скорость химической реакции.
- •Влияние поверхности соприкосновения реагентов на скорость химической реакции. Дополнительный материал.
- •Влияние природы реагентов на скорость химической реакции.
- •Влияние природы реагентов на скорость химической реакции. Дополнительный материал.
- •Влияние температуры на скорость химической реакции
- •Влияние температуры на скорость химической реакции. Дополнительный материал. Правило Вант-Гоффа
- •Энергия активации
- •Катализ и ингибирование.
- •Катализ и ингибирование. Дополнительный материал.
|
|
Реферат
по химии на тему
«Скорость химических реакций».
Содержание.
Скорость химической реакции. Определение.
Влияние концентрации веществ на скорость химической реакции.
Влияние давления на скорость химической реакции.
Влияние давления на скорость химической реакции. (Дополнительный материал).
Влияние поверхности соприкосновения реагентов на скорость химической реакции.
Влияние поверхности соприкосновения реагентов на скорость химической реакции. (Дополнительный материал).
Влияние природы реагентов на скорость химической реакции.
Влияние природы реагентов на скорость химической реакции. (Дополнительный материал).
Влияние температуры на скорость химической реакции.
Влияние температуры на скорость химической реакции. (Дополнительный материал).
Катализ и ингибирование.
Катализ и ингибирование. (Дополнительный материал).
Скорость химической реакции. Определение.
Химические реакции протекают с разными скоростями. Из известных на сегодняшний день реакций самая быстрая протекает в 1040 раз быстрее, чем самая медленная. Превращение графита в алмаз в недрах Земли - очень медленная реакция. А взрыв смеси кислорода с водородом происходит практически мгновенно.
Как сравнить скорости реакций количественно?
Скорость - это изменение некоторой величины во времени.
Рассмотрим реакцию:
H2 + I2 = 2HI
Попробуем определить скорость этой реакции по расходованию реагентов в единицу времени. Например, так:
v(H2) = m(H2)/Dt, v(I2) = m(I2)/Dt
где v - скорость реакции, m - убыль массы соответствующего реагента, Dt - отрезок времени.
Но v(H2) не равно v(I2). Ведь массы водорода и иода, прореагировавших в единицу времени, не равны.
Реакция идет в мольном соотношении 1:1, а не в массовом! Попробуем по-другому:
v(H2) = n(H2)/Dt, v(I2) = n(I2)/Dt
взяв вместо масс количества веществ.
v(H2) = v(I2)
Но если в первом случае мы возьмем убыль числа молей в единицу времени в 1 мл смеси, а во втором - в 1 л смеси, то скорости снова не будут равны! Они зависят от объема. Если проводить одну и ту же реакцию в маленькой пробирке и в большой бочке, то в пробирке прореагирует меньшее количество вещества - просто потому, что там меньше реагента.
А если привести эти выражения к единице объема?
v(H2) = n(H2)/VDt = Dc(H2)/Dt, v(I2) = n(I2)/VDt=Dc(I2)/D t
где Dc изменения молярных концентраций соответствующих веществ.Тогда vH2 = vI2 = v данной реакции!
Таким образом, конечное определение будет:
|
Скорость химической реакции - это изменение молярной концентрации одного из участвующих в реакции веществ в единицу времени: v = Dc/Dt [моль/литр*сек] |
В принятом определении есть два нюанса!
Нюанс 1:
Это выражение
v = Dc/Dt
позволяет определить лишь среднюю скорость реакции за выбранный отрезок времени. Ученых же, как правило, интересует скорость в выбранный момент времени, т.е. так называемая мгновенная скорость реакции. Она определяется как производная функции c(t):
v = dc/dt
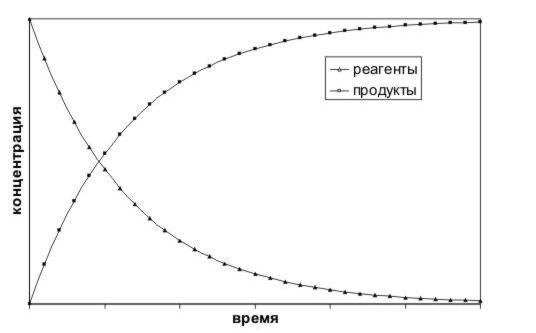
Если мы определяем скорость реакции по одному из реагентов, то знак производной c(t) отрицателен, т.к. концентрации реагентов убывают. Но по физическому смыслу скорость не может быть отрицательной величиной. Поэтому при использовании концентраций реагентов:
v = -dc/dt
Нюанс 2:
Определим скорость этой же реакции
H2 + I2 = 2HI
не по уменьшению концентрации реагента, а по увеличению концентрации продукта:
v(HI) = dc(HI)/dt
У нас получилось, что v(H2) = v(I2), но не равно v(HI)! Ведь при уменьшении концентраций водорода и иода, например, в 3 раза концентрация иодоводорода возрастает в 9 раз (это видно по коэффициентам в уравнении реакции). Чтобы скорости стали равными (и можно было говорить о единой скорости реакции), изменение концентрации HI в единицу времени следует поделить на стехиометрический коэффициент при HI:
v(HI) = dc(HI)/2dt
В общем случае для реакции
aA + bB = eE + fF
значение скорости определяется как:
v = -dc(A)/adt = -dc(B)/bdt = dc(E)/edt = dc(F)/fdt
