
- •Основные законы и формулы обучения физике Справочник для студентов всех форм обучения с техническим уклоном, преподавателей и абитуриентов.
- •Оглавление
- •Предисловие
- •Кинематика
- •2. Динамика
- •3. Законы сохранения
- •4. Законы вращательного движения
- •5. Гармонические колебания
- •6. Элементы молекулярной физики и термодинамики.
- •7. Элементы механики жидкостей
- •8. Элементы теории относительности
- •9. Электрическое поле
- •10. Электроёмкость. Конденсаторы
- •11. Законы постоянного тока
- •12. Магнитное поле тока. Электромагнитная индукция.
- •13. Магнитное поле катушки
- •14. Сила Лоренца
- •15. Электромагнитные колебания
- •16. Переменный ток
- •17. Оптика. Квантовая природа излучения.
- •18. Элементы физики атомного ядра.
5. Гармонические колебания
 =2
=2 = 2
= 2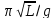 – период колебаний физического
маятника.
– период колебаний физического
маятника.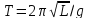 –период
колебаний математического маятника.
–период
колебаний математического маятника.
Характеристики
гармонического свободного колебания
материальной точки (массы на пружине),
совершаемого по закону
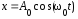 ,
при
,
при
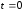 ,
,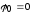 .
Здесь индексом 0 обозначены максимальные
(амплитудные) значения величин (
.
Здесь индексом 0 обозначены максимальные
(амплитудные) значения величин (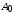 ,
,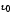 ,
,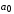 ,
,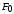 ,
,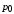 ,
,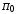 ,
,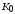 ).
).
Скорость м.т.
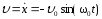 ,
где
,
где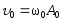 .
.Ускорение м.т.
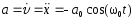 ;
;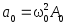 .
.Возвращающая сила, действующая на м.т.,
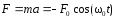 ;
;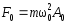 .
.Импульс м.т.
 ;
;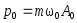 .
.Кинетическая энергия м.т.
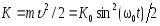 ;
;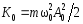
Среднее значение кинетической энергии м.т. за один период
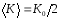 .
.Потенциальная энергия м.т.
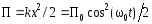 ;
;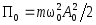
Среднее значение потенциальной энергии м.т.
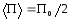 .
.
Колебание
м.т. совершается по закону
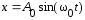 ,
при
,
при
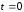 ,
,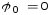 .
.
Скорость м.т.
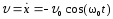 ,
где
,
где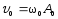 .
.Ускорение м.т.
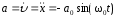 ;
;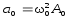 .
.Возвращающая сила, действующая на м.т.
 ;
;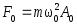 .
.Импульс м.т.
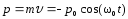 ;
;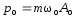 .
.Кинетическая энергия м.т.
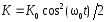 ;
;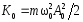 .
.Потенциальная энергия м.т.
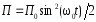 ;
;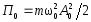 .
По закону сохранения механической
энергии максимальные значения
.
По закону сохранения механической
энергии максимальные значения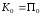 ,
средние значения за период
,
средние значения за период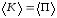 .
Полная энергия колеблющейся м. т. равна
.
Полная энергия колеблющейся м. т. равна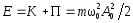 .
Так как
.
Так как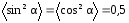 ,
,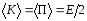 .
.
6. Элементы молекулярной физики и термодинамики.
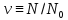 –определение
количества вещества (N0
– число Авогадро).
–определение
количества вещества (N0
– число Авогадро).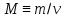 –определение
молярной массы вещества (m
– масса вещества).
–определение
молярной массы вещества (m
– масса вещества).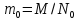 –масса
молекулы.
–масса
молекулы. –число
молекул, содержащихся в произвольном
количестве вещества.
–число
молекул, содержащихся в произвольном
количестве вещества.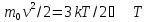 –определение
абсолютной температуры идеального
газа (ИГ).
–определение
абсолютной температуры идеального
газа (ИГ).p = 2/3 nε; pV = 2/3 Ek; pV = mυ2/3 – основные уравнение молекулярно–кинетической теории идеального газа, где p – давление газа, n – число молекул в единице объема, ε – средняя кинетическая энергия поступательного движения молекул, V – объем газа, Eк – суммарная кинетическая энергия поступательного движения всех молекул газа, m – масса газа, υ – средняя квадратичная скорость молекул.
pV0 = RT; pV = mRT/M – уравнение Менделеева – Клапейрона, где V0 – молярный объем, T – температура, R – молярная газовая постоянная, V – объем газа, m – масса газа, m/M = ν – количество вещества, М – молекулярная масса.
 –уравнение
состояния ИГ.
–уравнение
состояния ИГ.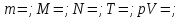 –закон
Бойля – Мариотта.
–закон
Бойля – Мариотта. –закон
Гей–Люссака.
–закон
Гей–Люссака.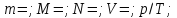 –закон
Шарля.
–закон
Шарля. 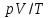 –объединенный
газовый закон.
–объединенный
газовый закон.р = nĸT ; p = 2/3 nε; p = ρυ2/3; p = mυ2/3V – давление газа, где
k = R/N0 ,k – постоянная Больцмана, N0 – постоянная Авагадро,
ρ – плотность газа.
n = N0p/RT; N = N0pV/RT; ρ = Mp/RT; m = MpV/RT – концентрация молекул n , число молекул N.
ν = m/M; ν = V/V0; ν = n/n0; ν = pV/RT; ν = U/U0; ν = N/N0 – количество вещества ν (моль), где U0 – внутренняя энергия (1 моль), U – внутренняя энергия ν моль газа.
V0 = M/ρ; ρ = m/V; v' = V/m; N0 = N/
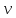 ;m0
= M/N0;
D
;m0
= M/N0;
D
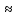 (1/3)ℓ υ – молярный
объем газа V0,
плотность
газа ρ,
удельный
объем газа v',
m0
– масса
одной молекулы,
D – коэффициент
диффузии молекул.
(1/3)ℓ υ – молярный
объем газа V0,
плотность
газа ρ,
удельный
объем газа v',
m0
– масса
одной молекулы,
D – коэффициент
диффузии молекул. ε =m0υ2/2 = 3/2kT; ε = 3pV0/2N0 – средняя кинетическая энергия поступательного движения молекулы.
U0 = iRT/2 = εN0; U0 = Mυ2/2; U = mυ2/2; U = iνRT/2 = =εN0ν; U = ipV/2 – внутренняя энергия идеального газа, где i – число степеней свободы.
 –закон
распределения молекул ИГ по скоростям.
Продифференцировав f(v)
по скорости, приравняв к нулю, получим
–закон
распределения молекул ИГ по скоростям.
Продифференцировав f(v)
по скорости, приравняв к нулю, получим
 .
Откуда приN
=, M
=, следует с
.
Откуда приN
=, M
=, следует с
 ,
максимум
,
максимум и кривая смещается вправо
и кривая смещается вправо ,
и наоборот. Площадь под кривой
,
и наоборот. Площадь под кривой При условииT
=, i
=, N
=, с
При условииT
=, i
=, N
=, с
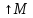 максимум
максимум и кривая смещается влево
и кривая смещается влево
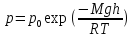 –барометричеcкая
формула, где
–барометричеcкая
формула, где
 – давление на высоте моря,
– давление на высоте моря,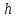 – высота над уровнем моря. Газы с
– высота над уровнем моря. Газы с exp
exp При условии
При условии
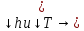
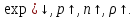 Тяжелые молекулы сосредоточены ближе
к Земле, легкие – выше над Землей.
Тяжелые молекулы сосредоточены ближе
к Земле, легкие – выше над Землей.QТ = A; QV = ∆U =
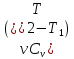 ;QР
= ∆U
+ A
=
;QР
= ∆U
+ A
=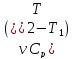 –первое
начало термодинамики для изотермического,
изохорического, изобарического
процессов, где Q
–количество теплоты, A
– работа газа.
–первое
начало термодинамики для изотермического,
изохорического, изобарического
процессов, где Q
–количество теплоты, A
– работа газа.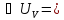 ν
ν A
= 0,
A
= 0,
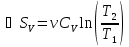 – изменение внутренней энергии, работа,
изменение энтропии при изохорическом
процессе.
– изменение внутренней энергии, работа,
изменение энтропии при изохорическом
процессе.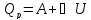 ;
;
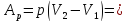 ν
ν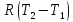 ;
;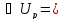 ν
ν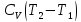 ;
;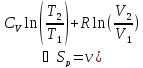 – первый закон термодинамики, работа,
изменение внутренней энергии, изменение
энтропии при изобарическом процессе.
– первый закон термодинамики, работа,
изменение внутренней энергии, изменение
энтропии при изобарическом процессе.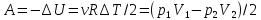 –работа
ИГ при адиабатическом процессе.
–работа
ИГ при адиабатическом процессе. –работа
газа при изобарном расширении.
–работа
газа при изобарном расширении.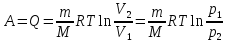 –работа
газа при изотермическом расширении.
–работа
газа при изотермическом расширении.∆Uv =
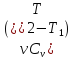 ;
∆Up
=
;
∆Up
=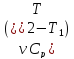 – изменение внутренней энергии
идеального газа, при постоянном объеме
и постоянном давлении.
– изменение внутренней энергии
идеального газа, при постоянном объеме
и постоянном давлении.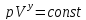 ,
,

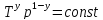 –уравнение
адиабатического процесса (уравнение
Пуассона).
–уравнение
адиабатического процесса (уравнение
Пуассона).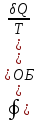 ;
;
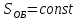 ;
; ;
;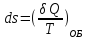 – энтропия, изменение энтропии при
обратимом (об) процессе.
– энтропия, изменение энтропии при
обратимом (об) процессе.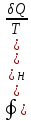 ;
;
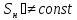 ;
;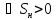 ;
;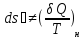 – энтропия, изменение энтропии при
необратимом (н) процессе.
– энтропия, изменение энтропии при
необратимом (н) процессе.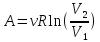 ,△U
= 0,
△
,△U
= 0,
△ – работа, изменение внутренней энергии
и изменение энтропии при изотермическом
процессе (m
=, M
=, N
=).
– работа, изменение внутренней энергии
и изменение энтропии при изотермическом
процессе (m
=, M
=, N
=).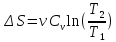 –изменение
энтропии при изохорическом (m
=, M
=, N
=)
процессе.
–изменение
энтропии при изохорическом (m
=, M
=, N
=)
процессе.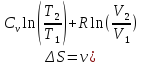 –изменение
энтропии при изобарическом (m
=, M
=, N
=) процессе.
–изменение
энтропии при изобарическом (m
=, M
=, N
=) процессе.Цикл Карно. Участки: T1 = const
 ,
∆Q
= 0
,
∆Q
= 0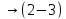 ,
,
T2
=
const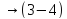 ,
∆ Q
= 0
,
∆ Q
= 0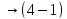
Параметры ИГ на участке 1 – 2 : Q > 0 ; A > 0 ; ∆ S > 0 ; T = ; V ↑ ; p ↓ ; U = ; ρ ↓; n ↓; υ = ; ε = ; l ↑; D ↑.
Параметры ИГ на участке 2 – 3: ∆ Q = 0 ; A > 0 ; ∆ S = 0 ; T ↓ ; V ↑ ; p ↓ ;
U ↓; ρ ↓; n ↓; υ ↓ ; ε ↓ ; l ↑.
Параметры ИГ на участке 3 – 4 : Q < 0 ; A < 0 ; ∆ S < 0 ; T = ; V ↓ ; p ↑ ;
∆U = ; ρ ↑ ; n ↑ ; υ = ; ε = ; l ↓; D ↓.
Параметры ИГ на участке 4 – 1 : Q = 0 ; A < 0 ; ∆ S = 0 ; T ↑ ; V ↓ ; p ↑ ; U ↑ ; ρ ↑; n ↑; υ ↑ ; ε ↑ ; l ↓; D↓.
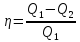 –термический
коэффициент полезного действия для
кругового процесса.
–термический
коэффициент полезного действия для
кругового процесса.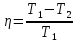 –термический
коэффициент полезного действия цикла
Карно.
–термический
коэффициент полезного действия цикла
Карно.
Теплоемкость
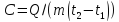 –определение
теплоемкости тела.
–определение
теплоемкости тела. –определение
удельной теплоемкости вещества.
–определение
удельной теплоемкости вещества.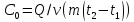 –определение
молярной теплоемкости вещества.
–определение
молярной теплоемкости вещества.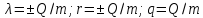 –определение
удельных теплот: плавления (кристаллизации),
парообразования (конденсации), сгорания
топлива.
–определение
удельных теплот: плавления (кристаллизации),
парообразования (конденсации), сгорания
топлива.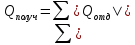 –уравнение
теплового баланса.
–уравнение
теплового баланса.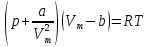 –уравнение
Ван–дер–Ваальса для моля реального
газа.
–уравнение
Ван–дер–Ваальса для моля реального
газа.
