
- •3. Газовые законы.
- •39. Дисперсионные системы. Их классификация.
- •61 Степень и константа гидролиза солей, образованных сильным основанием и слабой кислотой
- •62 Степень и константа гидролиза солей, образованных слабым основанием и сильной кислотой
- •63 Степень и константа гидролиза солей, образованных слабым основанием и слабой кислотой. Факторы, усиливающие гидролиз и подавляющие его.
- •64 Координационная теория комплексных соединений Вернера. Комплексообразователь, лиганды внутренняя сфера, координационные числа.
- •65 Классификация комплексных соединений.
- •1) По принадлежности к определенному классу соединений
- •2) По природе лигандов
- •3) По знаку заряда комплекса
- •66 Номенклатура комплексных соединений.
- •67 Изомерия комплексных соединений.
- •68 Природа химической связи в комплексных соединениях.
- •69 Константы нестойкости, константы образования. Возможности разрушения комплексных соединений.
- •70 Степень окисления. Важнейшие окислители и восстановители. Окислительно-восстановительная двойственность. Классификация овр.
- •71 Составление овр методами электронного и ионно-электронного баланса (метод полуреакций).
- •72 Влияние среды раствора на протекание овр.
- •73 Расчет молярной массы эквивалента окислителя и восстановителя.
- •75 Гальванический элемент Даниеля-Якоби. Электродвижущая сила, ее определение. Возможность и направление протекания овр.
- •76 Расчет изменения энергии Гиббса в результате овр.
- •77 Электролиз как ов-процесс. Электролиз расплавов и вод. Р-ров электролитов
- •79 Основные виды коррозии. Химическая коррозия. Электрохимическая коррозия. Борьба с коррозией металлов.
- •80 Методы защиты металлов от коррозии. Изоляция металлов отагрессивной среды, защитные покрытия. Электрохимические методы защиты. Изменение свойств коррозионной среды.
1. Эквивалент - это реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалентна одному катиону водорода или в ОВР одному электрону.
Фактор эквивалентности ƒэкв.(х) или 1/Z число, равное той доле частице Х, которая является эквивалентом вещества в данной реакции.( ƒэкв ≤ 1)
ƒэкв рассчитывают на основании стехиометрических коэффициентов реакции.
Например: H2S + 2Na OH = Na2S +H2O ƒэкв (H2S) =1/2
В этом случае одному катиону H+ эквивалентна условная частица, равная 1/2 молекулы H2S (участвуют оба иона водорода каждой молекулы).
Количество моль - эквивалентов измеряется в молях, как любое количество вещества. Масса 1 моль эквивалента, молярная масса эквивалента, равна произведению фактора эквивалентности на молярную массу вещества
M(ƒэкв (х) х) = ƒэкв (х) ∙ М(х)
Так, молярная масса эквивалента иона алюминия М(1/3Аl+3) =1/3 ∙ 27 = 9 г/моль
Количество моль - эквивалентов можно определить по формуле
m
nэкв = ——
Mэкв
Молярная масса эквивалента и эквивалент элемента не являются постоянной величиной в соединении, а зависят от валентности или степени окисления элемента.
Например:
Мэкв(С)
в
![]() =
12 ∙ 1/2 = 6 г/моль
Мэкв(С)
в
=
12 ∙ 1/2 = 6 г/моль
Мэкв(С)
в
![]() = 12 ∙ 1/4 = 3 г/моль
= 12 ∙ 1/4 = 3 г/моль
Постоянными являются эквиваленты Мэ (Н) = 1,008 г/моль Мэ(О) = 8 г/моль, Мэ (Аl) = 9 г/моль , Мэ ( Са) = 20 г/моль.
Если не учитывать конкретную химическую реакцию, то фактор эквивалентности и молярная масса эквивалентов сложных веществ рассчитываются по формулам:
 ;
;
Мэ
![]() =
=![]()
где М – молярная масса вещества
В - валентность функциональной группы
N - число функциональных групп
Для кислот функциональной группой является ион водорода, для оснований – ион гидроксила, для солей – ион металла и т.д. (H+, OH-, Kat +n, An-n)
Для определения эквивалентной массы сложного вещества в реакции следует разделить его полную массу (М) на сумму замещенных радикалов (H+, OH-, Kat+n, Ann-) NaH+ SO4 + NaCl = Na2SO4 + HCl
ƒэ NaHSO4 = 1
для кислот: ƒэкв равен единице, деленной на основность кислоты, которая определяется числом ионов водорода
1/Z = ƒэкв (HCl) = 1 1/Z = ƒэкв (H2 SO4) = ½ 1/Z = ƒэкв (H3 PO4) = 1/3
Молярная масса эквивалента кислоты равна произведению фактора эквивалентности на молярную массу кислоты
Мк
Мэ кислоты = ƒэкв ∙ Мк = —
Nн+
где: Мк - молекулярная (формульная) масса кислоты Nн+ - число атомов водорода, способных замещаться на металл.
для оснований ƒэкв равен единице, деленной на кислотность, равную числу гидроксогрупп, вступающих в реакцию
ƒэкв ( NaOH) = 1/Z ( NaOH) ƒэкв (Ca(OH)2) = 1/Z (Ca(OH)2) = 1/2
Молярная масса эквивалента основания равна произведению фактора эквивалентности на молярную массу основания
Мосн
Мэ основания = ƒэкв ∙ Мосн = ——
Nон-
для солей: ƒэкв соли равен единице, деленной на произведение числа атомов металла в молекуле соли на степень окисления металла.
ƒэкв (Na2SO4) = 1/Z (Na2SO4) =1/2 ƒэкв Al2(SO4)3 = 1/2 ∙ 3
Молярная масса эквивалента соли равна произведению фактора эквивалентности на молярную массу соли
Мэ
соли = ƒэкв
соли ∙ Мс
=
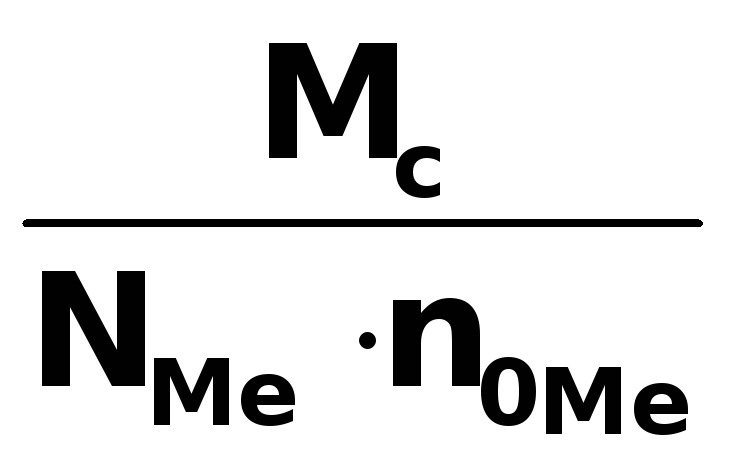
![]() гдеNме
– число
атомов металла,
гдеNме
– число
атомов металла,
![]() -
степень окисления металла
-
степень окисления металла
3 4 2
Мэ Al2(SO4)3= ——— = 57 г/моль
2 ∙ 3
Молярная масса эквивалента соли может быть рассчитана как сумма молярных масс металла и кислотного остатка
Мэ Al2(SO4)3 = 27/3 +48 = 57г/моль
4) для оксидов ƒэкв равен единице, деленной на произведение числа атомов кислорода на степень окисления кислорода
ƒэкв ( H2O) = 1/Z ( H2O) = ½ ƒэкв (SO2) = 1/Z (SO2) = ¼ 1
ƒэкв (Mn2O7) = ——
7∙ 2
Молярная масса эквивалента оксида равна произведению фактора эквивалентности на молярную массу оксида
М окс
Мэ оксида = ƒэкв ∙ Мокс = ———
No ∙ noО. где: Nо - число атомов кислорода, nоО – степень окисления кислорода в оксиде, которая равна всегда - 2.
Мокс
Мэ оксида = ———
Nо ∙ 2
В ОВР для определения ƒэкв необходимо единицу разделить на число отданных или присоединенных электронов. Вещества вступают в реакцию в эквивалентных количествах: 2Н2 + О2 = 2Н2О
4экв 4экв 4экв
2. Стехиометрия- раздел химии, рассматривающей количественные соотношения между реагирующими в-ами E=mc2 Е — энергия m — масса с — скорость света в вакууме ( 3 ∙ 108 м/сек.)
а) закон сохранения массы и энергии: Суммарные массы и энергии веществ, вступающие в реакцию, всегда равны суммарным массам и энергиям продуктов реакции.
б) закон постоянства состава (1808г. Ж.Прустом):
Всякое чистое вещество, независимо от способов его получения, всегда имеет постоянный качественный и количественный состав. Вещества постоянного состава называются дальтонидами, а переменного состава – бертоллидами.
в) закон кратных отношений (1803 году Джоном Дальтоном)
Если два элемента образуют между собой несколько соединений, то массы атома одного элемента, приходящиеся на одну и ту же массу атома другого элемента, относятся между собой как небольшие целые числа.
г) закон эквивалентов:
массы реагирующих друг с другом веществ (m1,m2) пропорциональны молярным массам их эквивалентов (МЭ1,МЭ2)
m1 Mэ1 m1 m2
—— = ——— < = > —— = ——
m2 МЭ2 MЭ1 МЭ2
3. Газовые законы.
a) закон объемных отношений (Гей-Люссака, 1808г)
При постоянных давлении и температуре объемы реагирующих между собой газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа.
б) закон Авогадро (1811 г. Амедео Авогадро)
в равных объемах различных газов при одинаковых условиях (температуре и давлении ) содержится равное число молекул.
Следствия из закона Авогадро:
1. При одинаковых условиях 1 моль любого газа занимает одинаковый объем.
2. При н.у. (т.е. Р =101325 Па и Т = 273,15 К) 1 моль различных газов занимает объем 22,4 л. Такой объем называется молярным объемом газа (Vм) и имеет размерность (л/моль)
Vм = 22,4 л/моль , тогда количество вещества газа определяется по формуле
Vг nг = ——,
Vм где Vг – объем газа
3. Отношение масс равных объемов различных газов равно отношению их молярных масс:
m1 M1
—— = —— = D2
m2 M2
это отношение называется относительной плотностью первого газа по второму(D2).
D2= m1/m2 = M1/M2, откуда М1 = D2 ∙ М2.
в) объединенный газовый закон:
термин «объединенный» означает, что данный закон является объединением двух законов;
1 ) закон Бойля – Мариотта: при постоянной температуре объем данного количества газа обратно пропорционален давлению, под которым он находится , т.е.
P ∙ V = const
2) закон Гей – Люссака: при постоянном давлении изменение объема газа прямо пропорционально температуре т.е.
V/Т = const
В химических расчетах при осуществлении перехода от нормальных условий или к нормальным используется выражение объединенного газового закона Бойля-Мариотта и Гей-Люссака:
PO · VO P · V
——— = ——
TO T
Если в это выражение подставить значения PO, VO и ТО, соответствующие обьему 1 моль газа при н.у. (22,4л), то POVO / TO становится постоянным для всех газов. Это соотношение обозначается R и называется универсальной газовой постоянной. Числовые значения R зависят от того, в каких единицах выражены объем и давление. PO =101325 Па, VO = 22,4 ∙ 10-3 м3, TO = 273 К
Подставляя соответствующие значения в формулу объединенного закона для любого газа количеством вещества 1 моль получим :
PO · VO 1,01325 ∙ 105 Па ∙ 22,4 ∙ 10-3 м3
R= ——— = —————————————— = 8,31 Дж/моль∙К
TO моль ∙ 273 К
с учетом R уравнение состояния идеального газа принимает вид
P ∙ V = R∙ T — для количества газа n = 1 моль
P ∙ V = n ∙ R T — для количества газа n моль n= m/M , тогда выражение уравнения состояния идеального газа или, иначе, уравнение Клапейрона – Менделеева имеет вид:
m
P ∙ V = —— R∙ T
M
4. Современные представления о строении атома зародились вначале нашего столетия в результате исследования природы катодных лучей (Дж.Томсон 1897), открытия радиоактивности (А.Беккерель, М.Склодовская-Кюри, П.Кюри 1896-1899), расшифровки спектров излучения раскалённых тел, а также опытов Э.Резерфорда (1911) по исследованию прохождения α-частиц через металлическую фольгу. Долгое время атом считался неделимым. Во второй половине 19 века появились высказывания о сложном строении атома. Открытие радиоактивности химических элементов (α-, β-, и γ-лучей) показало, что наряду с электронами атомы содержит материю, несущую положительный заряд. Первая гипотеза строения атома предложена английским учёным Томсоном (1904) так называемая статическая или электронно-ионная теория, согласно которой атом состоит из положительно заряженной сферы, в которую вкраплены отрицательные электроны. Для проверки гипотезы Томсона и более точного определения внутреннего строения атома, Резерфорд (1911) провёл серию опытов по рассеиванию α -частиц тонкими металлическими пластинами.
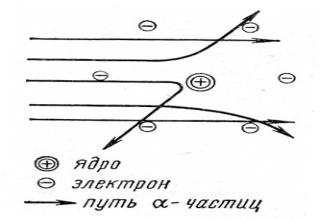
Резерфорд объяснил рассеяние α- частиц, предложив ядерную, планетарную модель строения атома, согласно которой атом состоит из положительно заряженного ядра, очень малого по размерам. Вокруг ядра на значительном расстоянии от него вращаются электроны, образующие электронную оболочку атома. Аналогично движению планет солнечной системы (отсюда название модели − планетарная). Датский физик Н.Бор в 1913 году внёс в планетарную модель атома Резерфорда квантовые представления и объяснил происхождение линейчатых спектров атомов, сформулировав 2 постулата. Основываясь на положении квантовой теории света о прерывистой, дискретной природе излучения сделал вывод, что энергия электронов в атоме не может меняться непрерывно, а изменяется скачками, т.е. дискретно. Иначе говоря, энергетические состояния электронов в атоме квантованы.
Строение ядра: Атом − электронейтральная микросистема, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. Ядра атомов состоят из 2-х типов частиц - протонов и нейтронов (нуклонов). Основная масса атома сосредоточена в ядре и характеризуется массовым числом А, равным сумме чисел протонов (заряд ядра) Z и нейтронов N A = Z + N
Заряд
ядра определяет число электронов,
находящихся вокруг ядра, совпадает с
порядковым номером (атомным номером).
В обозначении элемента указывают
массовое число и количество протонов,
![]() ,
например
,
например![]() .
.
Изотопы
− атомы с
одинаковыми значениями Z,
но различными А и N, например
![]()
Изобары
− атомы с одинаковыми значениями А, но
различными Z и N, например
![]() .
.
5. В 1924 году французский физик Луи де Бройль предположил, что двойственная, корпускулярно-волновая природа свойственна не только фотонам, но и любым другим материальным телам. Математический дуализм волна-частица выражается уравнением Луи де Бройля:
г
![]() деλ −
длина волны, h
– постоянная Планка
(6,63·10-34
Дж/с), m
− масса частицы, v
− скорость частицы
деλ −
длина волны, h
– постоянная Планка
(6,63·10-34
Дж/с), m
− масса частицы, v
− скорость частицы
Уравнение легко выводится, если в уравнение Планка E = h· υ (υ - частота) подставить значение E из уравнения Эйнштейна Е = m ·с2
m · c2 = h · υ , υ = c/ λ , m · c2 = h · с/λ , m · c2 = h /λ , λ = h /m·с, заменив с – (скорость фотона) на скорость любой микрочастицы v, получим:
λ = h /m · v
Принцип
неопределённости Гейзенберга (1927):
невозможно
одновременно точно измерить скорость
и положение (координаты) электрона.
ΔX
· ΔVx
· m
≥ h
/ 2π
Где
![]() x
и
x
и
![]() =ΔVx·m
- неопределенности в измерении координаты
и импульса. Электронное
облако − это
квантовомеханическая модель электрона
в атоме. Орбиталь
− это та
часть пространства атома, где наиболее
вероятно нахождение электрона в атоме.
=ΔVx·m
- неопределенности в измерении координаты
и импульса. Электронное
облако − это
квантовомеханическая модель электрона
в атоме. Орбиталь
− это та
часть пространства атома, где наиболее
вероятно нахождение электрона в атоме.
6. Существуя в трёхмерном пространстве, электрон имеет 3 степени свободы. Квант − наименьшая, неделимая порция энергии. Их значения указывают местонахождение электрона в атоме − его наиболее вероятный «адрес». 3 квантовых числа вычислены для атома водорода при решении уравнения Шрёдингера.
1. Главное n
2. Орбитальное ℓ
3. Магнитное mℓ
1)Главное квантовое число n характеризует энергетический уровень, или общий запас энергии электрона, а также размеры электронного облака. Для реально существующих атомов n может иметь значения целых чисел от 1 до 7, соответственно номеру периода, в котором находится элемент. С увеличением n возрастают энергия электрона и размер электронного облака.
2) Орбитальное или побочное квантовое число ℓ характеризует энергетический подуровень и форму электронного облака. В пределах уровня электроны распределяются по подуровням. Значения ℓ связаны со значением n и принимают число значений, равное n. ℓ изменяется от 0 до n-1
3) Магнитное квантовое число ml определяет ориентацию электронного облака в пространстве, связано с орбитальным квантовым числом и может принимать целочисленные значения от –l до +l через 0.
4) Спиновое квантовое число ms характеризует собственное вращение электрона вокруг своей оси. Может принимать всего 2 значения +½ и –½, которые отличаются как и остальные квантовые числа, на единицу.
7. Распределение электронов в атоме, находящемся в основном состоянии определяется зарядом ядра. При этом электроны размещаются согласно принципу наименьшей энергии: каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией. Принцип исключения Паули − в атоме не может быть двух электронов с одинаковыми значениями всех четырёх квантовых чисел. правило Хунда: в пределах подуровня электроны заполняют наибольшее число орбиталей, в связи с чем сумма их спиновых чисел должна быть максимальной. Ёмкость энергетического уровня (число электронов в уровне): Nn = 2n2 .Число электронов в подуровне Nl = 2 (2ℓ + 1). Валентность определяется числом неспареных электронов. Правило Клечковского: АО заполняются электронами в порядке последовательного увеличения суммы n + l, а при одинаковых значениях этой суммы − в порядке последовательного возрастания главного квантового числа n. Промотирование- разъединение спаренных электронов.
8. Формулировка ПЗ: св-ва элементов, а так же формы и св-ва соединений элементов находятся а периодической зависимости от величины заряда ядер их атомов. Строение электронных оболочек атомов объясняет расположение атомов в 7 периодах. Период- ряд элементов, начинающийся с активного щелочного Ме и завершающийся благородным газом. Первые 3 периода наз. Малыми(содержат соответственно 2, 8 и 8 элементов), которые наз. Типическими. Остальные периоды (с4 по7)наз. Большими, которые могут быть записаны в 2 ряда (четный и нечетный), поэтому возможны 2 варианта ПС. 4 и 5 содержат вставные декады элементов. Недостатки: нарушен принцип непрерывности, искусственно объединены в группу 7гр., вынесены за пределы табл. (лантаноиды и актиноиды) Группа— последовательность атомов по возрастанию заряда ядра, обладающих однотипным электронным строением. подгруппы — главные (или подгруппы A), начинающиеся с элементов первого и второго периодов, и побочные (подгруппы В), содержащие d-элементы. Кайносимметричные орбитали - орбитали, которые появляются впервые.
9. элементы, атомы которых завершают заполнение своей электронной оболочки на 5-подуровне внешнего уровня наз. S-элементы(1А и 2Агр., Н и Не). При дальнейшем увеличении заряда ядра начинает заполняться р-подуровень внешнего уровня. Элементы, атомы которого завершают заполнение своей электронной оболчки на р-подуровне внешнего уровня наз. Р-элементы (3А-8А гр.). физ. смысл ПЗ:при последовательном увеличении зарядов ядер периодически проявляется конфигурация электронных оболочек и, как следствие, периодически проявляются хим. Св-ва элемента. В ПС проявляется: вторичная периодичность- немонотонность в изменении св-в в подгруппе, внутренняя периодичность- немонотонность в изменении св-в элемента (в периодах) в горизонтальныз рядах р, д, ф-элементов горизонтальная аналогия- следствие внутренней периодичности, диагональная аналогия- сходство элементов расположенных по диагонали. Граница Цинтля- вертикальная граница между элементами 3А и 4А гр., слева от которой распологаются элементы с дефицитом валентных электронов, а справа- с избытком. Хим. Элемент-совокупность атомов 1 вида. Атомный радиус химического элемента зависит от координационного числа. Увеличение координационного числа всегда сопровождается увеличением межатомных расстояний. При этом относительная разность значений атомных радиусов, соответствующих двум разным координационным числам, не зависит от типа химической связи (при условии, что тип связи в структурах со сравниваемыми координационными числами одинаков). Изменение атомных радиусов с изменением координационного числа существенно сказывается на величине объемных изменений при полиморфных превращениях. Ионные радиусы в веществах с ионной связью не могут быть определены как полусумма расстояний между ближайшими ионами. Как правило, размеры катионов и анионов резко различаются. Кроме того, симметрия ионов отличается от сферической. Эффективный радиус иона зависит от заполненности электронных оболочек, но он не равен радиусу наружной орбиты. Для определения эффективного радиуса представляют атомы (ионы) в структуре кристалла как соприкасающиеся жесткие шары, так что расстояние между их центрами равно сумме радиусов. Атомные и ионные радиусы определены экспериментально по рентгеновским измерениям межатомных расстояний и вычислены теоретически на основе квантово-механических представлений. Орбитальный радиус– радиус электронных облаков внешнего электронного слоя. Атомные радиусы- характеристики, позволяющие приближенно оценивать межатомные (межъядерные) расстояния в молекулах и кристаллах. Энергия ионизации Е- энергия необходимая для отрыва наименее связанного электрона от атома с образованием соответствующего катиона. Потенциал ионизации I- наименьшее напряжение поля, при котором происходит ионизация атомов(численно равен энергии ионизации). По периоду энергия ионизации увеличивается, а по группе уменьшается, но не монотонно. Сходство к электрону F - энергия, которая выделяется при присоединении электрона к нейтральному атому, т.е. энергия процесса, при котором образуется анион. Наибольшим сродством к электрону характеризуется р-элементами 7гр. (галогены) т.к. на внешнем уровне находятся благородные газы. Электроотрицательность- способность атомов в молекулах или кристаллах притягивать электрон(ЭО=(I+F)/2). По периоду ЭО нарастает, а по группе убывает. Слева направо по периоду у элементов происходит ослабление метал. Св-в и усиление неметалл., основные св-ва оксидов ослабевают, а кислотные- возрастают. По главным гр. Метал. Св-ва элемента ослабевают, а метал.- усиливаются. если один и тот же элемент образует несколько оксидов с разными с.о., то чем выше с.о. элемента в оксиде, тем выше его кисл. Св.. ближе к нижнему левому углу метал.-увелич. Основность гидрокс. И оксидов, а верхний правый угол- увел. Кислотные св. оксидов и гидроксидов.
10. ковалентная х.с- х.с., осуществляемая электронными парами. Связь, образованная общей электронной парой в равной мере принадлежит двум одинаковым атомам наз. Ковал. Неполярной, а разными- ковал. Полярной. Для образования донорно-акцепторной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу. При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для обобществления пары по электрону, как бы обмениваясь ими. Дативный при осуществлении связи донором и акцептором является атом одного и того же элемента.
11. ковалентная х.с- х.с., осуществляемая электронными парами. Связь, образованная общей электронной парой в равной мере принадлежит двум одинаковым атомам наз. Ковал. Неполярной, а разными- ковал. Полярной. св-ва ковал. связи: Насыщаемость- способность атомов образовывать ограниченное число ковал. связей. Направленность ковал. связи обусловлена тем, что перекрывание валентных электронных облаков возможно только при их определенной взаимной ориентации, что обуславливает пространственную форму молекул. Полярная (несимметричная) ковалентная связь – связь между атомами с различной электроотрицательностью и несимметричным распределением общей электронной пары. Электронная плотность такой связи смещена в сторону более электроотрицательного атома, что приводит к появлению на нем частичного отрицательного заряда δ– (дельта минус), а на менее электроотрицательном атоме – частичного положительного заряда δ+ (дельта плюс). Чем больше различие в электроотрицательности связываемых атомов, тем выше полярность связи и больше ее дипольный момент. Между противоположными по знаку частичными зарядами действуют дополнительные силы притяжения, увеличивая прочность связи. Полярность связей влияет на химические и физические свойства соединений. От полярности связи зависит механизм реакции и даже реакционная способность соседних связей. Полярность связей может привести к полярности молекул и, таким образом, повлиять на физические свойства вещества (температуры плавления и кипения, растворимость).
12. Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам. sp-гибридизация: Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов.
13. Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам. sp2-гибридизация: Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей.
14 . Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам. sp3-гибридизация: Происходит при смешивании одной s- и трех p-орбиталей, образуя четыре равноценные по форме и энергии sp3-гибридные орбитали. Могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов. Оси sp3-гибридных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28', что соответствует наименьшей энергии отталкивания электронов. Так же sp3-орбитали могут образовывать четыре σ-связи с другими атомами или заполняться неподеленными парами электронов.
15. NH3: у атома азота 7 электронов. На внешнем электронном слое находится 5 электронов. 3 из них неспаренных. У Н 1 электрон и за счет обобщения электронных пар азота и водорода образуется связь. Для того, чтоб хим. в-во достигло устойчивого состояния, необходимо обобщить в свободную орбиталь электроны Н и N. H2O: у атома кислорода находится 2 неспаренных электрона. За счет обобщения электрона водорода и кислорода образуя связь. Валентный угол — угол, образованный направлениями химических связей, исходящими из одного атома. Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома. Для простых молекул валентный угол, как и другие геометрические параметры молекулы, можно рассчитать методами квантовой химии. Валентный угол сложных молекул определяют методами дифракционного структурного анализа. Метод Гиллеспи–Найхолма основан на том, что реальная геометрия молекулы определяется не только гибридизацией АО, но и числом двухэлектронных двухцентровых связей (связывающих электронных пар) и наличием неподеленных электронных пар. характерные особенности σ- и π-связей. σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. По σ-связям возможно внутримолекулярное вращение атомов, т.к. форма σ-МО допускает такое вращение без разрыва связи (аним., ~33 Kб). Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи. Ковалентная связь считается локализованной, если ее электронная пара находится в поле двух ядер и связывает только два атома. Делокализованная связь - связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов (подобие металлической связи). Такая делокализация (рассредоточение) электронов характерна для сопряженных p-связей, т.е. кратных связей, чередующихся с одинарными. Рассредоточение электронов - энергетически выгодный процесс, т.к. приводит к снижению энергии молекулы. Необходимым условием делокализации p-электронов является p-перекрывание р-АО соседних sp2- или sp-атомов, лежащих в одной плоскости. Делокализация p-электронов приводит к тому, что в сопряженной системе связи становятся нецелочисленными (дробными), т.е. ни двойными или тройными, ни одинарными. Иначе говоря, связи имеют нецелочисленный порядок.
16. Энергия и длина связи. Количество энергии, выделяющееся при образовании химической связи, называется энергией химической связи Есв. Она имеет единицу измерения кДж/моль. Для многоатомных соединений с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Чем больше энергия химической связи, тем устойчивее молекулы. Важной характеристикой химической связи является ее длина lсв, равная расстоянию между ядрами в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и соответственно устойчивость молекул. Сумма энергии ионизации и сродства к электрону называется электроотрицательностью. Поляризуемость- межмолекулярная электронная плотность смещается к атому с большей электроотрицательностью, тогда центры тяжести (+) и (-) не совпадают и возникает электрический диполь. Дипольный момент электрический, векторная величина, характеризующая асимметрию распределения положительных и отрицательных зарядов в электрически нейтральной системе. Электрический момент диполя: μ=ɋ*l (μ- момент диполя, ɋ- заряд электрона,l- длина диполя). Длина диполя- расстояние между полюсами. Чем больше дипольный момент, тем больше полярность связи и молекулы. Дипольный момент является векторной величиной. Вектор дипольного момента направлен от центра положительного заряда к центру отрицательного.
17. при полном смещении межъядерной электронной плотности к атому с большей электрообрицательностью длина поля становится равной длине связи, а атомы превращаются в положительно и отрицательно заряженные ионы, между которыми действуют силы электрическогопритяжения. Такая связь наз. Ионной. Ионная связь- вид хим. связи, возникающий в результате взаимного электрического притяжения противоположно заряженных ионов. ионная связь не обладает направленностью и насыщаемостью, в отличии от ковалентной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
18. Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений. Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей.
19. Кристалли́ческая решётка — вспомогательный геометрический образ, вводимый для анализа строения кристалла. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Решёткой является совокупность точек (атомов), которые возникают из отдельной произвольно выбранной точки кристалла под действием группы трансляции. Это расположение замечательно тем, что относительно каждой точки все остальные расположены совершенно одинаково. Применение к решётке в целом любой из присущих ей трансляций приводит к её параллельному переносу и совмещению. Для удобства анализа обычно точки решётки совмещают с центрами каких-либо атомов из числа входящих в кристалл, либо с центрами молекул. Классификация решёток по симметрии. Сингонии: триклинная сингония — наименьшая симметрия, нет одинаковых углов, нет осей одинаковой длины; моноклинная сингония — два прямых угла, нет осей одинаковой длины; ромбическая сингония — три прямых угла (поэтому ортогонально), нет осей одинаковой длины; гексагональная сингония — две оси одинаковой длины в одной плоскости под углом 120°, третья ось под прямым углом; тетрагональная сингония — две оси одинаковой длины, три прямых угла; тригональная сингония — три оси одинаковой длины и три равных угла, не равных 90°; кубическая сингония — высшая степень симметрии, три оси одинаковой длины под прямым углом.
20. Основные положения ММО: 1. Все электроны принадлежат молекуле в целом. Молекула представляет собой единую совокупность атомных ядер и электронов. 2. Каждому электрону в молекуле соответствует молекулярная орбиталь.
АО s p d f
МО σ π Ϭ φ
3. молекулярную орбиталь можно представить как линейную комбинацию атомных орбиталей, т.е. результат их сложения и вычисления: NАО=NМО
ММО рассматривает х.с. как результат распределения электронов в молекуле по ее орбиталям. МО заполняются электронами в соответствии с принципом наименьшей энергии, исключ. Паули, правилом Хунда. Электроны на связывающих молекулярных орбиталях упрочняют связь, на разрыхляющих как бы дестабилизируют (расшатывают). Молекула является устойчивой лишь в том случае, если число электронов на связывающих орбиталях превышает число электронов на разрыхляющих. Электроны, находящиеся на несвязывающих молекулярных орбиталях, участия в образовании химической связи не принимают. Из исходных атомных орбиталей возникает n МО. На связывающей МО электрон большую часть времени пребывает между ядрами (повышается электронная плотность), способствуя их химическому связыванию. На разрыхляющей же МО электрон большую часть времени находится за ядрами, вызывая отталкивание ядер друг от друга. Характер распределения электронов по МО определяет порядок (кратность) связи, её энергию, межъядерные расстояния (длина связи), магнитные свойства молекул и др. Заполнение молекулярных орбиталей подчиняется тем же правилам, что и заполнение атомных: принципу энергетической выгодности, принципу Паули, правилу Хунда, принципу заполнения электронных структур Aufbau. В общепринятом приближении молекулярная орбиталь рассматривается как линейная комбинация атомных орбиталей (приближение МО ЛКАО).
Кратность связи в
теории молекулярных орбиталей определяется
выражением
![]() где
где
![]() и
и
![]() — суммарные количества электронов на
связывающих и разрыхляющих орбиталях
соответственно.
— суммарные количества электронов на
связывающих и разрыхляющих орбиталях
соответственно.
21.У элементов второго периода в образовании химических связей принимают участие только s-орбитали(Н2,Н2+,Н2).
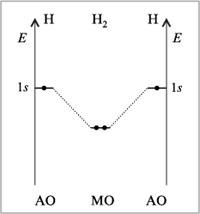
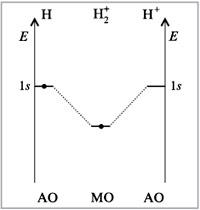
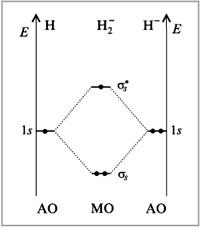
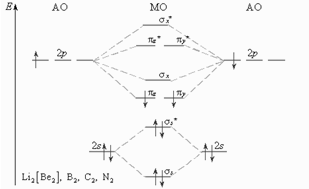
У элементов второго периода в образовании химических связей принимают участие кроме s- еще и p-орбитали, при этом соблюдаются следующие условия: АО должны иметь близкие энергии, перекрываться в значительной степени, иметь одинаковую симметрию относительно линии связи, число МО должно быть равно числу образующих их АО.
№22. Каждый электрон, благодаря наличию у него спина, создает собственное магнитное поле. Направление этого поля определяется направлением спина, так что магнитные поля, образованные двумя спаренными электронами, взаимно компенсируют друг друга. Поэтому молекулы, в состав которых входят только спаренные злектроны, не создают собственного магнитного поля. В-ва, состоящие из таких молекул, являются диамагнитными - они выталкиваются из магнитного поля. Напротив, в-ва, молекулы которых содержат неспаренные электроны, обладают собственным магнитным полем и являются парамагнитными; такие в-ва втягиваюся в магнитное поле.
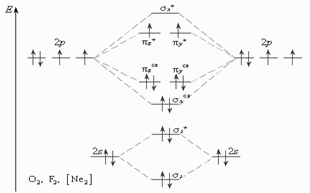
Кислород - в-во парамагнитное, что свидельствует о наличии в его молекуле неспаренных электронов.
В методе МО кратность связи принято определять по числу связывающих электронов, учавствующих в ее образ.: два связывающих электронов соответ. простой связи, четыре связывающих электр. - двойной связи. При этом разрыхляющие электроны компенсируют действие соответствующего числа связывающих электронов.
В молекуле кисларода2 в образовании хим. связей принимают участие по 4 2р-электрона каждого атома; всего на МО должны перейти 8 электронов. Шесть заним. связыв. МО, а 2 размещ. на разрых. молек. орбит.; Обе орбит. энергетич. равноценны, и элекроны должны размещ. по правилу Хунда, к-ое сохраняет свою справедливость и в приложении к молекулам. Поэтому каждая из орбиталей занимается одни электроном и притом так, что спины этих электронов имеют одинаковое направление. Отсюда следует, что в молекуле кисларода2 имеются два неспаренных электрона, вследствии чего эта молекула должна быть парамагнитной. Таким образом, метод МО объясняет магнитные свойства молекулярного кислорода.
О2- будет присоединять один электрон и поэтому кислород с зарядом минус будет обладать диомагнитными свойствами.
О2+ будет забирать один электрон и поэтому будет обладать парамагнитными свойствами, кратность связи равна 2,5
О22- будет присоединять 2 электрона и поэтому О22- обладает димагнитными свойствами.
23.
Межмолекулярное взаимодействие:
1)Ориентационное – проявляется между полярными молекулами. В результате беспорядочного теплового движения молекул при их сближении друг с другом одноименно заряженные концы диполей взаимно отталкиваются, а противоположно заряженные притягиваются. Чем более полярны молекулы, тем сильнее они притягиваются и тем самым больше ориентационное взаимодействие.
2)Индукционное – взаимодействие между полярной и неполярной молекулами. Полярная молекула индуцирует временный дипольный момент и обе молекулы взаимодействуют как диполи.
3)Дисперсионное – мгновенно наведенный диполь. Наиболее универсальное и проявляется между любыми молекулами.
24.
Водородная связь – тип молекулярного взаимодействия, возникает между атомом водорода одной молекулы и атомом сильно электроотрицательного элемента другой молекулы.
Но в отличии от дипольного взаимодействия, механизм возникновения водородной связи обусловлен донорно-акцепторным взаимодействием, где донор – атом электроотрицательного элемента одной молекулы, а акцептор – атом водорода.
Обладает насыщаемостью и направленностью. Определяет свойства веществ в жидком состоянии. Бывает:
внутримолекулярная
Н
межмолекулярная
Характер химической связи между атомами оказывает влияние на физические и химические свойства веществ.
Наличие водородных связей – более высокая температура кипения воды.
Свойства веществ с ионной связью отличаются от свойств веществ с неполярной ковалентной связью: имеют высокую температуру кипения и плавления, в расплавленном состоянии обладают электропроводностью, в воде диссоциируют на ионы.
А вещества с полярной ковалентной связями занимают между ними промежуточное положение.
25.
Химическая термодинамика изучает:
переход энергии из одной формы в другую, от одной части системы к другой.
Энергетические эффекты
Возможность и направление самопроизвольного протекания процессов.
Система – тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее.
Гетерогенная система – состоит из нескольких фаз.
Гомогенная – однофазная.
Изолированные системы – не могут обмениваться с внешней средой ни веществом, ни энергией.
Закрытые системы – могут обмениваться с внешней средой только энергией.
Открытые системы – и веществом, и энергией (жидкость и ее пар).
Закон сохранения энергии (первое начало термодинамики):
Сообщенная системе теплота расходуется на изменение внутренней энергии и на совершение работы против внешних сил.
Q= U+A
U+A
U=Uпост+Uвращ+Uколеб+Uмежмолек. взаим.
Под величиной А имеют в виду работу против всех сил, действующих на систему.
Изохорный процесс: V=const
если поршень закреплен неподвижно, то сообщенная системе теплота идет полностью на увеличение запаса внутренней энергии.
A =p*
V=0
=p*
V=0
Q V=
U
V=
U
Энергия системы определяется тепловым эффектом реакции.
Изобарный процесс: P=const
- если дать возможность поршню свободно перемещаться, то газ, расширяясь, совершит работу:
A=p* V=p(V2-V1)
V=p(V2-V1)
Qp= U+p(V2-V1)
U+p(V2-V1)
U1 и U2 - запас внутренней энергии системы в исходном и конечном состояниях, то
 U=U2-
U1
U=U2-
U1
Qp=(U2+pV2)-(U1+pV1)
Функция H=UpV – энтальпия, является функцией состояния системы.
Энтальпия – рассматривается как энергия расширения системы.
Тепловой эффект процесса – количество выделенной или поглощенной теплоты.
QV= U
Qp=
U
Qp= H
H
Параметры состояния
экстенсивные – зависят от количества вещества (V, m)
интенсивные – не зависят от количества вещества (T, p)
26.
Термохимия – раздел химии, изучающий тепловые эффекты химических процессов.
Термохимические уравнения – уравнения реакции, в которых указываются тепловые эффекты (и агрегатное состояние веществ).
Для изобарного процесса:
Qp= H=∑
H=∑ Hкон
- ∑
Hкон
- ∑ Hисх.
Hисх.
Для изохорного процесса:
QV= U=∑Uкон
- ∑Uисх.
U=∑Uкон
- ∑Uисх.
Qp ≠ QV
Закон Гесса:
Тепловой эффект реакции зависит только от начального и конечного состояния реагирующих веществ, и не зависит от Пети процесса, т.е. от числа промежуточных стадий.
1-е следствие:
Тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ.
ΔH0p=∑VjΔH0fпрод - ∑VjΔH0fисх
Энтальпия (теплота образования) – тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при стандартных условиях.
Энтальпии образования простых веществ в стандартном состоянии условно принимаются равными 0.
2-е следствие:
Тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции.
ΔH0p=∑VjΔH0сгор.исх. - ∑VjΔH0сгор.прод.
3-е следствие (закон Лавуазье-Лапласа):
Тепловой эффект разложения какого-либо химического соединения точно равен, но противоположен по знаку тепловому эффекту его образования.
4-е следствие:
Если совершаются две реакции, приводящих из различных начальных состояний к одинаковым конечным состояниям, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое.
Стандартная молярная энтальпия плавления (ΔНпл) – изменение энтальпии, которым сопровождается плавление 1 моль вещества при температуре плавления и р=1атм.
Стандартная молярная энтальпия испарения (ΔНисп) – изменение энтальпии, которым сопровождается испарение 1 моль вещества при его температуре кипения и р=1атм.
27.
Состояние любой совокупности частиц можно характеризовать:
указав значение непосредственно измеряемых свойств вещества, таких как t и p, которые являются характеристиками макросостояния вещества
указав мгновенные характеристики каждой частицы вещества – ее положение в пространстве, скорость и направление перемещения – характеристики микросостояния вещества.
Данному макросостоянию отвечает колоссальное число различных микросостояний.
Критерием направленности процесса может служить степень неупорядоченности системы, мерой которой является функция состояния системы, называемая энтропией (S):
S=k*lnW – уравнение Больцмана
2-е начало термодинамики:
1) невозможен самопроизвольный переход энергии (в форме теплоты) от менее нагретого тела к более нагретому
2) все самопроизвольные процессы в изолированных системах протекают в сторону увеличения энтропии ΔS>0
Энтропия растет:
- с увеличением температуры
- при плавлении (и возгонке) твердого вещества
- при кипении жидкости
- при расширении газа
- при растворении кристаллов
- при диссоциации веществ, когда вследствие роста числа частиц неупорядоченность увеличивается
Энтропия падает:
- при охлаждении
- при отвердевании
- при сжатии
- при кристаллизации из растворов
- в реакциях с уменьшением объема
Стандартная энтропия образования соединения равна изменению энтропии, которое сопровождает реакцию образования 1 моль соединения в стандартных условиях из простых веществ.
В изменении энтропии веществ:
1) усложнение молекулы приводит к увеличению энтропии
2) увеличение твердости веществ, упорядочение структуры приводит к уменьшению энтропии
3) энтропия веществ в аморфном и стеклообразном состояниях больше, чем в кристаллах.
4) энтропия простых веществ и соединений элементов является периодическим свойством
5) среди одинаковых по форме молекул энтропия возрастает с увеличением массы этих соединений
6) с уменьшением плотности Ме энтропия возрастает.
Вывод: для живых организмов, как и для тел неживой природы, полностью выполняются законы термодинамики в целом, энтропия системы организм-среда увеличивается.
28.
Самопроизвольно, т.е. без затраты работы извне, система может переходить только из менее устойчивого состояния в более устойчивое.
В химических процессах одновременно действуют 2 тенденции:
1) стремление частиц объединяться за счет простых связей в более сложные, что уменьшает энтальпию системы
2) стремление частиц разъединяться, что увеличивает энтропию системы
Суммарный эффект этих двух тенденций в процессах, протекающих при постоянных Т и р, отражается изменением изобарно-изотермического потенциала. В честь американского ученого Гиббса, ее называют также свободной энергией Гиббса ΔG, проявляется действие двух прямо противоположных факторов – энтальпийного ΔН и энтропийного.
ΔG= ΔН – ТΔS
ΔGp,t<0 – процесс термодинамически возможен
ΔG>0 – невозможен
ΔG=0 – состояние химического равновесия
Все процессы могут самопроизвольно протекать в сторону уменьшения свободной энергии Гиббса.
ΔGреак.=ΣΔGfкон - ΣΔGfисх.
ΔG образования наиболее устойчивой модификации простого вещества принимается равной нулю.
|
ΔН |
ΔS |
ΔG |
ΔН – ТΔS= ΔG |
возможность/невозможность |
|
- |
+ |
- |
-ΔH-TΔS<0 |
возможно при любых Т |
|
+ |
- |
+ |
ΔH+ TΔS>0 |
невозможно при любых Т |
|
- |
- |
+ - |
-ΔH +TΔS<0 |
при низких Т |
|
+ |
+ |
+ - |
ΔH- TΔS<0 |
при высоких Т |
29.
Под стандартной энергией Гиббса образования ΔG0f понимают изменение энергии Гиббса при реакции образования 1 моль вещества, находящегося в стандартном состоянии. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии и энтропии системы, не зависит от пути процесса. Поэтому для реакции вида
aA+bB+…=dD+eE+…
изменение стандартной энергии Гиббса ΔG0 равно разности между суммой стандартных энергий Гиббса образования исходных веществ:
ΔG0=(dΔG0f,D+eΔG0f,E+…) – (aΔG0f,A+bΔG0f,B+…)
ΔG0=ΣΔG0f,прод. - ΣΔG0f,исх.
При пользовании значениями стандартной энергии Гиббса критерием принципиальной возможности процесса в нестандартных условиях следует принять условие ΔG0<<0, а критерием принципиальной невозможности осуществления процесса - неравенство ΔG>>0. Разумеется, если ΔG0=0, то это вовсе не означает, что в реальных условиях система будет находится в равновесии. Таким образом, во многих случаях значениями ΔG0 можно пользоваться лишь для приближенной оценки направления реакций.
30.
Химическая кинетика изучает скорость и механизм химических реакций.
Скорость хим. реакции – изменение концентрации реагирующих веществ в единицу времени при неизменном объеме системы:
Vcp= − (c2-c1)/(t2-t1)= - ∆c/∆t – для исходных веществ
Истинная скорость – скорость в данный момент времени, которая определяется как первая производная от концентрации по времени:
Vист= ±dc/dt
Скорость химических реакций зависит от:
природы и концентрации реагирующих веществ
температуры
давления (для реакций с участием газов)
присутствия катализаторов
среды
интенсивности света (в фотохимических реакциях)
31.
Закон действующих масс (1867г.):
скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов.
mA + nB = pC + gD
V(скорость) = k1*cAm*cBn
V = k2*cCp*cDg
k – коэффициент пропорциональности (константа скорости)
k – зависит от природы реагирующих веществ и температуры, но не зависит от концентрации!
Кинетическое уравнение связывает скорость реакции с концентрацией.
32.
Правило Вант-Гоффа:
при повышении температуры на каждые 100С, скорость гомогенной химической реакции увеличивается в 2-4 раза.
По этому правилу определяется приближенная зависимость:
V2/V1 = γ∆t/10 V – скорость, γ – температурный коэффициент
γ = (kt + 10)/kt ≈ 2-4
γ – это отношение константы
Уравнение Аррениуса:
k = A*e*(-Ea)/RT
В логарифмической форме:
lnk = lnA – Ea/RT
A – предэкспоненциальный множитель
33.
Активированный комплекс – соединение, в котором ослаблены и удлинены связи, разрываемые в ходе данной реакции.
Разность энергий активации прямой и обратной реакции равна тепловому эффекту:
∆H = Ea – Ea, ∆H<0 – экзотермический процесс
Ea>Ea, ∆H>0 – эндотермический процесс
Уравнение Аррениуса:
k = A*e*(-Ea)/RT
В логарифмической форме:
lnk = lnA – Ea/RT
A – Предэкспоненциальный множитель
lnkT1 = lnA – Ea/RT1 (1)
lnkT2 = lnA – Ea/RT2 (2)
(2) – (1):
lnkT2 – lnkT1 = - Ea/RT2 + Ea/RT1
lnkT2/kT1 = Ea/R(1/T1 – 1/T2)
34.
Катализатор – вещество, изменяющее скорость химической реакции, но само в реакции не образуется и в конечные продукты не входит.
B + A kat AB
SO2 + 1/2O2 NO SO3
A + K [A…K] [A…K] + B AB + K
1/2O2 + NO NO2 NO2 + SO2 SO3 + NO
Если Ea этих стадий ниже Ea процесса в отсутствии катализатора, то общая скорость процесса увеличивается, и такой катализ называют положительным.
Если скорость процесса уменьшается, то катализ будет отрицательным (ингибитором).
Ингибиторы отличаются от катализаторов тем, что входят в состав продуктов реакции.
В присутствии катализатора Ea реакции снижается на величину ∆Eak.
Катализаторы обладают избирательностью (селективностью):
C2H5OH AL2O3 C2H4 + H2O – дегидратация этанола (350-3600C)
C2H5OH Cu CH3 – COH + H2 – дегидрирование этанола (200-2500C)
Гетерогенный катализ – катализатор и реагенты находятся в разных фазах, и процесс протекает на поверхности их раздела.
Каталитические яды – вещества, которые снижают активность или полностью деактивируют твердый катализатор.
Промоторы – вещества, усиливающие действие катализатора данной реакции, хотя сами катализаторами не являются.
Ферменты (энзимы) – биологические катализаторы.
Ферменты – особый класс белков, присутствие которых в небольших количествах жизненно необходимо для всех биологических организмов.
Особенности ферментов как катализаторов:
исключительно большая каталитическая активность
высокая химическая специфичность
инактивация
35.
Необратимые реакции – реакции, которые протекают только в одном направлении и идут до конца.
В практически необратимых преобладает реакция, идущая в одном направлении. Среди них выделяют несколько типов:
реакции двойного обмена с образованием малорастворимого вещества.
NaCI + AgNO3 = NaNO3 + AgCI
CI- + Ag+ = AgCI
реакции с образованием газообразных веществ
Na2CO3 + 2HCI = 2NaCI + H2O + CO2
CO32- + 2H+ = H2O + CO2
реакции с образованием малодиссоциирующих веществ
HNO3 + KOH = KNO3 + H2O
H+ + OH- = H2O
ионные ОВР
Zn + H2SO4 = ZnSO4 + H2
реакции, приводящие к образованию комплексных соединений
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O
Cu2+ + 4NH4OH = [Cu(NH3)4]2+ + 4H2O
реакции, сопровождающиеся большим количеством энергии
C6H12O6 + 6O2 = 6CO2 + 6H2O; ∆H0 = - 2867 кДж/моль
 2KCIO3
= 2KCI + 3O2
2KCIO3
= 2KCI + 3O2
Pb(N3)2 = Pb + 3H2
Обратимые – протекают в противоположных направлениях и не идут до конца.
C + CO2 2CO
N2 + 3H2 2NH3
Химическое равновесие – состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
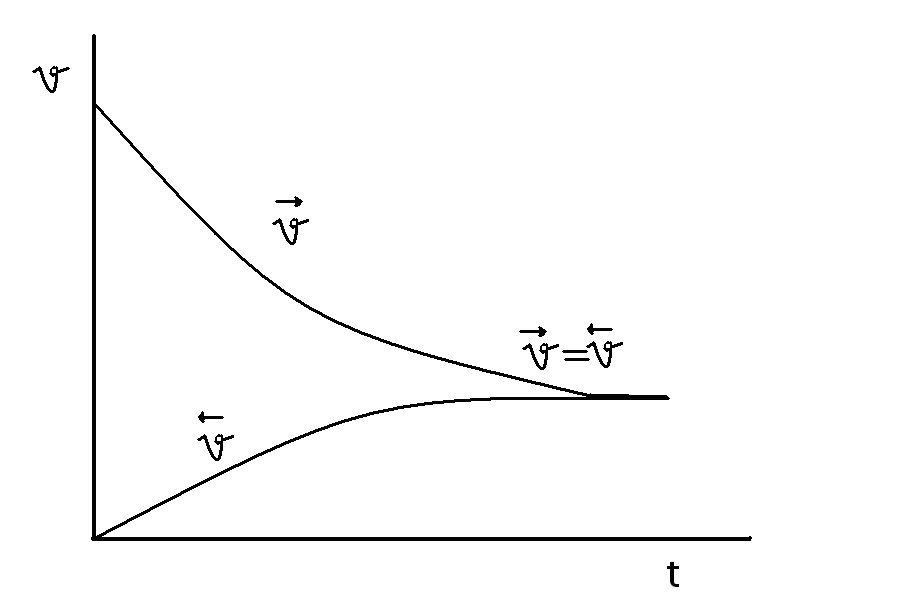
в общем виде:
mA
+ nB
![]() pС
+ gD
pС
+ gD
→ v1 = к1 · [A] m · [B] n
← v2 = k2 · [C] p · [D] g
Концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, называются равновесными, обозначаются при помощи квадратных скобок, в отличии от неравновесных.
В состоянии динамического равновесия v1 = v2 - кинетическая концепция равновесия. С течением времени v1 уменьшается, а v2- увеличивается. В некоторый момент они становятся равными.
k1 · [A]m · [B]n = k2· [C]p · [D]g
Кс = k1/k2 = [ C]p · [D]g/ [A]m · [B]n
Константа Кс, отражающая соотношение концентраций компонентов обратимой реакции в состоянии динамического равновесия называется константой равновесия.
Кс = [C]p · [D]g / [A]m · [B]n –
уравнение закона действующих масс в общем виде.
Формулировка закона действующих масс (з.д.м.) для обратимых реакций:
В данной обратимой реакции при данной температуре отношение произведений равновесных концентраций продуктов реакции и исходных веществ, возведенных в степени их стехиометрических коэффициентов есть величина постоянная.
Кс показывает во сколько раз скорость прямой реакции больше скорости обратной, если концентрации каждого из реагирующих веществ равны 1 моль/л. В этом физический смысл константы равновесия.
Константа равновесия определяет глубину протекания процесса в момент достижения состояния равновесия. Чем больше К, тем полнее происходит взаимодействие веществ. Зная К, можно вычислить теоретически возможный выход продуктов реакции.
З.д.м. применим ко всем обратимым реакциям.
Для гомогенных газов, реакций при небольших давлениях, когда газ подчиняется законам идеальных газов, вместо концентраций используют равновесные парциальные давления реагентов.
Р =
![]() · R
·T
· R
·T
P = Cm · R · T
См = n/V, P = Cм · R · T, См = P/R · T
mA + nB
![]() pС
+ gD
pС
+ gD
Кp
=
P![]() ·
P ·
·
P ·![]() /Р
/Р![]() ·
Р
·
Р![]() ,
,
Кp = [Сс ]р·[СD ]g / [CA ]m ∙ [CB]n ∙ RT
Кp = Kc · R· T
где = (p+g) - (m+n)
Kc
= Kp,
если
![]() =0
.Константа равновесия – важнейшая
характеристика химического взаимодействия
.Для необратимых реакций К
=0
.Константа равновесия – важнейшая
характеристика химического взаимодействия
.Для необратимых реакций К![]() ,
т.к. равновесные концентрации продуктов
реакции намного превышают концентрации
исходных веществ. Она зависит от
температуры, от природы реагирующих
веществ, но не зависит от их концентрации
(давления).
,
т.к. равновесные концентрации продуктов
реакции намного превышают концентрации
исходных веществ. Она зависит от
температуры, от природы реагирующих
веществ, но не зависит от их концентрации
(давления).![]()
Константа диссоциации слабых электролитов (кислот и оснований), константа нестойкости комплексных ионов, ионное произведение воды, произведение растворимости – характеризуют обратимые процессы и являются константами равновесия.
37 Константа равновесия в гомогенных и гетерогенных системах и ее связь с термодинамическими функциями.
Когда скорости прямой и обратной реакций становятся одинаковыми, наступает состояние химического равновесия и дальнейшего изменения конц-ций участвующих в реакц-и в-в не происходит. Константа равновесия- постоянная при данной температуре величина, выражающая соотношение между равновесными концентр-ми продуктов реакц-и (числитель) и исходных в-в (знаменатель). Чем больше константа равновесия, тем «глубже» протекает реакция, т.е. тем больше выход ее продуктов. В хим-кой термодинамике доказывается, что для общего случая хим-кой реакц-и А+В=C+D справедливо аналогичное выражение для константы равновесия реакц-и: K=[C][D]./ [A][В]. В выражение константы равновесия гетерогенной реакц-и, как и в выражение закона действия масс, входят только концентрации в-в, находящихся в жидкой или газообразной фазе, так как концентрации твердых в-в остаются, как правило, постоянными. Катализатор не влияет на значение константы равновесия, поскольку он одинаково снижает энергию активации прямой и обратной реакций и поэтому одинаково изменяет скорости прямой и обратной реакций. Катализатор лишь ускоряет достижение равновесия, но не влияет на количественный выход продуктов реакц-и.
Aг+2Bг=Cг [A]=1моль/л[B]=2[C]=3 K=[C]/[A][B]2=3/4
38.
Состояние химического равновесия зависит от целого ряда факторов, основные из которых - температура, давление и концентрация. При изменении хотя бы одного из них равновесие нарушается и концентрации реагирующих веществ изменяются до тех пор, пока не установится новое равновесие, но уже при иных значениях равновесных концентраций.
Переход реакционной системы из одного состояния равновесия к другому называется смещением или сдвигом химического равновесия.
Влияние различных факторов на состояние равновесия качественно описывается принципом смещения равновесия: eсли на систему, находящуюся в равновесии производится какое-либо воздействие (изменяется концентрация, температура, давление), то равновесие смещается в направлении процесса, ослабляющего произведенное воздействие.
(N2)
+ 3 (H2)
![]() 2 (NH3)
H0
= - 46кДж/моль
2 (NH3)
H0
= - 46кДж/моль
1)При увеличении концентрации хотя бы одного из реагентов равновесие смещается в сторону образования продуктов, а при добавлении продуктов – в сторону реагентов.
2)Повышение температуры вызывает смещение равновесия в сторону эндотермической реакции, а понижение - в сторону экзотермической.
3)Повышение давления в равновесной системе вызывает реакцию, сопровождающуюся уменьшением числа частиц в газовой фазе, равновесие смещается в сторону меньшего числа газообразных частиц.
Принцип Ле Шателье применим не только к гомогенным системам , но и к гетерогенным. Гомогенные реакции протекают в однофазной системе и во всем объеме, гетерогенные - в многофазной , на поверхности раздела фаз.
З.д.м. применим к гетерогенным системам лишь с определенными допущениями. Рассмотрим гетерогенную реакцию термической диссоциации карбоната кальция.
CaCO3(тв) = CaO(тв) + СО2(г)
Если бы она протекала как гомогенная, то К = [CаО ] · [CО2] / [CаСО3], но [CаО] и [CаСО3] при данной температуре величины постоянные, очень малы.
Тогда k1 = К ·[CаCО3] / [CaO] и k1 = [CО2] равновесная концентрация [CО2] при данной температуре является величиной постоянной, не зависящей от количеств CаО и CаСО3.
