
Komina_yakovlev_uchebn
.pdfФедеральное агентство по образованию
Санкт-Петербургский государственный архитектурно-строительный университет
Г. П. КОМИНА, В. А. ЯКОВЛЕВ
ЭНЕРГОСБЕРЕЖЕНИЕ И ЭКОНОМИЯ ЭНЕРГОРЕСУРСОВ В СИСТЕМАХ ТГС
Учебное пособие по выполнению курсовой работы для студентов специальности
270109 – теплогазоснабжение и вентиляция
Санкт-Петербург
2009
1

УДК 653.26:662.76
Рецензенты: д-ртехн. наук, проф. А. Л. Шкаровский(действительныйчлен Международнойакадемииприкладныхисследований); канд. техн. наук, доцент М. А. Кочергин (главный специалист отдела технического надзора управления капитального строительства ОАО «Газпромрегионгаз»)
Комина, Г. П., Яковлев, В. А.
ЭнергосбережениеиэкономияэнергоресурсоввсистемахТГС: учеб. пособиеповыполнениюкурсовойработыдлястудентовспециальности 270109 – теплогазоснабжение и вентиляция / Г. П. Комина, В. А. Яковлев; СПб. государственный архитектурно-строи- тельный университет. – СПб., 2009. – 133 с.
ISBN 978-5-9227-0160-0
Представленыметодикасоставленияматериальногобалансагоренияприродных газовых смесей и методика составления тепловых балансов промышленных печей, рекуперативных теплообменных аппаратов, схем утилизации теплоты продуктов сгорания газовых топлив с применением рекуперативных и контактных теплообменных аппаратов. Проанализирована методика конструктивного расчёта рекуперативных и контактных теплообменных аппаратов. Рассмотренытехническиехарактеристикиосновныхвидовгазогорелочныхустройств, применяющихся в промышленных печах. Приведены основные справочныевеличины, таблицы, номограммы, необходимыедлявыполнениякурсовой работы.
Пособие предназначено для студентов всех форм обучения по специальности 270109 – теплогазоснабжение и вентиляция.
Табл. 12. Ил. 10. Библиогр.: 16 назв.
Рекомендовано Редакционно-издательским советом СПбГАСУ в качестве учебного пособия
ISBN 978-5-9227-0160-0 |
Г. П. Комина, В. А. Яковлев, 2009 |
|
Санкт-Петербургский государственный |
|
архитектурно-строительный университет, 2009 |
ПРЕДИСЛОВИЕ
Основным видом многочисленных топливно-энергетических ресурсов, наиболее широко использующимся в промышленной индустрии и жилищно-коммунальном хозяйстве, является газовое топливо, вчастности природный газ. Ресурсы использования природного газа в мире весьма разнообразны, но не безграничны.
Как топливо газ обладает множеством ценных свойств. Так, природный газ, добываемый на большинстве газовых месторождений Российской Федерации, не содержит серы, следовательно, при его горении не происходит образования диоксидов серы SO2, что значительно улучшает экологические показатели продуктов сгорания; газ имеет достаточно высокую теплоту сгорания из-за высокого содержания природного метана (95–98 %) и ничтожно низкого содержания балластных примесей; отсутствие оксида углерода СО в составе природного газа делает этот газ в отличие от искусственных газов (доменный, коксовый) нетоксичным для человека.
Природный газ может использоваться не только в качестве топлива, ноикакценноесырьёдляхимическойпромышленности. В связи с этим особенно остро стоит вопрос о рациональном (экономном) применении природного газа и других видов энергетических ресурсов в качестве топлива.
Какизвестно, тепловаяэнергияобразуетсяврезультатехимической реакции горения, т. е. соединения органической составляющей, входящей в химический состав топлива, с кислородом воздуха, протекающего при температуре горения. Из 100 % выделившейся тепловой энергии, как показывают практические исследования промышленных печей, в результате прохождения химических реакций горения большая её часть теряется. Потери тепловой энергии обусловлены в большей степени несовершенством конструкций промышленных печей. Часть тепловой энергии теряется черезнаружныеограждениятопочнойкамерыпромышленнойпечи, часть – ввиделучистойэнергии, выбивающейсяиз открытых две-
3
рец в момент загрузки и выгрузки деталей и т. д., а большая часть общихпотерьтепловойэнергииуноситсяспотокомуходящихпродуктовсгорания. Этимобусловливаетсячрезвычайно низкий КПД всех промышленных печей – 15–25 %, а то и ещё ниже.
Отсюдаочевидно, чтоснижениепотерьтепловойэнергиитолько за счёт решений, направленных на отбор тепловой энергии
сдальнейшимеёполезнымиспользованием, приведеткзначительной экономии топливно-энергетических ресурсов страны.
Главной целью изучения курса «Энергосбережение и экономия энергоресурсов в системах теплогазоснабжения (ТГС)» является углубленное изучение основных вопросов рационального использованияэнергетическихресурсоввпромышленнойиндустрии и жилищно-коммунальном хозяйстве. Овладение теоретическими знаниямиипрактическиминавыкамипомогаетспециалистампринимать грамотные технические решения по составлению (компоновке) схем использования вторичных энергетических ресурсов в системах теплогазоснабжения (ТГС), повышающих коэффициент использования тепловой энергии и топлива.
Впроцессе изучения специального курса студенты в курсовой работе выполняют тепловой расчёт принятой тепловой схемы отбора тепловой энергии отходящих газов промышленной печи
споследующимиспользованиемэтойэнергии. Студентдолжентехнически грамотно и научно обоснованно разрабатывать решения по выбору схем использования вторичных энергетических ресурсов. При работе необходимо руководствоваться соответствующими правилами Ростехнадзора РФ, СНиП, законом РФ «Об энергосбережении» и другими нормативными документами.
Глава 1. ОСНОВНЫЕ ПУТИ ДОСТИЖЕНИЯ ЭФФЕКТИВНОГО ИСПОЛЬЗОВАНИЯ ТЕПЛОВОЙ ЭНЕРГИИ ПРОДУКТОВ СГОРАНИЯ
1.1. Меры, направленные на сбережение энергоресурсов
Внастоящее время одним из основных путей экономии топ- ливно-энергетическихресурсоввпромышленномижилищно-ком- мунальномэнергетическомсектореявляетсяповышениеэффективности их использования путём утилизации теплоты отходящих газов.
Врешение энергетической программы нашей страны значительный вклад может внести применение теплоутилизационных установок, работающих на отходящих газах котельных, промышленных тепловых установок, промышленных печей и т. п. Вопрос экономного расходования топлива актуален как в нашей стране, так и за рубежом, поэтому работы по выбору и проектированию теплоутилизационных установок находят всё большее распространение и применение.
Выбор схем утилизации теплоты отходящих газов и типов применяемых теплоутилизаторов зависит от источников теплоты, возможности использования теплового потенциала отходящих газов, потребителей теплоты, вида топлива и состава отходящих газов, определяющего их агрессивность по отношению к теплотехническому оборудованию.
Побудительным мотивом установки теплоутилизаторов является стремление наиболее полно удовлетворить энергетические потребностинепутёмвводадополнительныхмощностей, азасчёт энергосбережения – использования вторичных энергетических ресурсов.
Правильныйвыбортипаитребуемойпроизводительноститеплоутилизатораопределяетсямощностьюэнергетических установок
иналичием реальных потребителей утилизируемой теплоты.
4 |
5 |
1.2. Области применения вторичных энергетических ресурсов в системах ТГС
В качестве потребителей теплоты вторичных энергетических ресурсовмогутрассматриватьсякотельные, систематеплоснабжения и промышленные потребители, использующие теплоту для технологических и нетехнологических целей.
Вторичные энергетические ресурсы могут применяться в водоподогревателяхсистемисходнойихимическиочищеннойводы, горячего водоснабжения, подогрева питательной воды для технологических и нетехнологических нужд предприятий, теплоснабжения тепличных и парниковых хозяйств, открытых и закрытых плавательных бассейнов, мойки улиц и транспортных средств, а также в воздухоподогревателях систем отопления складских помещений, тепловых завес, размораживания твёрдого топлива и строительных сыпучих материалов, подачи вторичного воздуха в зону горения топлива.
Глава 2. ОСНОВНЫЕ ПОЛОЖЕНИЯ И ТРЕБОВАНИЯ К ВЫПОЛНЕНИЮ КУРСОВОЙ РАБОТЫ ПО ДИСЦИПЛИНЕ «ЭНЕРГОСБЕРЕЖЕНИЕ
ИЭКОНОМИЯ ЭНЕРГОРЕСУРСОВ В СИСТЕМАХ ТГС»
2.1.Составные части и объём курсовой работы
В состав расчетно-пояснительной записки должны входить:
1)титульный лист;
2)задание на проектирование с описанием исходных данных и технических характеристик используемого теплового оборудования;
3)составлениематериальногобалансагорениягазовойсмеси:
 вычисление высшей и низшей теплоты сгорания газовой смеси;
вычисление высшей и низшей теплоты сгорания газовой смеси;
 вычислениепотребностейреакцийгорения газовойсмеси в сухом и влажном воздухе;
вычислениепотребностейреакцийгорения газовойсмеси в сухом и влажном воздухе;
 вычисление образующихся в результате химических реакций горения конечных объёмов продуктов сгорания газовой смеси;
вычисление образующихся в результате химических реакций горения конечных объёмов продуктов сгорания газовой смеси;  вычисление плотностей газовой смеси, воздуха и продук-
вычисление плотностей газовой смеси, воздуха и продук-
тов сгорания;
 вычисление калориметрической и действительной температуры горения газовой смеси;
вычисление калориметрической и действительной температуры горения газовой смеси;
4) составление теплового баланса промышленной печи:
 определение расхода газового топлива, необходимого для надлежащей работы промышленной печи;
определение расхода газового топлива, необходимого для надлежащей работы промышленной печи;
 определение термического КПД и коэффициента использования топлива;
определение термического КПД и коэффициента использования топлива;
5)подбор газогорелочных устройств для промышленной
печи;
6)разработка схемы ступенчатого использования теплоты продуктовсгорания суказанием техническойхарактеристики теплоутилизаторов, включаемых в тепловую схему;
7)определение энергетического КПД тепловой схемы;
8)основные выводы;
9)список использованной литературы.
Всоставграфическойчастирасчётно-пояснительнойзаписки должна входить схема ступенчатого использования теплоты отходящих от промышленной печи продуктов сгорания.
2.2. Состав курсовой работы и требования по её выполнению
В курсовой работе необходимо:
выполнить расчёт теплового баланса промышленной печи заданной конструкции, на основании которого определить величину термическогоКПДпечи, коэффициентаиспользованиятоплива, расхода газовой смеси, подаваемой в газогорелочные устройства печи; разработать схему использования вторичных энергоресурсов (теплоты отходящих газов) промышленной печи для повышения
6 |
7 |
энергетическогоКПДсхемыиэкономииприродногогазовоготоплива;
определить численное значение энергетического КПД после каждой ступени с учётом разработанных мероприятий по энергосбережению.
Курсоваяработадолжнасостоятьизсброшюрованнойрасчёт- но-пояснительной записки с вычерченной на формате А3 или А4 тепловой схемой утилизации вторичных энергоресурсов.
Глава3. ГОРЕНИЕГАЗОВ
3.1.Материальный баланс горения газов
Воснове расчётов материального и теплового балансов горения любых видов топлива лежат стехиометрические термохимические уравнения, которые можно представить в виде уравнения материального баланса горения топлива
k |
l |
|
¦ni Mi |
¦n j M j , |
(3.1) |
i 1 |
j 1 |
|
где Mi , M j – количество исходных и конечных веществ соответственно, моли;
ni , n j – стехиометрические коэффициенты для исходных и конеч-
ных продуктов соответственно.
Уравнение в такой форме может быть записано на основании закона сохранения массы реагирующих веществ и закона простых кратных соотношений молей или объёмов реагирующих веществ.
Вкачестве окислителя при сжигании газа обычно применяют воздух, реже – чистый атомарный кислород. Объёмный состав сухого воздуха для всех теплотехнических расчётов принимается следующим: кислорода – 21 %, азота – 79 %. Следовательно, 1 м3
кислорода содержится в 100/21 – 4,76 м3 воздуха, или на 1 м3 кислорода приходится 79/21 = 3,76 м3 азота. Если учесть, что 1 кмоль любого газа при нормальных физических условиях t = 0 °C, Р = 760 мм рт. ст. занимает примерно одинаковый объём, реакции горения простых газов в воздухе могут быть выражены следующими уравнениями:
2 H2 O2 3,76 N2 |
2 H2O 3,76 N2 |
|
|
|||
, |
|
|
|
|
|
|
2 м3 |
4,76 м3 |
2 м3 |
3,76 м3 |
|
|
|
|
|
|
|
|
||
|
|
|
5,76 м3 |
|
|
|
2 CO О 3,76 N |
2 CO |
3,76 N |
|
|
||
, |
2 2 |
2 |
2 |
|
|
|
2 м3 |
3 |
2 м |
3 |
3 |
|
|
|
4,76 м |
|
3,76 м |
|
|
|
|
|
|
|
|
||
|
|
|
5,76 м3 |
|
|
|
СН4 2 О2 7,52 N2 |
CO2 7,52 N2 2 H2O |
|
||||
, |
|
|
|
|
||
1 м3 |
9,52 м3 |
|
8,52 м3 |
2 м3 |
|
|
|
|
|
|
|||
|
|
|
|
10,52 м3 |
|
|
С2Н6 3,5 О2 13,16 N2 |
2 CO2 13,16 N2 3 H2O |
|||||
, |
|
|
|
|
||
1 м3 |
16,66 м3 |
|
|
15,16 м3 |
|
3 м3 |
|
|
|
|
|
||
|
|
|
|
18,16 м3 |
|
|
С3Н8 5 О2 18,8 N2 |
3 CO2 18,8 N2 |
4 H2O |
||||
, |
|
|
|
|||
1 м3 |
23,8 м3 |
|
|
21,8 м3 |
4 м3 |
|
|
|
|
||||
|
|
|
|
25,8 м3 |
|
|
С4Н10 |
6,5 О2 24,44 N2 |
4 CO2 24,44 N2 |
5 H2O |
|||
|
|
|
|
|
||
1м3 |
30,94 м3 |
|
|
28,44 м3 |
|
5 м3 |
|
|
|
|
|
||
|
|
|
|
33,44 м3 |
|
|
Из этих соотношений можно найти теоретическую потребность в кислороде и воздухе, а также количество и состав продуктов горения отдельных видов газов при полном сгорании в теоретическом количестве воздуха.
8 |
9 |
В состав реакций горения входят все компоненты (составляющие) воздуха: кислородиазот. Вреакциюгорениявступаеттолько кислород, который взаимодействует с горючим газом как окислитель. Азот N2 является балластом, в горении не участвует и горения неподдерживает, к томужепри высоких температурах, развивающихся в зоне горения, разлагается, образуя канцерогенные вещества NOx (NO и NO2).
Для определения количества и состава компонентов продуктовсгорания, образующихсяприполномсгораниигазовоготоплива, составляют материальный баланс горения газа.
Горением называют протекающую сравнительно быстро во времени химическую реакцию соединения горючих компонентов с кислородом, сопровождающуюся интенсивным выделением теплоты и резким повышением температуры продуктов сгорания. Реакциигоренияописываютсястехиометрическимиуравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате её вещества. Общее уравнение реакции горения любого углеводорода записывается в виде уравнения
§ |
n · |
|
|
§ n |
· |
|
|
|||
СmHn ¨m |
|
¸ |
O2 |
m CO2 |
¨ |
|
¸ |
H2O Q, |
(3.2) |
|
4 |
2 |
|||||||||
© |
¹ |
|
|
© |
¹ |
|
|
|||
где m, n – число атомов углерода и водорода в молекуле, шт.;
Q – тепловой эффект реакции, или теплота, выделившаяся в результате сгорания, кДж/кмоль (кДж/кг, кДж/м3).
Теплотой сгорания (тепловым эффектом) называется количество теплоты, которое выделится в результате полного сгорания 1 кмоля, 1 кг или 1 м3 газа при нормальных физических условиях. Различают высшую Qв и низшую Qн теплоту сгорания топлива. Высшая теплота сгорания включает в себя величину скрытой теплоты конденсации водяных паров, содержащихсяв продуктах сгорания. Обычно при сжигании газового топлива водяные пары, как правило, не конденсируются, а удаляются вместе с другими про-
дуктамисгоранияпри температуре130 150 °С, поэтомутехнические расчёты обычно ведут по низшей теплоте сгорания, т. е. без учёта скрытой теплоты конденсации водяных паров, составляющей приблизительно 2260 кДж/кг. Однако если за тепловой установкой планируется установка устройств, способных отобрать скрытую теплоту конденсации водяных паров, содержащихся впродуктахсгорания, споследующимеёполезнымиспользованием, то расчёт необходимо выполнять по высшей теплоте сгорания топлива.
150 °С, поэтомутехнические расчёты обычно ведут по низшей теплоте сгорания, т. е. без учёта скрытой теплоты конденсации водяных паров, составляющей приблизительно 2260 кДж/кг. Однако если за тепловой установкой планируется установка устройств, способных отобрать скрытую теплоту конденсации водяных паров, содержащихся впродуктахсгорания, споследующимеёполезнымиспользованием, то расчёт необходимо выполнять по высшей теплоте сгорания топлива.
Высшая и низшаятеплотасгорания газовых смесей численно равна сумме произведений соответственно высшей или низшей теплоты сгорания каждого компонента, входящего в состав газовой смеси, на его объёмную, массовую или молярную долю:
Q r1 Q1 r2 Q2 ... rn Qn , |
(3.3) |
где r1, r2 ,...,rn – объёмные доли компонентов, входящих в состав газовой смеси, м3/м3г ;
Q1, Q2 ,...,Qn – высшая или низшая теплота сгорания компонентов газовой смеси, кДж/м3г .
Низшаятеплота сгорания сложных газовых смесей определяется по формуле
n |
|
Qн ¦Qнi ri , |
(3.4) |
i 1 |
|
где Qнi – низшая теплота сгорания i-го компонента, входящего
в состав газовой смеси, кДж/м3 . Находится по таблицам справочной литературы или по табл. 5 прил. II.
Высшая теплота сгорания сложных газовых смесей рассчитывается по формуле
n |
|
Qв ¦Qвi ri , |
(3.5) |
i 1 |
|
10 |
11 |
где Qвi – высшая теплота сгорания i-го компонента, входящего
в состав газовой смеси, кДж/м3 . Определяется по таблицам справочной литературы или по табл. 5 прил. II.
Низшая и высшая теплота сгорания основных компонентов, входящих в состав газовых смесей, приведена в табл. 5 прил. II.
В практических расчётах вычисление низшей Qнр и высшей
Qр теплотысгорания природныхгазовых смесей, кДж/м3 |
, можно |
||||||||||||||||||
в |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
г |
|
|
производить по следующим выражениям: |
|
|
|
|
|
|
|
||||||||||||
n |
|
|
|
QнH2 rН2 QнCО rСО QнCH4 rСН4 QнC2H6 rС2Н6 |
|||||||||||||||
Qнр ¦Qнi ri |
|
||||||||||||||||||
i 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
QC3H8 |
r |
|
|
QC4H10 |
r |
|
|
|
|
QC5H12 |
r |
|
|
QC2H4 |
r |
|
Н |
|
|
н |
С Н |
8 |
н |
С Н |
|
н |
С Н |
н |
С |
4 |
|
||||||||
|
|
3 |
|
|
4 |
10 |
|
|
5 |
12 |
|
|
2 |
|
|
||||
QC3H6 |
r |
|
|
QC4H8 |
r |
|
Н |
; |
|
|
|
|
|
|
|
|
|
|
|
н |
С Н |
6 |
н |
С |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
3 |
|
|
4 |
|
8 |
|
|
|
|
|
|
|
|
|
|
|
|
Qнр 0,01 (10 790 Н2 12 640 СО 35 880 СН4 |
|
|
|
|
(3.6) |
||||||||||||||
64 300 С2Н6 93 180 С3Н8 123 500 С4Н10
122 700 С4Н10 156 600 С5Н12 59 500 С2Н4
88 400 С3Н6 113 800 С4Н8 );
n |
|
|
|
QвH2 rН2 QвCО rСО QвCH4 rСН4 QвC2H6 rС2Н6 |
||||||||||||||
Qвр ¦Qвi ri |
|
|||||||||||||||||
i 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
QC3H8 |
r |
|
|
QC4H10 |
r |
|
|
|
|
QC5H12 |
r |
|
QC2H4 |
r |
|
Н |
|
|
в |
С Н |
8 |
в |
С Н |
|
в |
С Н |
в |
С |
4 |
|
|||||||
|
|
3 |
|
|
4 |
10 |
|
5 |
12 |
|
|
2 |
|
|
||||
QC3H6 |
r |
|
|
QC4H8 |
r |
|
Н |
; |
|
|
|
|
|
|
|
|
|
|
в |
С Н |
6 |
в |
С |
|
|
|
|
|
|
|
|
|
|
||||
|
|
3 |
|
|
4 |
|
8 |
|
|
|
|
|
|
|
|
|
|
|
Qвр 0,01 (12 750 Н2 12 640 СО 39 800 СН4 |
|
|
|
|
(3.7) |
|||||||||||||
70 300 С2Н6 101 200 С3Н8 113 800 С4Н10132 900 С4Н10 169 300 С5Н12 36 000 С2Н491 900 С3Н6 121 400 С4Н8 ),
где Н2 , СО, СН4 и т. д. – процентное содержание компонентов, входящих в газовую смесь;
rН2 , rСО, rСН4 , ... – объёмныедоликомпонентов, входящих всмесь, м3/м3г ;
QвH2 , QвCО, QвCH4 , ... – высшая теплота сгорания компонентов, вхо-
дящих в состав газовой смеси, кДж/м3 ;
QнH2 , QнCО, QнCH4 , ... – низшая теплота сгорания компонентов, вхо-
дящих в состав газовой смеси, кДж/м3 .
Коэффициенты, стоящиепередпроцентнымсодержаниемкомпонентов, являются табличными значениями высшей и низшей
теплоты сгорания компонентов, кДж/м3 .
Кислород для сжигания газового топлива обычно подаётся в составе воздуха.
Потребности в кислороде воздуха при сжигании сложных газовых смесей определяются на основании теоретической потребности в кислороде отдельных компонентов, входящих в состав
смеси, м3в/м3г :
Vтс |
|
♣ |
|
n |
|
∙ |
|
|
4,76 |
♦ |
¦VОi |
2 |
ri ÷ |
, |
(3.8) |
||
|
|
♥ i |
1 |
|
≠ |
|
|
|
где ri – объёмные доли i-х компонентов, входящих в состав газо-
вой смеси, м3/м3г ;
VОi 2 – теоретическая потребность i-го компонента в атомарном кислороде, необходимомдляполногосгораниякомпонентасоглас-
но его химической реакции горения, м3O2 /м3г . Теоретическая по-
требность в кислороде основных компонентов, входящих всостав природных газовых смесей, приведена в табл. 6 прил. II;
4,76 – объёмвоздуха, вкоторомсодержится1 м3 кислорода, м3в/м3O2 .
12 |
13 |
Уравнение (3.8) для большинства природных газовых смесей можно представить в развёрнутом виде:
V с |
|
♣ |
n |
|
r |
∙ |
4,76 |
V Н2 |
r |
V СО r |
V СН4 |
r |
|
|
||
4,76 ♦ |
ƒV i |
÷ |
|
|||||||||||||
т |
|
♥ i 1 |
О2 |
i |
≠ |
|
О2 |
Н2 |
О2 |
СО |
О2 |
СН4 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
V С2Н6 |
r |
|
V С3Н8 |
r |
V С4Н10 r |
V С5Н12 r |
|
|
|
|||||||
|
О2 |
С2Н6 |
|
О2 |
|
С3Н8 |
О2 |
. |
С4Н10 |
О2 |
С5Н12 |
|
|
|||
V С2Н4 |
r |
|
V С3Н6 |
r |
О |
2 |
|
|
|
|
|
|
||||
|
О2 |
С2Н4 |
|
О2 |
|
С3Н6 |
|
|
|
|
|
|
|
|
||
В практических расчётах вычисление теоретической потребности в О2 газовых смесей можно производить по формуле
V с |
4,76 |
0,5 |
Н |
2 |
0,5 СО 2 |
СН |
4 |
3,5 |
С |
Н |
6 |
|
|
||||||||||||
т |
100 |
|
|
|
|
|
2 |
|
|
|||
|
|
С4Н10 8,0 С5Н12 3 С2Н4 |
|
|
|
|||||||
5 С3Н8 6,5 |
|
|
(3.9) |
|||||||||
4,5 С3Н6 6 |
С4Н8 О2 , |
|
|
|
|
|
|
|
||||
где коэффициенты, стоящие передкомпонентами газовой смеси, – это теоретическая потребность в кислороде компонентов смеси, м3в/м3г ;
Н2 , СО, СН4 , ... – процентноесодержаниекомпонентов, входящих
всостав газовой смеси.
Теоретический объём влажного воздуха Vтвл , м3в/м3г , больше теоретического объёмасухого воздуха Vтс на величинуобъёма, занимаемого содержащимися в нём водяными парами, м3в/м3г :
|
V вл |
V с 0,00124 d |
в |
V с, |
(3.10) |
|
т |
т |
т |
|
|
где V с |
– теоретический объём сухого воздуха, необходимого для |
||||
т |
|
|
|
|
|
полного сгорания 1 м3 газовой смеси, м3в/м3г ;
dв – влагосодержание атмосферного воздуха, г/кг..
Действительнаяпотребностьввоздухе Vдвл, м3в/м3г , вследствие
несовершенства смешения горючего газа и окислителя в процессе горения принимается несколько больше теоретической (на величину 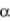 ):
):
V вл |
V вл Δ, |
(3.11) |
д |
т |
|
где  – коэффициент избытка воздуха, который для практически применяемыхгорелокдолженсоответствоватьтребованиямГОСТ. В реальных условиях при сжигании газа коэффициент
– коэффициент избытка воздуха, который для практически применяемыхгорелокдолженсоответствоватьтребованиямГОСТ. В реальных условиях при сжигании газа коэффициент 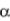 всегда должен быть больше 1, так как в противном случае неминуемы химическая неполнота сгорания и выброс вредных веществ в атмосферу. Исключение составляют отдельные процессы, для прохождения которых необходимо создание в нагревательных камерах печей нейтральной или малоокислительной среды.
всегда должен быть больше 1, так как в противном случае неминуемы химическая неполнота сгорания и выброс вредных веществ в атмосферу. Исключение составляют отдельные процессы, для прохождения которых необходимо создание в нагревательных камерах печей нейтральной или малоокислительной среды.
Объёмыотдельныхкомпонентовпродуктовсгораниягазовых смесей могут быть определены по приведенным далее формулам.
Объём содержащегося в продуктах сгорания диоксида углерода, м3СО2 /м3г , вычисляется по формуле
VCO2 0,01 CО СО2 СН4 2 С2Н4 ƒ m CmНn . (3.12)
Объём содержащихся в продуктах сгорания водяных паров,
м3Н2О / м3г , определяется по формуле
VН2О |
♣ |
Н2 |
2 |
СН4 2 С2Н4 |
♣ n |
∙ |
∙ |
|
||||
0,01 ♦ |
¦♦ |
2 |
÷ |
CmHn ÷ |
|
|||||||
|
♥ |
|
d |
|
|
|
V с . |
♥ |
≠ |
≠ |
|
|
|
0,00124 |
г |
α d |
в |
|
|
|
|
(3.13) |
|||
|
|
|
|
|
т |
|
|
|
|
|
||
Объём содержащегося в продуктах сгорания азота, м3N2 /м3г , находится по формуле
14 |
15 |

V |
0,79 V с 0,01 N |
2 |
. |
(3.14) |
N2 |
т |
|
|
Объём содержащегося в продуктах сгорания кислорода, м3О2 / м3г , определяется по формуле
V |
0,21 Δ1 V с, |
(3.15) |
O2 |
т |
|
где VCO2 , VН2О, VN2 , VO2 – объёмы компонентов СО2, Н2О, N2, O2 , м3/м3г , содержащихся в продуктах сгорания;
Н2 , СО, СН4 ,... – процентноесодержаниеотдельныхкомпонентов, входящих в состав газовой смеси;
dв, dг – влагосодержание подаваемого на горение воздуха и газа, г/кг; 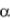 – коэффициент избытка воздуха.
– коэффициент избытка воздуха.
Полный объём влажных продуктов сгорания, м3п.с / м3г , определяется по формуле
V вл |
V |
V |
V |
V |
. |
(3.16) |
п.с |
CO2 |
H2O |
N2 |
O2 |
|
|
3.2. Температура горения
Различают следующие температуры горения газов: температуру жаропроизводительности, калориметрическую, теоретическую, действительную.
Температура жаропроизводительности
Температура жаропроизводительности tж – это максималь-
ная температура продуктов полного сгорания газа, которая может
развиться при адиабатических условиях, т. е. без подвода и отвода теплоты, с коэффициентом избытка воздуха 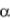 = 1,0, при темпера-
= 1,0, при темпера-
туре газа t'г и воздуха t'в , равной 0 °С.
|
Qр |
|
tж |
н |
, |
n |
||
|
¦Vi cжpi |
(3.17) |
|
i 1 |
|
n |
|
|
|
|
|
|
|
|
где ¦Vi cжpi – сумма произведений удельных объёмов и теплоём- |
||||||||
i 1 |
|
|
|
|
|
|
|
|
костей компонентов продуктов сгорания. |
|
|
|
|||||
В развёрнутом виде температуру жаропроизводительности |
||||||||
можно представить как |
|
|
|
|
|
|
||
|
|
|
Qр |
|
|
|
|
|
tж |
|
|
н |
|
|
, |
(3.18) |
|
V |
cж |
V |
cж |
V |
cж |
|||
|
CO2 |
CO2 |
H2O |
H2O |
N2 |
N2 |
|
|
где Qнр – низшая теплота сгорания газовой смеси в пересчёте на рабочий состав топлива, кДж/м3г ;
VCO2 , VН2О, VN2 – объёмыкомпонентовСО2, Н2О, N2, содержащих-
сявпродуктахсгораниягаза, м3/м3г , вычисленныхпри |
1 итем- |
пературе tж; |
|
cCOж 2 , cHж2O , cNж2 – удельнаяобъёмнаятеплоёмкостьприпостоянном
давлении компонентов СО2, Н2О, N2, кДж/м3 град, при температуре жаропроизводительности газовой смеси tж.
Температуру жаропроизводительность tж горючих газовых смесей определяют методом последовательных приближений, так кактеплоёмкостьгазовнепостояннаиувеличиваетсясповышениемтемпературы. Зависимостьтеплоёмкостей компонентов от тем-
16 |
17 |

пературы представлена в табл. 1 прил. II. Для определения температурыжаропроизводительностипредварительнозадаютсяеёзначением для природных газов (около 2000 °С). Далее определяют их среднюю теплоёмкостьи подсчитываютпо формуле(3.18) температуружаропроизводительности газа. Если в результате подсчётаонаокажетсянижеиливышепринятой, тозадаютсядругойтемпературой и расчёт повторяют до тех пор, пока принятая температура и расчётная не совпадут.
Температура жаропроизводительности распространённых простых и сложных газов при их горении в сухом воздухе представлена в табл. 8 прил. II. При сжигании газа в атмосферном воздухе, содержащем около 1 вес. % влаги, температура жаропроизводительности снижается на 25 30 °С.
30 °С.
Температура калориметрическая
Калориметрическая температура tк определяется без учёта диссоциацииводяныхпаровидиоксидауглерода, носучётомфактической температуры подаваемого газа и воздуха. Она отличаетсяоттемпературыжаропроизводительностиtж тем, чтотемпература газа и воздуха, а также коэффициент избытка воздуха  принимаются по их действительным значениям.
принимаются по их действительным значениям.
|
Qр q |
|
|
|
tк |
н |
физ |
, |
(3.19) |
n |
|
|||
|
¦Vi cкpi |
|
|
|
|
i 1 |
|
|
|
или в развёрнутом виде
|
|
|
|
Qр |
q |
|
|
|
|
|
|
|
tк |
|
|
|
н |
|
физ |
|
|
|
|
, |
(3.20) |
V |
cк |
V |
cк |
|
V |
N2 |
cк |
V |
cк |
|||
|
CO2 |
CO2 |
H2O |
H2O |
|
N2 |
O2 |
O2 |
|
|||
где qфиз – физическая теплота, вносимая в топочный объём с воздухом и газовым топливом, кДж/м3г ;
VCO2 , VН2О, VN2 , VO2 – объёмы компонентов СО2, Н2О, N2, О2, содержащихся в продуктах сгорания газа при действительном коэф-
фициенте избытка воздуха 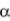 > 1 и температуре tк, м3/м3г ;
> 1 и температуре tк, м3/м3г ;
cCOк 2 , cHк 2O , cNк 2 , cOк2 – объёмнаятеплоёмкостьприпостоянномдав-
лении компонентовСО2, Н2О, N2, О2 итемпературеtк, кДж/м3 град. Природные и сжиженные углеводородные газы перед сжиганием из-за высокой теплоты сгорания обычно не нагревают,
иих объём по сравнению с объёмом воздуха, идущим на горение, невелик, поэтому при определении калориметрической температуры теплосодержание газов можно не учитывать. При сжигании газов с низкой теплотой сгорания (генераторные, доменные газы
идр.) их теплосодержание (в особенности нагретых до сжигания) оказывает весьма существенное влияние на калориметрическую температуру.
Физическая теплота, вносимая в топочный объём, кДж/м3г , определяется по формуле
q |
qг |
qв |
, |
(3.21) |
физ |
физ |
физ |
|
|
где qфизг – физическаятеплота, вносимая в топочный объём с газовым топливом, кДж/м3г ;
qфизв – физическая теплота, вносимая в топочный объём с воздухом, кДж/м3г .
|
qфизг |
n |
|
|
¦Vгi c'рi tг' , |
(3.22) |
|
|
|
i 1 |
|
где V i |
– объёмные доли i-х компонентов, входящих в состав газо- |
||
г |
|
|
|
вой смеси. Определяются по составу газовой смеси, м3/м3г ;
18 |
19 |
