
Описание оборудования и метода измерения
Для проведения опытов понадобятся:
Химические стаканы на 100 и 250 мл. В химических стаканах проводят смешивание веществ для осуществления химических реакций.
Мерные цилиндры на 100 и 250 мл. С помощью мерных цилиндров отмеряют необходимый объём воды.
Фарфоровая ложечка, стеклянная палочка. С помощью фарфоровой ложечки берут твёрдые реактивы из банки, а с помощью стеклянной палочки перемешивают растворы.
Банка с реактивом (соль NaCl).
Колба с растворителем (дистиллированная вода H2O).
Ареометр.
С помощью ареометра определяют плотность
растворов. Ареометр представляет собой
поплавок с узкой трубкой, на которую
нанесена шкала, проградуированная в
единицах плотности (рисунок 8.1). Внутри
поплавка насыпана дробь. Принцип действия
ареометра основан на законе Архимеда.
На погруженный в раствор ареометр
действуют две силы – сила тяжести
помощью ареометра определяют плотность
растворов. Ареометр представляет собой
поплавок с узкой трубкой, на которую
нанесена шкала, проградуированная в
единицах плотности (рисунок 8.1). Внутри
поплавка насыпана дробь. Принцип действия
ареометра основан на законе Архимеда.
На погруженный в раствор ареометр
действуют две силы – сила тяжести![]() и сила Архимеда (выталкивающая сила)
и сила Архимеда (выталкивающая сила)![]() .
В состоянии покоя эти две силы
уравновешивают друг друга, то есть
выполняется условие
.
В состоянии покоя эти две силы
уравновешивают друг друга, то есть
выполняется условие
![]() ,
,
где р-ра – плотность раствора;
m – масса ареометра;
V – объём вытесненной жидкости.
Таким образом, объём вытесненной ареометром жидкости обратно пропорционален плотности раствора, то естьв растворы с различной плотностью ареометр погружается на разную глубину.
Определение плотности раствора с помощью ареометра осуществляют следующим образом. Ареометр помещают в стакан с раствором, при этом он не должен касаться дна и стенок стакана, а уровень жидкости должен находить в пределах шкалы ареометра, и считывают показания по шкале (показания следует снимать по нижнему краю мениска, так как раствор соли является прозрачным).
Опыт 1. Приготовление водного раствора соли NaCl с заданной массовой долей % из чистого вещества.
Для приготовления водного раствора соли NaCl с заданной массовой долей % из чистого вещества необходимо к данной массе соли добавить определённое количество воды (рисунок 8.2).

Чтобы рассчитать необходимое количество воды воспользуемся определением плотности вещества
 .
.
Так как водный раствор образуется при смешивании вещества с водой, то масса раствора равна
![]() ,
,
откуда масса воды
![]() .
(8.3)
.
(8.3)
Массу раствора можно определить, зная массовую долю раствора
![]() .
(8.4)
.
(8.4)
Тогда, подставляя формулу (8.4) в выражение (8.3), получим
![]() ,
,
а, следовательно,
 .
(8.5)
.
(8.5)
Для того, чтобы рассчитать молярную и моляльную концентрации, необходимо определить количество используемого вещества (соли NaCl)
![]() ,
,
где М(NaCl) =23 + 36 = 59г/моль– молярная масса солиNaCl.
Молярная и моляльная концентрации раствора могут быть определены по формулам (8.1) и (8.2).
Опыт 2. Приготовление водного раствора соли NaCl с заданной массовой долей 2% из более концентрированного раствора с массовой долей 1%.
Д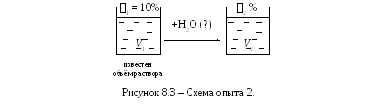 ля
приготовления разбавленного водного
раствора солиNaCl
с заданной массовой долей 2%
необходимо к концентрированному раствору
с массовой долей 1%
добавить определённое количество воды
(рисунок 8.3).
ля
приготовления разбавленного водного
раствора солиNaCl
с заданной массовой долей 2%
необходимо к концентрированному раствору
с массовой долей 1%
добавить определённое количество воды
(рисунок 8.3).
В результате этого масса растворённого вещества не изменяется, а массовая доля растворённого вещества уменьшается.
Чтобы определить необходимое количество воды нужно
![]() ,
,
где V1, V2 – объёмы растворов.
Так как объём концентрированного раствора V1 известен, то необходимо рассчитать объём получаемого раствора V2.
Для этого дважды воспользуемся формулой для рассчёта массовой доли вещества, учитывая, что масса растворённого вещества не изменяется
![]() ,
(8.6)
,
(8.6)
![]() .
(8.7)
.
(8.7)
Приравнивая
левые части формул (8.6) и (8.7) и учитывая,
что ![]() ;
;
![]() ,
получим
,
получим
![]() .
.
Тогда
![]() .
(8.8)
.
(8.8)
