
Лабораторная работа № ксе-04 спектральный анализ
КАК ЭКСПЕРИМЕНТАЛЬНОЕ ПОДТВЕРЖДЕНИЕ КВАНТОВОЙ ТЕОРИИ
Цель работы:
1. Ознакомиться с теорией строения атома на примере атома водорода.
Ознакомиться с закономерностями расположения спектральных серий и спектральных линий в спектре атома водорода.
Подтвердить справедливость сериальной формулы Бальмера.
4. Ознакомиться с характером спектров излучения газов, паров, и твёрдых тел.
Теоретическое введение
В 1911 году Э. Резерфордом была
предложенаядерная
(планетарная) модель атома.
В центре атома химического элемента с
порядковым номером Z
в таблице Менделеева расположено
маленькое (диаметр 10151014
м) массивное (99,95% массы атома) ядро, заряд
которого + Zе
(е – элементарный
заряд). Вокруг ядра, подобно планетам,
под действием силы Кулона вращаются Z
отрицательно заряженных электронов,
образуя электронную оболочку атома
(рисунок 4.1).
Атом в целом нейтрален.
1911 году Э. Резерфордом была
предложенаядерная
(планетарная) модель атома.
В центре атома химического элемента с
порядковым номером Z
в таблице Менделеева расположено
маленькое (диаметр 10151014
м) массивное (99,95% массы атома) ядро, заряд
которого + Zе
(е – элементарный
заряд). Вокруг ядра, подобно планетам,
под действием силы Кулона вращаются Z
отрицательно заряженных электронов,
образуя электронную оболочку атома
(рисунок 4.1).
Атом в целом нейтрален.
Планетарная модель атома Резерфорда явилась крупным шагом в развитии знаний о строение атома, однако не смогла объяснить длительность существования атома (его устойчивость), поскольку противоречила законам классической физики. Преодоление возникших трудностей потребовало создание новой – квантовой– теории строения атома.
В 1913 году датский физик Нильс Бор предложил отказаться от многих представлений классической физики и сформулировал постулаты, на основе которых должна строиться новая теория строения атома:
1. Постулат стационарных состояний: В атоме существуют стационарные орбиты, находясь на которых электрон обладает дискретным значением энергии Еn (n номер орбиты); в стационарном состояние атом не поглощает и не излучает энергию.
2. Правило частот: При переходе электрона со стационарной орбиты с номером n на стационарную орбиту с номером k происходит (рисунок 4.2):
излучение фотона с энергией hνnk, если n > k (например, переход с уровня Е3 на Е2);
п
 оглощение
фотона с энергиейhνnk,
если n < k
(например, переход с уровня Е1
на Е2).
оглощение
фотона с энергиейhνnk,
если n < k
(например, переход с уровня Е1
на Е2).
Э нергия
фотона равна разности энергии электрона
на орбитах:
нергия
фотона равна разности энергии электрона
на орбитах:
Еф = hνnk = EnEk.
Новая теория строения атома позволила:
1. Рассчитать радиус первой орбиты электрона в атоме водорода (Z = 1; n = 1) первый боровский радиус
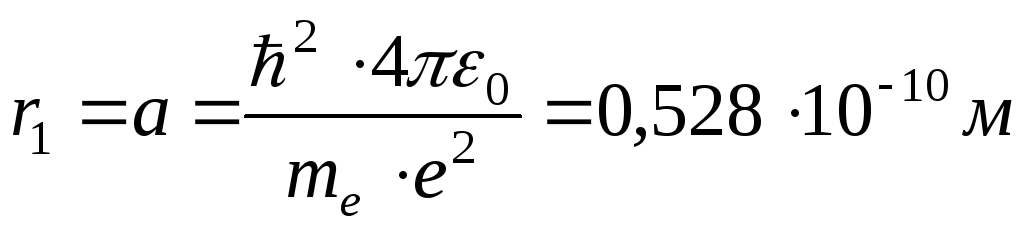 ,
,
где mе = 9,11∙1031 кг масса электрона;
е = 1,6·10–19 Кл – заряд электрона;
0 = 8,85·10–12 Ф/м – электрическая постоянная;
ħ = h/2π = 6,63·10–34 Дж/с постоянная Планка;
а также рассчитать радиус n-ой орбиты электрона для водородоподобных систем (состоящих из ядра с зарядом Ze и одного электрона)
![]() ;
n = 2,
3, …, (4.1)
;
n = 2,
3, …, (4.1)
т. е. тем самым подтвердить, что радиусы стационарных орбит электрона rn имеют дискретные значения и пропорциональны квадратам целых чисел.
2. Рассчитать энергию электрона на первой орбите в атоме водорода (Z = 1; n = 1)
![]()
а также рассчитать энергию электрона на n-ой орбите для водородоподобных систем
![]() ;
n = 2,
3, …, (4.2)
;
n = 2,
3, …, (4.2)
т. е. тем самым подтвердить, что энергия электрона Еnнаn-ой стационарной орбите принимает дискретные значения. Знак «» означает, что электрон связан в атоме силой притяжения к ядру.
Целое число n в выражениях (4.1) и (4.2) называется главным квантовым числом. Энергетическое состояние с n = 1 является основным состоянием, а соответствующий ему энергетический уровень основным уровнем. Состояния с n > 1 и соответствующие им энергетические уровни называются возбуждёнными.
Экспериментальным подтверждением теории Н. Бора является спектральный анализ.
Спектральный анализ это исследование спектров излучения (поглощения) различных веществ.
О птическим
спектром
называется
распределение по частотам (или длинам
волн) интенсивности оптического излучения
некоторого тела (спектр излучения) или
интенсивности поглощения при его
прохождении через вещество (спектр
поглощения). Спектры делятся на три вида
– линейчатые, полосатые и сплошные
(рисунок 4.3).
птическим
спектром
называется
распределение по частотам (или длинам
волн) интенсивности оптического излучения
некоторого тела (спектр излучения) или
интенсивности поглощения при его
прохождении через вещество (спектр
поглощения). Спектры делятся на три вида
– линейчатые, полосатые и сплошные
(рисунок 4.3).
Линейчатыеспектры излучения выглядят как узкие отдельно стоящие цветные линии определённой интенсивности, разделенные тёмными промежутками (рисунок 4.3а).
Линейчатый вид спектра характерен для веществ, находящихся в атомарном состоянии. Это обусловлено тем, что в изолированных атомах при переходе электрона со стационарной орбиты с номером nна стационарную орбиту с номеромkпроисходит излучение фотона с энергиейhνnk,равной разности энергии электрона на орбитах:
Еф = hνnk = EnEk.
Поскольку энергия электрона Еn,Еkможет принимать только дискретные значения, то и энергия испущенного фотона принимает только дискретные значения, а, следовательно, частота (длина волны) излучения атома имеет дискретный ряд значений (узкие отдельно стоящие цветные линии). Исследования спектров излучения разреженных газов (то есть спектров излучения отдельных атомов) показали, что каждому газу присущ определенный линейчатый спектр.
Полосатые спектры представляют собой множество тесно расположенных линий, образующих группы – полосы, разделённые темными промежутками (рисунок 4.3б). Полосатые спектры излучаются молекулами. Спектральные линии в молекулярном спектре, как и в спектрах атомов, возникают при изменении энергии молекулы. Однако, в отличие от атомов, для молекул помимо поступательного движения характерно наличие ещё двух видов движения: колебания отдельных атомов относительно положения равновесия и вращение всей молекулы вокруг оси. Тогда энергия молекулы, определяющая её спектр, будет состоять из трёх частей
E = Еэ + Ек + Евр,
где Еэ – энергия движения электронов в атомах,
Ек – энергия колебательного движения атомов,
Евр – энергия вращательного движения молекулы.
В связи с этим частоты спектральных линий, испускаемых молекулами, могут соответствовать не только переходам с одного электронного уровня на другой (электронные спектры), но и переходам с одного колебательного (вращательного) уровня на другой (колебательные (вращательные) спектры). Корме того, возможны комбинации этих переходов, дающие электронно-колебательные и колебательно-вращательные спектры. Поэтому совокупный спектр молекул весьма сложный и состоит из групп настолько тесно расположенных линий, что линии в группах сливаются в полосы.
Сплошные спектры представляют собой непрерывную последовательность спектральных цветов плавно переходящих друг в друга (рисунок 4.3в). Сплошные спектры излучаются нагретыми твёрдыми телами. Сплошной спектр содержит волны всех частот видимого света и поэтому выглядит как цветная полоса с плавным переходом от одного цвета к другому в следующем порядке: красный, оранжевый, желтый, зеленый, голубой, синий, фиолетовый.
С помощью спектрального анализа происходит изучение химического состава вещества (по положению спектральных линий и полос), а также концентрации атомов, входящих в его состав (по интенсивности спектральных линий). С помощью спектрального анализа удаётся определять очень малое количество данного химического элемента в составе сложного вещества. Примером может служить определение химического состава Солнца и звёзд.
Спектральный анализ был открыт в 1860 г. немецкими физиками Г. Кирхгофом и Р. Бунзеном. Они установили, что спектр пламени газовой горелки зависит только от введённого металла, причём спектр каждого металла строго постоянен. Обнаружив в спектрах некоторых образцов новые незнакомые линии, они открыли новые химические элементы – рубидий (rubidus – красный) и цезий (ceasius – голубой). Позже другие исследователи открыли ещё четыре новые элемента: таллий, индий, галлий и гелий, причём гелий был впервые обнаружен при изучении спектра Солнца и только спустя четверть века был обнаружен на Земле.
На основе экспериментальных спектральных исследований (ещё до создания квантовой теории атомов) в 1885 г. швейцарский физик И. Бальмер подобрал эмпирическую формулу, определяющую закономерность расположения спектральных линий атома водорода в видимой области:
![]()
где R=1,10∙107 м1 постоянная Ридберга.
Опыт показал, что спектральные линии атома водорода в видимой области спектра представляют собой группу (серию) линий, называемую серией Бальмера.
В дальнейшем (начало ХХ века) в спектре атома водорода было обнаружено еще несколько серий, например, в ультрафиолетовой области спектра серия Лаймана, в инфракрасной области спектра серия Пашена и другие.
Все серии линий в спектре атома водорода могут быть описаны – обобщенной формулой Бальмера:
![]() ,
,
где k = 1; 2; 3; число, определяющее серию линий;
n > k число, определяющее отдельные линии серии.
Спектральный анализ широко применяется в науке и технике: в геологии – для определения химического состава земной коры, в промышленности (химической, нефтеперерабатывающей, металлургической, машиностроительной, фармацевтической) – для определения химического состава веществ, в экологии – для контроля объектов окружающей среды (воды, воздуха, почв) и т.д. Чувствительность спектрального анализа очень высока и достигает 10–5 – 10–6 %.
Разложение излучения источников света в спектр осуществляется с помощью специальных оптических приборов – спектральных аппаратов.
